Аммиак относится к группе химических веществ. Получение аммиака в промышленности. Получение аммиака в лаборатории
Аммиак – NH 3
Аммиак
(в европейских языках его название звучит как «аммониак») своим
названием обязан оазису Аммона в Северной Африке, расположенному на
перекрестке караванных путей. В жарком климате мочевина (NH 2) 2 CO,
содержащаяся в продуктах жизнедеятельности животных, разлагается
особенно быстро. Одним из продуктов разложения и является аммиак. По
другим сведениям, аммиак получил своё название от древнеегипетского
слова амониан
. Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали нашатырь NH 4 Cl, который при нагревании испаряет аммиак.
1. Строение молекулы
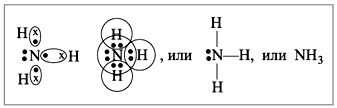
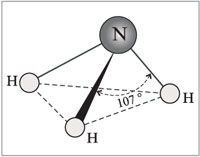
Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине . Три неспаренныхp-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать донорно-акцепторную связь с ионом водорода, образуя ион аммония NH 4 + .
Вид химической связи: ковалентная полярная, три одинарные σ - сигма связи N-H
2. Физические свойства аммиака
При нормальных условиях - бесцветный газ с резким характерным запахом (запах нашатырного спирта), почти вдвое легче воздуха, ядовит. По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это мы и воспринимаем как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи. Растворимость NH 3 в воде чрезвычайно велика - около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды.
3.
|
В лаборатории |
В промышленности |
|
Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония: NH 4 Cl + NaOH = NH 3 + NaCl + H 2 O (NH 4) 2 SO 4 + Ca(OH) 2 = 2NH 3 + CaSO 4 + 2H 2 O Внимание ! Гидроксид аммония неустойчивое основание, разлагается: NH 4 OH ↔ NH 3 + H 2 O При получении аммиака держите пробирку - приёмник дном кверху, так как аммиак легче воздуха: |
Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота: N 2(г) + 3H 2(г) ↔ 2NH 3(г) + 45,9к Дж Условия: катализатор – пористое железо температура – 450 – 500 ˚С давление – 25 – 30 МПа Это так называемый процесс Габера (немецкий физик, разработал физико-химические основы метода). |
4. Химические свойства аммиака
Для аммиака характерны реакции:
- с изменением степени окисления атома азота (реакции окисления)
- без изменения степени окисления атома азота (присоединение)
|
Реакции с изменением степени окисления атома азота (реакции окисления) N -3 → N 0 → N +2 NH 3 – сильный восстановитель. |
|
с кислородом 1. Горение аммиака (при нагревании) 4 NH 3 + 3 O 2 → 2 N 2 + 6 H 2 0 2. Каталитическое окисление амииака (катализатор Pt – Rh , температура) 4NH 3 + 5O 2 → 4NO + 6H 2 O Видео - Эксперимент " Окисление аммиака в присутствии оксида хрома" |
|
с оксидами металлов 2 NH 3 + 3CuO = 3Cu + N 2 + 3 H 2 O |
|
с сильными окислителями 2 NH 3 + 3 Cl 2 = N 2 + 6 HCl (при нагревании) |
|
аммиак – непрочное соединение, при нагревании разлагается 2NH 3 ↔ N 2 + 3H 2 |
|
Реакции без изменения степени окисления атома азота (присоединение - Образование иона аммония NH 4 + по донорно-акцепторному механизму) Видео - Эксперимент "Качественная реакция на аммиак" Видео - Эксперимент "Дым без огня" Видео - Эксперимент "Взаимодействие аммиака с концентрированными кислотами" Видео - Эксперимент "Фонтан" Видео - Эксперимент "Растворение аммиака в воде" |
5. Применение аммиака
По объемам производства аммиак занимает одно из первых мест; ежегодно во всем мире получают около 100 миллионов тонн этого соединения. Аммиак выпускается в жидком виде или в виде водного раствора – аммиачной воды, которая обычно содержит 25% NH 3 . Огромные количества аммиака далее используются для получения азотной кислоты , которая идет на производство удобрений и множества других продуктов. Аммиачную воду применяют также непосредственно в виде удобрения, а иногда поля поливают из цистерн непосредственно жидким аммиаком. Из аммиака получают различные соли аммония, мочевину, уротропин . Его применяют также в качестве дешевого хладагента в промышленных холодильных установках.
Аммиак используется также для получения синтетических волокон , например, найлона и капрона. В легкой промышленности он используется при очистке и крашении хлопка, шерсти и шелка . В нефтехимической промышленности аммиак используют для нейтрализации кислотных отходов, а в производстве природного каучука аммиак помогает сохранить латекс в процессе его перевозки от плантации до завода. Аммиак используется также при производстве соды по методу Сольве. В сталелитейной промышленности аммиак используют для азотирования – насыщения поверхностных слоев стали азотом, что значительно увеличивает ее твердость.
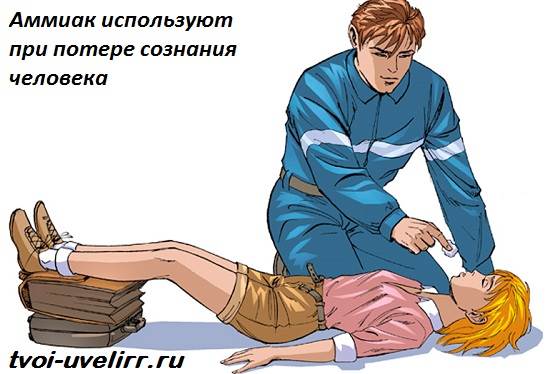
Медики используют водные растворы аммиака (нашатырный спирт) в повседневной практике: ватка, смоченная в нашатырном спирте, выводит человека из обморочного состояния. Для человека аммиак в такой дозе не опасен.
ТРЕНАЖЁРЫ
Тренажёр №1 "Горение аммиака"
Тренажёр №2 "Химические свойства аммиака"
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Осуществить превращения по схеме:
а) Азот→ Аммиак → Оксид азота (II)
б) Нитрат аммония → Аммиак → Азот
в) Аммиак → Хлорид аммония → Аммиак → Сульфат аммония
Для ОВР составить е-баланс, для РИО полные, ионные уравнения.№2. Напишите четыре уравнения химических реакций, в результате которых образуется аммиак.
Лепестки зеленеют, а – чернеют.
Флористам, как говориться, на заметку. Однако, аммиак пригождается и в других сферах деятельности. Узнаем остальные свойства вещества, ознакомимся с путями его применения.
Свойства аммиака
Работая с парами аммиака, стоит быть осторожным. При определенной концентрации смесь реагента с воздухом взрывоопасна.
К тому же, газ токсичен. «Общение» с ним чревато нервными расстройствами, ухудшением слуха, частичной потерей памяти, помутнением хрусталиков . Эти симптомы наблюдаются у людей, работающих на аммиачных производствах.
Пары аммиака всегда устремляются вверх, поскольку газ легче воздуха. Газом вещество является в обычных условиях. Для транспортировки и продажи аммиак сжижают.
Для этого нужно повышенное давление. Получают безводный концентрат. Для него существует 6221-90 ГОСТ.
Сжиженный аммиак в сосудах, все же, имеет газообразную фазу. Под давлением оба состояния вещества находятся в равновесии.
При этом, температура должна быть ниже критической, как и давление. Если будет больше 132-ух градусов и 11-ти мегапаскалей, равновесие нарушится.
Коэффициент объемного сжатия вещества в разы меньше коэффициента его расширения.
Если сосуд заполнен доверху, повышение температуры может привести к давлению в 52 мегапаскаля.
Этого достаточно, чтобы разорвать металлические швы вмещающего сосуда. Соответственно, будет взрыв.
Из концентрата аммиака можно получить раствор аммиака любой насыщенности. Хотя, человечеству пригождается и безводная версия.
Она, к примеру, является одним из удобрений. Кроме в веществе присутствует лишь водород. Последнего 3 атома, то есть, формула газа такова: — NH 3 .
Такое содержание водорода – причина отличной растворимости аммиака в воде. Другие газы этим «похвастаться» не могут.
Между аммиаком и водой образуются прочные водородные связи. Чем насыщеннее раствор, тем больше его растворяющие свойства.
По ним вещество конкурирует с этиловым спиртом, с той лишь разницей, что последний органического происхождения.
Так, аммиак водный , как и концентрат, способны растворить металлы щелочной и щелочноземельной групп.
Итогом реакций становятся темно-синие жидкости. Это результат ионизации валентных электронов и солватации.
Последнее понятие обозначает электростатический контакт между молекулами растворенных металлов и аммиака.
От нашатырного спирта запах аммиака исходит неспроста. Средство является водным раствором гидроксида аммония.
То есть, аммиак – это нашатырный спирт. Гидроксид аммония содержится и в моче, а так же, в продуктах разложения органики.
Именно поэтому, к примеру, неприятно пахнут гниющие массы со дна болот. В них разлагаются остатки растений, рыб, .
В тех же прудах аммиак, естественно, смешивается с водой. В растворе присутствует OH-группа.
Значит, смесь способна на щелочную реакцию, является слабым основанием. Растворяет героя и спирт. Аммиак не случайно смешан с ним в нашатыре.
В концентрированном виде нитрид водорода сильно преломляет свет, то есть, меняет направление его лучей.
Еще одно любопытное свойство героя статьи – кипение при минусовых температурах. Должно быть около 34-ех ниже нуля.
Если опустить температуру до 78-ми градусов, жидкость, и вовсе, затвердеет. Получаются белесые хлопья, похожие на снег. вещества имеют правильную, симметричную форму.
Добыча аммиака
Производство аммиака сводится к 100 000 000 тонн ежегодно. Примерно столько же добывают хлора. При этом, аммиак менее токсичен.
В указанный объем аммиака входят вещество, извлеченное из природных источников азота, и синтезированное в условиях.
Промышленный метод основан на соединении водорода и азота . Аммиак из них получается при температуре не ниже 500-от градусов Цельсия.
Еще одно условие: — давление в 350 атмосфер. Не обойтись и без катализатора. Он ускоряет вялотекущую реакцию, сам в нее не вступая.
Роль катализатора, обычно, выполняет губчатое . Из более дорогих помощников выбирают оксид , или .
Итоговый выход продукта при взаимодействии простых веществ равен примерно 30-35%.
Это максимум при соблюдении минимально возможной температуры и наибольшего давления. Именно такой дуэт обеспечивает эффективность реакции.
Однако, при нижней температурной планке уменьшается скорость процесса. Поддашь жару, — частично останешься без аммиака , зато, получишь его быстрее.
Синтетический метод производства аммиака практически не оставляет шансов его добыче в природе из продуктов гниения органики. Процесс этот долог.
Аммиак образуется, но быстро улетучивается. В ловушки земной коры газ попадает редко.
Обычно, аммиак понемногу испаряется, что делает природные месторождения неликвидными.
Применение аммиака
Применение вещества в сельскохозяйственной сфере уже упоминалось. Теперь, перейдем к индустрии красоты, вспомнив про аммиак для волос .
Здесь же вспомним, что раствор вещества является слабой щелочью. Отсюда назначение: — обеспечить щелочной Ph краски, в районе 10-ти.
Такая среда способствует набуханию волос, что запускает реакцию разложения перекиси водорода.
Последняя, является осветлителем, поэтому, обязательно используется в оттенках блонд.
Существует краска без аммиака . Однако, производители частично лукавят. Вместо чистого вещества применяются его производные.
Они тоже поднимают Ph до щелочного уровня, но стоят дороже. Соответственно, и краска для волос без аммиака требует затрат.

Однако, потребители готовы к ним, дабы сохранить шевелюры. Дело в том, что чистый аммиак сильнее раскрывает поры волос.
Они начинают напоминать губку, сгладить поверхность которой можно лишь дорогостоящей силиконовой косметикой, заполняющей пустоты.
Из продуктов питания выраженая щелочь – . На ее изготавление, так же, направлен синтез аммиака .
Производят его и для получения азотной кислоты. Аммиак преобразуют в оксид азота.
Последний, окисляют до диоксида. Потом, оксиды проходят абсорбцию водой. Так и получают .
Формула аммиака , как уже говорилось, лежит в основе создания взрывчатых субстанций.
Вещество нужно и на производстве холодильного оборудования. Его действие основано на испарении сжиженного газа. При этом, поглощается много тепла, что, собственно, и обеспечивает прохладу.
В ювелирном деле также не обошлось без аммиака. Его используют для очистки изделий из после полировки пастой .
Потребности человечества в аммиаке отражает тенденция его производства. Еще 30 лет назад в год формировали 70 000 000 тонн реагента.
Теперь, как указывалось в главе «Добыча», — 100 000 000. Не поменялись лишь лидеры производства. Это, по-прежнему, США и, теперь уже, .
В справочниках прошлых лет фигурирует, естественно, СССР. Что поменялась стоимость вещества, и гадать не надо. Ознакомимся с актуальным ценником на аммиак.
Цена аммиака
Аммиак купить можно оптом и в розницу. Крупные поставки осуществляют, как правило, тоннами.
За 1000 килограммов просят от 19000 рублей. Небольшие предприятия готовы продавать по килограмму, прося около 30-ти рублей.
В розницу килограммы предлагают редко, тонны не предлагают вовсе. Изучим прейскурант аптек, обратив внимание на нашатырный спирт.
Обычно, его разливают во флаконы по 40 миллилитров. Стоит такой объем от 15-ти до 31-го рубля.
Интересно, что, если встречаются флаконы на 25 и 100 миллилитров, стоят они примерно так же, от 13-ти до 55-ти рублей.
При этом, стоит учесть, что спиртовой раствор 10-процентный. Сжиженный же аммиак на оптовых поставках концентрированный.
Поэтому, промышленникам приходится задумываться о правильной транспортировке груза. Есть специальные полуприцепы с цистернами.
Возраст емкостей не должен превышать 30-ти лет. Важен и состав для цистерн, ведь аммиак растворяет многие металлы.
Учитывать приходится, так же, давление в резервуаре, температуру. Поэтому, рядом с объявлениями о продаже реагента, как правило, размещают и предложения по продаже и аренде полуприцепов. Без них не обойтись.
Жидкий
Аммиак — NH 3 , нитрид водорода, при нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта), почти вдвое легче воздуха, ядовит. Растворимость NH 3 в воде чрезвычайно велика — около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды. В холодильной технике носит название R717, где R — Refrigerant (хладагент), 7 — тип хладагента (неорганическое соединение), 17 — молекулярная масса.
Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине. Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать донорно-акцепторную связь с ионом водорода, образуяион аммония NH 4 + . Благодаря тому, что не связывающее двухэлектронное облако строго ориентировано в пространстве, молекула аммиака обладает высокой полярностью, что приводит к его хорошей растворимости в воде.
В жидком аммиаке молекулы связаны между собой водородными связями. Сравнение физических свойств жидкого аммиака с водой показывает, что аммиак имеет более низкие температуры кипения (t кип −33,35 °C) и плавления (t пл −77,70 °C), а также более низкую плотность, вязкость (вязкость жидкого аммиака в 7 раз меньше вязкости воды), проводимость и диэлектрическую проницаемость. Это в некоторой степени объясняется тем, что прочность этих связей в жидком аммиаке существенно ниже, чем у воды, а также тем, что в молекуле аммиака имеется лишь одна пара неподелённых электронов, в отличие от двух пар в молекуле воды, что не дает возможность образовывать разветвлённую сеть водородных связей между несколькими молекулами. Аммиак легко переходит в бесцветную жидкость с плотностью 681,4 кг/м³, сильно преломляющую свет. Подобно воде, жидкий аммиак сильно ассоциирован, главным образом за счёт образования водородных связей. Жидкий аммиак практически не проводит электрический ток. Жидкий аммиак — хороший растворитель для очень большого числа органических, а также для многих неорганических соединений. Твёрдый аммиак — бесцветные кубические кристаллы.
Химические свойства
- Благодаря наличию неподеленной электронной пары во многих реакциях аммиак выступает как нуклеофил или комплексообразователь. Так, он присоединяет протон, образуя ион аммония:
- Водный раствор аммиака («нашатырный спирт») имеет слабощелочную реакцию из-за протекания процесса:
- Взаимодействуя с кислотами даёт соответствующие соли аммония:
- Аммиак также является очень слабой кислотой (в 10 000 000 000 раз более слабой, чем вода), способен образовывать с металлами соли — амиды. Соединения, содержащие ионы NH 2 − , называются амидами, NH 2− — имидами, а N 3− — нитридами. Амиды щелочных металлов получают, действуя на них аммиаком:
Амиды, имиды и нитриды ряда металлов образуются в результате некоторых реакций в среде жидкого аммиака. Нитриды можно получить нагреванием металлов в атмосфере азота.
Амиды металлов являются аналогами гидроксидов. Эта аналогия усиливается тем, что ионы ОН − и NH 2 − , а также молекулы Н 2 O и NH 3 изоэлектронны. Амиды являются более сильными основаниями, чем гидроксиды, а следовательно, подвергаются в водных растворах необратимому гидролизу:
NaNH 2 + H 2 O → NaOH + NH 3 CaNH + 2H 2 O → Ca(OH) 2 + NH 3 Zn 3 N 2 + 6H 2 O → 3Zn(OH) 2 + 2NH 3
и в спиртах:
KNH 2 + C 2 H 5 OH → C 2 H 5 OK + NH 3
Подобно водным растворам щелочей, аммиачные растворы амидов хорошо проводят электрический ток, что обусловлено диссоциацией:
MNH 2 → M + + NH 2 −
Фенолфталеин в этих растворах окрашивается в красный цвет, при добавлении кислот происходит их нейтрализация. Растворимость амидов изменяется в такой же последовательности, что и растворимость гидроксидов: LiNH 2 — нерастворим, NaNH 2 — малорастворим, KNH 2 , RbNH 2 и CsNH 2 — хорошо растворимы.
- При нагревании аммиак проявляет восстановительные свойства. Так, он горит в атмосфере кислорода, образуя воду и азот. Окисление аммиака воздухом на платиновом катализаторе даёт оксиды азота, что используется в промышленности для получения азотной кислоты:
На восстановительной способности NH 3 основано применение нашатыря NH 4 Cl для очистки поверхности металла от оксидов при их пайке:
3CuO + 2NH 4 Cl → 3Cu + 3H 2 O +2HCl + N 2
Окисляя аммиак гипохлоритом натрия в присутствии желатина, получают гидразин:
2NH 3 + NaClO → N 2 H 4 + NaCl + H 2 O
- Галогены (хлор, йод) образуют с аммиаком опасные взрывчатые вещества — галогениды азота (хлористый азот, иодистый азот).
- С галогеноалканами аммиак вступает в реакцию нуклеофильного присоединения, образуя замещённый ион аммония (способ получения аминов):
- С карбоновыми кислотами, их ангидридами, галогенангидридами, эфирами и другими производными даёт амиды. С альдегидами и кетонами — основания Шиффа, которые возможно восстановить до соответствующих аминов(восстановительное аминирование).
- При 1000 °C аммиак реагирует с углём, образуя HCN и частично разлагаясь на азот и водород. Также он может реагировать с метаном, образуя ту же самую синильную кислоту:
История названия
Аммиак (в европейских языках его название звучит как «аммониак») своим названием обязан оазису Аммона в Северной Африке, расположенному на перекрестке караванных путей. В жарком климате мочевина (NH 2) 2 CO, содержащаяся в продуктах жизнедеятельности животных, разлагается особенно быстро. Одним из продуктов разложения и является аммиак. По другим сведениям, аммиак получил своё название от древнеегипетского словаамониан . Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали нашатырь NH 4 Cl, который при нагревании испаряет аммиак.
Жидкий аммиак
Жидкий аммиак, хотя и в незначительной степени, диссоциирует на ионы, в чём проявлется его сходство с водой:
2NH 3 → NH 4 + + NH 2 −
Константа самоионизации жидкого аммиака при −50 °C составляет примерно 10 −33 (моль/л)².
Жидкий аммиак, как и вода, является сильным ионизирующим растворителем, в котором растворяется ряд активных металлов: щелочные, щёлочноземельные, Mg, Al, а также Eu и Yb. Растворимость щелочных металлов в жидком NH 3 составляет несколько десятков процентов. В жидком аммиаке NH 3 также растворяются некоторые интерметаллиды, содержащие щелочные металлы, например Na 4 Pb 9 .
Разбавленные растворы металлов в жидком аммиаке окрашены в синий цвет, концентрированные растворы имеют металлический блеск и похожи на бронзу. При испарении аммиака щелочные металлы выделяются в чистом виде, а щелочноземельные — в виде комплексов с аммиаком [Э(NH 3) 6 ] обладающих металлической проводимостью. При слабом нагревании эти комплексы разлагаются на металл и NH 3 .
Растворенный в NH 3 металл постепенно реагирует с образованием амида:
2Na + 2NH 3 → 2NaNH 2 + H 2 -
Получающиеся в результате реакции с аммиаком амиды металлов содержат отрицательный ион NH 2 − , который также образуется при самоионизации аммиака. Таким образом, амиды металлов являются аналогами гидроксидов. Скорость реакции возрастает при переходе от Li к Cs. Реакция значительно ускоряется в присутствии даже небольших примесей H 2 O.
Металлоаммиачные растворы обладают металлической электропроводностью, в них происходит распад атомов металла на положительные ионы и сольватированные электроны, окруженные молекулами NH 3 . Металлоаммиачные растворы, в которых содержатся свободные электроны, являются сильнейшими восстановителями.
Комплексообразование
Благодаря своим электронодонорным свойствам, молекулы NH 3 могут входить в качестве лиганда в комплексные соединения. Так, введение избытка аммиака в растворы солей d-металловприводит к образованию их аминокомплексов:
CuSO 4 + 4NH 3 → SO 4 Ni(NO 3) 2 + 6NH 3 → (NO 3) 2
Комплексообразование обычно сопровождается изменением окраски раствора, так в первой реакции голубой цвет (CuSO 4) переходит в темно-синий (окраска комплекса), а во второй реакции окраска изменяется из зелёной (Ni(NO 3) 2) в сине-фиолетовую. Наиболее прочные комплексы с NH 3 образуют хром и кобальт в степени окисления +3.
Биологическая роль
Аммиак является конечным продуктом азотистого обмена в организме человека и животных. Он образуется при метаболизме белков, аминокислот и других азотистых соединений. Он высоко токсичен для организма, поэтому большая часть аммиака в ходе орнитинового цикла конвертируется печенью в более безвредное и менее токсичное соединение — карбамид (мочевину). Мочевина затем выводится почками, причём часть мочевины может быть конвертирована печенью или почками обратно в аммиак.
Аммиак может также использоваться печенью для обратного процесса — ресинтеза аминокислот из аммиака и кетоаналогов аминокислот. Этот процесс носит название «восстановительное аминирование». Таким образом из щавелевоуксусной кислоты получается аспарагиновая, из α-кетоглутаровой — глутаминовая и т. д.
Физиологическое действие
По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Аммиак обладает как местным, так и резорбтивным действием.
Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это мы и воспринимаем как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюнктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи. При соприкосновении сжиженного аммиака и его растворов с кожей возникает жжение, возможен химический ожог с пузырями, изъязвлениями. Кроме того, сжиженный аммиак при испарении поглощает тепло, и при соприкосновении с кожей возникает обморожение различной степени. Запах аммиака ощущается при концентрации 37 мг/м³.
Предельно допустимая концентрация в воздухе рабочей зоны производственного помещения составляет 20 мг/м³. Следовательно, если чувствуется запах аммиака, то работать без средств защиты уже опасно. Раздражение зева проявляется при содержании аммиака в воздухе 280 мг/м³, глаз — 490 мг/м³. При действии в очень высоких концентрациях аммиак вызывает поражение кожи: 7—14 г/м³ — эритематозный, 21 г/м³ и более — буллёзныйдерматит. Токсический отёк лёгких развивается при воздействии аммиака в течение часа с концентрацией 1,5 г/м³. Кратковременное воздействие аммиака в концентрации 3,5 г/м³ и более быстро приводит к развитию общетоксических эффектов. Предельно допустимая концентрация аммиака в атмосферном воздухе населённых пунктов равна: среднесуточная 0,04 мг/м³; максимальная разовая 0,2 мг/м³.
В мире максимальная концентрация аммиака в атмосфере (больше 1 мг/м³) наблюдается на Индо-Гангской равнине, в Центральной долине США и в Южно-Казахстанской области.
Применение
Аммиак относится к числу важнейших продуктов химической промышленности, ежегодное его мировое производство достигает 150 млн. тонн. В основном используется для производства азотных удобрений (нитрат и сульфат аммония, мочевина), взрывчатых веществ и полимеров, азотной кислоты, соды (по аммиачному методу) и других продуктов химической промышленности. Жидкий аммиак используют в качестве растворителя.
В холодильной технике используется в качестве холодильного агента (R717)
В медицине 10% раствор аммиака, чаще называемый нашатырным спиртом, применяется при обморочных состояниях (для возбуждения дыхания), для стимуляции рвоты, а также наружно — невралгии, миозиты, укусы насекомых, обработка рук хирурга. При неправильном применении может вызвать ожоги пищевода и желудка (в случае приёма неразведённого раствора), рефлекторную остановку дыхания (при вдыхании в высокой концентрации).
Применяют местно, ингаляционно и внутрь. Для возбуждения дыхания и выведения больного из обморочного состояния осторожно подносят небольшой кусок марли или ваты, смоченный нашатырным спиртом, к носу больного (на 0,5-1 с). Внутрь (только в разведении) для индукции рвоты. При укусах насекомых — в виде примочек; при невралгиях и миозитах — растирания аммиачным линиментом. В хирургической практике разводят в тёплой кипяченой воде и моют руки.
Поскольку является слабым основанием при взаимодействии нейтрализует кислоты.
Физиологическое действие нашатырного спирта обусловлено резким запахом аммиака, который раздражает специфические рецепторы слизистой оболочки носа и способствует возбуждению дыхательного и сосудодвигательного центров мозга, вызывая учащение дыхания и повышение артериального давления.
Получение
Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота:
N 2(г) + 3H 2(г) ↔ 2NH 3(г) + 45,9 кДж
Это так называемый процесс Габера (немецкий физик, разработал физико-химические основы метода).
Реакция происходит с выделением тепла и понижением объёма. Следовательно, исходя из принципа Ле-Шателье, реакцию следует проводить при возможно низких температурах и при высоких давлениях — тогда равновесие будет смещено вправо. Однако скорость реакции при низких температурах ничтожно мала, а при высоких увеличивается скорость обратной реакции. Проведение реакции при очень высоких давлениях требует создания специального, выдерживающего высокое давление оборудования, а значит и больших капиталовложений. Кроме того, равновесие реакции даже при 700 °C устанавливается слишком медленно для практического её использования.
Применение катализатора (пористое железо с примесями Al 2 O 3 и K 2 O) позволило ускорить достижение равновесного состояния. Интересно, что при поиске катализатора на эту роль пробовали более 20 тысяч различных веществ.
Учитывая все вышеприведённые факторы, процесс получения аммиака проводят при следующих условиях: температура 500 °C, давление 350 атмосфер, катализатор. Выход аммиака при таких условиях составляет около 30 %. В промышленных условиях использован принцип циркуляции — аммиак удаляют охлаждением, а непрореагировавшие азот и водород возвращают в колонну синтеза. Это оказывается более экономичным, чем достижение более высокого выхода реакции за счёт повышения давления.
Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония:
NH 4 Cl + NaOH = NH 3 + NaCl + H 2 O.
Обычно лабораторным способом получают получают слабым нагреванием смеси хлорида аммония с гашеной известью. 2NH 4 Cl + Ca(OH) 2 = CaCl 2 + 2NH 3 + 2H 2 O
Для осушения аммиака его пропускают через смесь извести с едким натром.
Очень сухой аммиак можно получить, растворяя в нём металлический натрий и впоследствии перегоняя. Это лучше делать в системе, изготовленной из металла под вакуумом. Система должна выдерживать высокое давление(при комнатной температуре давление насыщенных паров аммиака около 10 атмосфер) . В промышленности аммиак осушают в абсорбционных колоннах.
Аммиак в медицине
При укусах насекомых аммиак применяют наружно в виде примочек. Возможны побочные действия: при продолжительной экспозиции (ингаляционное применение) аммиак может вызвать рефлекторную остановку дыхания. Местное применение противопоказано при дерматитах, экземах, других кожных заболеваниях, а также при открытых травматических повреждениях кожных покровов. При ингаляционном применении — рефлекторная остановка дыхания, при местном применении — раздражения, дерматиты, экземы в месте аппликации. Местное применение возможно только на неповрежденную кожу. При случайном поражении слизистой оболочки глаза промыть водой (по 15 мин через каждые 10 мин) или 5 % раствором борной кислоты. Масла и мази не применяют. При поражении носа и глотки — 0,5 % раствор лимонной кислоты или натуральные соки. В случае приема внутрь пить воду, фруктовый сок, молоко, лучше — 0,5 % раствор лимонной кислоты или 1 % раствор уксусной кислоты до полной нейтрализации содержимого желудка. Взаимодействие с другими лекарственными средствами неизвестно. (Инструкция по применению)
В воде
- Галогены (хлор, йод) образуют с аммиаком опасные взрывчатые вещества - галогениды азота (хлористый азот, иодистый азот).
- С галогеноалканами аммиак вступает в реакцию нуклеофильного присоединения, образуя замещённый ион аммония (способ получения аминов):
- С карбоновыми кислотами , их ангидридами , галогенангидридами, эфирами и другими производными даёт амиды. С альдегидами и кетонами - основания Шиффа , которые возможно восстановить до соответствующих аминов (восстановительное аминирование).
- При 1000 °C аммиак реагирует с углём , образуя синильную кислоту HCN и частично разлагаясь на азот и водород. Также он может реагировать с метаном , образуя ту же самую синильную кислоту:
История названия
Аммиак (в европейских языках его название звучит как «аммониак») своим названием обязан оазису Аммона в Северной Африке , расположенному на перекрестке караванных путей. В жарком климате мочевина (NH 2) 2 CO, содержащаяся в продуктах жизнедеятельности животных, разлагается особенно быстро. Одним из продуктов разложения и является аммиак. По другим сведениям, аммиак получил своё название от древнеегипетского слова амониан . Так называли людей, поклоняющихся богу Амону . Они во время своих ритуальных обрядов нюхали нашатырь NH 4 Cl, который при нагревании испаряет аммиак.
Жидкий аммиак
Жидкий аммиак, хотя и в незначительной степени, диссоциирует на ионы (автопротолиз), в чём проявлется его сходство с водой :
Константа самоионизации жидкого аммиака при −50 °C составляет примерно 10 −33 (моль/л)².
Получающиеся в результате реакции с аммиаком амиды металлов содержат отрицательный ион NH 2 − , который также образуется при самоионизации аммиака. Таким образом, амиды металлов являются аналогами гидроксидов. Скорость реакции возрастает при переходе от Li к Cs. Реакция значительно ускоряется в присутствии даже небольших примесей H 2 O.
Металлоаммиачные растворы обладают металлической электропроводностью, в них происходит распад атомов металла на положительные ионы и сольватированные электроны, окруженные молекулами NH 3 . Металлоаммиачные растворы, в которых содержатся свободные электроны, являются сильнейшими восстановителями.
Комплексообразование
Благодаря своим электронодонорным свойствам, молекулы NH 3 могут входить в качестве лиганда в комплексные соединения. Так, введение избытка аммиака в растворы солей d-металлов приводит к образованию их аминокомплексов:
Комплексообразование обычно сопровождается изменением окраски раствора. Так, в первой реакции голубой цвет (CuSO 4) переходит в темно-синий (окраска комплекса), а во второй реакции окраска изменяется из зелёной (Ni(NO 3) 2) в сине-фиолетовую. Наиболее прочные комплексы с NH 3 образуют хром и кобальт в степени окисления +3.
Биологическая роль
Аммиак является конечным продуктом азотистого обмена в организме человека и животных. Он образуется при метаболизме белков , аминокислот и других азотистых соединений. Он высоко токсичен для организма, поэтому большая часть аммиака в ходе орнитинового цикла конвертируется печенью в более безвредное и менее токсичное соединение - карбамид (мочевину). Мочевина затем выводится почками, причём часть мочевины может быть конвертирована печенью или почками обратно в аммиак.
Аммиак может также использоваться печенью для обратного процесса - ресинтеза аминокислот из аммиака и кетоаналогов аминокислот. Этот процесс носит название «восстановительное аминирование». Таким образом из щавелевоуксусной кислоты получается аспарагиновая, из α-кетоглутаровой - глутаминовая и т. д.
Физиологическое действие
По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Аммиак обладает как местным, так и резорбтивным действием.
Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это человек и воспринимает как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюнктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи. При соприкосновении сжиженного аммиака и его растворов с кожей возникает жжение, возможен химический ожог с пузырями, изъязвлениями. Кроме того, сжиженный аммиак при испарении поглощает тепло, и при соприкосновении с кожей возникает обморожение различной степени. Запах аммиака ощущается при концентрации 37 мг/м³ .
Применение
Аммиак относится к числу важнейших продуктов химической промышленности, ежегодное его мировое производство достигает 150 млн тонн. В основном используется для производства азотных удобрений (нитрат и сульфат аммония, мочевина), взрывчатых веществ и полимеров , азотной кислоты, соды (по аммиачному методу) и других продуктов химической промышленности. Жидкий аммиак используют в качестве растворителя .
Расходные нормы на тонну аммиака
На производство одной тонны аммиака в России расходуется в среднем 1200 нм³ природного газа, в Европе - 900 нм³ .
Белорусский «Гродно Азот» расходует 1200 нм³ природного газа на тонну аммиака, после модернизации ожидается снижение расхода до 876 нм³.
Украинские производители потребляют от 750 нм³ до 1170 нм³ природного газа на тонну аммиака.
По технологии UHDE заявляется потребление 6,7 - 7,4 Гкал энергоресурсов на тонну аммиака .
Аммиак в медицине
При укусах насекомых аммиак применяют наружно в виде примочек. 10 % водный раствор аммиака известен как нашатырный спирт.
Возможны побочные действия: при продолжительной экспозиции (ингаляционное применение) аммиак может вызвать рефлекторную остановку дыхания.
Местное применение противопоказано при дерматитах, экземах, других кожных заболеваниях, а также при открытых травматических повреждениях кожных покровов.
При случайном поражении слизистой оболочки глаза промыть водой (по 15 мин через каждые 10 мин) или 5 % раствором борной кислоты. Масла и мази не применяют. При поражении носа и глотки - 0,5 % раствор лимонной кислоты или натуральные соки. В случае приема внутрь пить воду, фруктовый сок, молоко, лучше - 0,5 % раствор лимонной кислоты или 1 % раствор уксусной кислоты до полной нейтрализации содержимого желудка.
Взаимодействие с другими лекарственными средствами неизвестно.
Производители аммиака
Производители аммиака в России
| Компания | 2006, тыс. т | 2007, тыс. т |
|---|---|---|
| ОАО «Тольяттиазот»]] | 2 635 | 2 403,3 |
| ОАО НАК «Азот» | 1 526 | 1 514,8 |
| ОАО «Акрон» | 1 526 | 1 114,2 |
| ОАО «Невинномысский азот », г. Невинномысск | 1 065 | 1 087,2 |
| ОАО «Минудобрения» (г. Россошь) | 959 | 986,2 |
| КОАО «АЗОТ» | 854 | 957,3 |
| ОАО «Азот» | 869 | 920,1 |
| ОАО «Кирово-Чепецкий хим. комбинат» | 956 | 881,1 |
| ОАО Череповецкий «Азот» | 936,1 | 790,6 |
| ЗАО «Куйбышевазот» | 506 | 570,4 |
| ОАО «Газпром Нефтехим Салават» | 492 | 512,8 |
| «Минеральные удобрения» (г. Пермь) | 437 | 474,6 |
| ОАО «Дорогобуж» | 444 | 473,9 |
| ОАО «Воскресенские минеральные удобрения» | 175 | 205,3 |
| ОАО «Щекиноазот» | 58 | 61,1 |
| ООО «МенделеевскАзот» | - | - |
| Итого | 13 321,1 | 12 952,9 |
На долю России приходится около 9 % мирового выпуска аммиака. Россия - один из крупнейших мировых экспортеров аммиака. На экспорт поставляется около 25 % от общего объёма производства аммиака, что составляет около 16 % мирового экспорта.
Производители аммиака на Украине
- Облака Юпитера состоят из аммиака.
См. также
Примечания
Ссылки
- //
- // Энциклопедический словарь Брокгауза и Ефрона : В 86 томах (82 т. и 4 доп.). - СПб. , 1890-1907.
- // Энциклопедический словарь Брокгауза и Ефрона : В 86 томах (82 т. и 4 доп.). - СПб. , 1890-1907.
Аммиака. Молекулы этого газа имеют форму пирамиды, в одной из вершин которой находится атом азота. Они образуются с помощью водородных связей и характеризуются сильной полярностью. Это объясняет необычные физические свойства аммиака: его температура плавления составляет около -80 градусов. Он хорошо растворяется в воде, спиртах и других органических растворителях.
Применение аммиака
Аммиак играет важную роль в промышленности. С его помощью получают азотные удобрения, применяемые в сельском хозяйстве, азотную кислоту и даже взрывчатые вещества. Нашатырный спирт , широко применяемый медиками, также производят с помощью аммиака. Резкий запах этого газа раздражает слизистую оболочку носа и стимулирует дыхательные функции. Нашатырный спирт используют при обмороках или алкогольных отравлениях. Существует и наружное применение аммиака в медицине. Он отличный антисептик, которым хирурги обрабатывают свои руки перед операциями.
Аммиак, как продукт разложения нашатыря, используется при пайке металлов. При высокой температуре из нашатыря получается аммиак, который защищает металл от образования оксидной пленки.
Отравление аммиаком
Аммиак - ядовитое вещество. Нередко на производстве случаются отравления этим газом, которые сопровождаются удушьем, бредом и сильным возбуждением. Как помочь человеку, который попал в такую ситуацию? Сначала нужно промыть его глаза водой и надеть марлевую повязку, предварительно смоченную в слабом растворе лимонной кислоты. Затем необходимо вывести его за пределы зоны, где наблюдается высокая концентрация аммиака. Отравление возможно при концентрации около 350 мг/м³.
В случае попадания аммиака на кожу, нужно сразу же промыть пораженные участки водой. В зависимости от количества аммиака, попавшего на кожу, могут наблюдаться сильные покраснения или химические ожоги с волдырями.
На заводах, где производится аммиак, введены жесткие меры противопожарной безопасности. Дело в том, что смесь аммиака и воздуха легко воспламеняется. Емкости, где он хранится, могут легко взорваться при нагревании.
Химические свойства аммиака
Аммиак реагирует со многими кислотами. В результате такого взаимодействия получаются различные соли аммония. При реакции с многоосновными кислотами получаются два типа солей (в зависимости от количества молей аммиака).
