التركيزات القصوى المسموح بها للمواد الضارة في المسطحات المائية. MPC في البيئة المائية
صلاحية وصلاحية استخدام قوائم متعددة من دول البحر المتوسط الشريكة لـ مياه الصرف الصحيإنتاج الطلاء الكهربائي
في السنوات الاخيرةهناك بعض النمو في روسيا الإنتاج الصناعي، الأمر الذي يؤدي ، من ناحية ، إلى إحياء الإنتاج الجلفاني ، ولكن من ناحية أخرى ، مقيد بمخاطره البيئية العالية. يجب أن تعمل مرافق المعالجة الخاصة بالمؤسسات على تقليل المخاطر البيئية لإنتاج الجلفنة. ومع ذلك ، بالإضافة إلى الأسباب الموضوعية (تقنيات التنظيف القديمة ، وسوء حالة المعدات ، وما إلى ذلك) ، هناك أسباب ذاتية لعدم فعالية تدابير حماية البيئة ، وأهمها الاستخدام غير المعقول لقوائم مختلفة من البلدان المتوسطية الشريكة والقواعد الإقليمية غير المعقولة -صناعة.
بناءً على الاختلاف في أغراض استهلاك المياه ومتطلبات مستهلكي المياه المختلفين لجودة المسطحات المائية ، هناك معايير صحية وبيئية لنفس ملوثات المياه الكيميائية.
البلدان المتوسطية الشريكة الصحية هي أقصى تركيزات للمواد التي ليس لها تأثير مباشر أو غير مباشر على صحة السكان (عند تعرضها لجسم الإنسان طوال الحياة) ، ولا تسوء الظروف الصحية لاستخدام المياه. تنظم المعايير الصحية محتوى الملوثات فقط في تلك المسطحات المائية التي تستخدم للأغراض المنزلية والشرب والأغراض الثقافية والمنزلية ، بما في ذلك استخدام المياه الترفيهية ، وليس في جميع أنحاء الخزان أو في أماكن تصريف مياه الصرف الصحي ، ولكن فقط في نقاط استخدام المياه في المنطقة السكان الأقرب لمنافذ الصرف. هناك فئتان من الأسرة والشرب و استخدام المياه الثقافي والمجتمعي: الفئة الأولى تشمل استخدام المسطحات المائية كمصدر للإمداد المنزلي ومياه الشرب ، وكذلك لإمدادات المياه لشركات صناعة الشرب ؛ إلى الفئة الثانية - الاستخدام اجسام مائيةللأغراض الثقافية واليومية للسكان والترفيه والرياضة.
أدى ظهور مصادر جديدة للتلوث وتوسع جغرافيتها إلى التطور نظام مستقلمصايد الأسماك (البيئية) تهدف دول البحر المتوسط الشريكة إلى حماية المسطحات المائية كأساس لتربية الأسماك وصيد الأسماك بشكل منظم. هناك فئتان لاستخدام المياه في مصايد الأسماك: الفئة الأولى تشمل استخدام المسطح المائي لحفظ وتكاثر أنواع الأسماك القيمة شديدة الحساسية للأكسجين ؛ إلى الثاني - استخدام المسطح المائي للإنتاج التجاري للأسماك والحيوانات والنباتات المائية الأخرى.
إذا تم استخدام الخزان لأغراض صيد الأسماك وإمداد السكان بالمياه ، فسيتم توجيههم وفقًا للمعايير الأكثر صرامة.
عند تخصيص مسطح مائي لفئة معينة ، تسترشد هيئات لجنة الدولة للمصايد بمرسوم مجلس الوزراء لاتحاد الجمهوريات الاشتراكية السوفياتية رقم 1045 المؤرخ 15 سبتمبر 1958 ، والذي بموجبه: "جميع الخزانات وملحقاتها تعتبر المياه المستخدمة أو التي يمكن استخدامها في الإنتاج التجاري للأسماك والحيوانات المائية والنباتات الأخرى أو مهمة لتكاثر الأرصدة السمكية التجارية ، مستودعات سمكية. وبالتالي ، وفقًا لمثل هذا التعريف الواسع غير المبرر ، يتم تصنيف جميع المسطحات المائية لدولة ضخمة مثل روسيا على أنها مسطحات مائية سمكية ، أي أنه من المفترض أن سطح الماءيتم الحفاظ على تصنيع المعدات الأصلية لروسيا واستنساخها الأنواع القيمةالأسماك ذات الحساسية العالية للأكسجين ، أو تستخدم للإنتاج التجاري للأسماك والحيوانات والنباتات المائية الأخرى. اتضح أنه في جميع الحالات ، يجب التحكم في المياه السطحية وفقًا لنظام MAC الخاص بالمسطحات المائية لمصايد الأسماك (MAC RH).
بالإضافة إلى ذلك ، نظرًا لأن جميع منافذ المياه العادمة تقريبًا تقع داخل حدود المستوطنة ، وفقًا للقواعد والمعايير الخاصة بحماية المياه السطحية ، فإن معايير الحد الأقصى لتلوث المسطحات المائية تنطبق على المياه المصروفة نفسها ، أي ، لا يؤخذ في الاعتبار تخفيف المخلفات السائلة في مياه الخزان والقدرة الاستيعابية للخزانات. وبالتالي ، فإن جودة المياه العادمة التي يتم تصريفها في المسطحات المائية تخضع لمتطلبات قائمة MPC RH في كل مكان.
علاوة على ذلك ، فإن هذه المتطلبات لا تُفرض فقط على النفايات السائلة الحضرية التي يتم تصريفها في المسطحات المائية ، ولكن أيضًا على النفايات السائلة التي تدخل مجاري المدينة من الشركات. وبالتالي ، لا يقتصر الأمر على تخفيف مياه الصرف الصناعي عن طريق المناطق الحضرية النفايات المنزلية، ولكن أيضًا ينقل عدم كفاءة تشغيل محطات المعالجة الحضرية إلى أكتاف الشركات. يؤدي هذا بشكل غير معقول وغير ضروري إلى تشديد متطلبات جودة المياه العادمة من المؤسسات ويدفعها إلى طريق مسدود بسبب الإنجاز المستحيل الواضح لهذه البلدان المتوسطية الشريكة باستخدام تقنيات معالجة مياه الصرف الصحي القياسية للإنتاج الجلفاني.
دعنا ندعم هذا التأكيد.
عمليًا في جميع محطات معالجة مياه الصرف الصحي لإنتاج الجلفنة ، يتم استخدام طريقة الكاشف. الملوثات الرئيسية لمياه الصرف الصحي هي أيونات المعادن الثقيلة. يتم عرض التركيز المتبقي لأيونات المعادن الثقيلة ، المحسوب من ناتج قابلية ذوبان الهيدروكسيدات المقابلة والملاحظة في الممارسة العملية ، في الجدول 1.
الجدول 1. كفاءة طريقة الكاشف لمعالجة مياه الصرف الصحي من المعادن الثقيلة
| أيون المعادن الثقيلة | تم حساب تركيز أيون المعدن المتبقي من منتج الذوبان ، مجم / لتر | لوحظ تركيز أيون المعدن المتبقي في الممارسة العملية عند درجة الحموضة 8.5-9.0 ، ملجم / لتر | MPC RH ، ملغم / لتر |
| Fe2 + | 0,44 | 0,3 - 1 | 0,1 |
| Fe3 + | 0.21 10 -4 | 0,3 - 0,5 | 0,1 |
| * Cr3 + | 0.13 10 -2 | 0,05 - 0,1 | 0,07 |
| Cu2 + | 0,024 | 0,1 - 0,15 | 0,001 |
| Ni2 + | 1,47 | 0,25 - 0,75 | 0,01 |
| Zn2 + | 0,17 | 0,05 - 0,1 | 0,01 |
| القرص المضغوط 2+ | 2,62 | 2,5 | 0,005 |
| آل 3+ | 0.23 10 -3 | 0,1 - 0,5 | 0,04 |
* - لم ترد بيانات عن Cr 6+ لأن في مرحلة تحييد النفايات السائلة المحتوية على الكروم ، يستمر تفاعل الاختزال الكيميائي لـ Cr 6+ إلى Cr 3+ تمامًا.
أرز. 1. مخطط تطبيق قوائم مختلفة من دول البحر المتوسط الشريكة في مياه الصرف الصحي
وبالتالي ، هناك ثلاث نقاط على طول نظام الصرف الصحي المحلي في أي مدينة حيث يجب تطبيق قوائم MPC المختلفة على مياه الصرف الصحي (الشكل 1) ، كما هو الحال في موسكو (كما هو موضح أدناه):
1 - عند الخروج من المؤسسة - أقصى تركيز مواد مؤذيةفي مياه الصرف الصحي المقبولة في نظام الصرف الصحي بالمدينة ؛
2- قبل دخول محطات المدينة المعالجة البيولوجية- التركيز المسموح به للمواد الضارة في مياه الصرف الصحي المقبولة للمعالجة البيولوجية ؛
3 - في موقع تصريف المياه العادمة إلى خزان طبيعي وفقًا لفئته - إما MPC للمواد الضارة في مياه المسطحات المائية لأغراض الشرب والأغراض الثقافية ، أو MPC في مياه المسطحات المائية لأغراض مصايد الأسماك (MAC RH).
ضع في اعتبارك استخدام قوائم مختلفة من البلدان المتوسطية الشريكة للمعادن الثقيلة في مياه الصرف باستخدام مثال موسكو (الشكل 2).
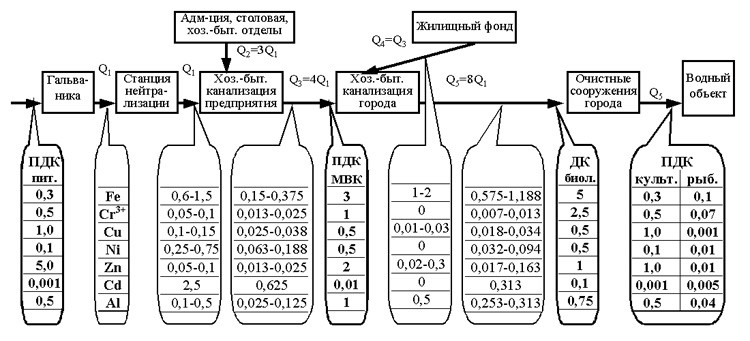
أرز. الشكل 2. مخطط التغيرات في تركيز أيونات المعادن الثقيلة في مياه الصرف الصحي من ورشة الطلاء بالكهرباء إلى الجسم المائي
(س هو حجم مياه الصرف الصحي)
في المؤسسة ، تخضع المياه العادمة الناتجة عن الإنتاج الجلفاني (س 1) المحتوية على أيونات المعادن الثقيلة للمعالجة الكيميائية في محطة التحييد ، ونتيجة لذلك يصل تركيز أيونات المعادن الثقيلة إلى القيم الموضحة في الجدول 1. بعد المعالجة ، يتم تخفيف المياه العادمة الناتجة عن الإنتاج الجلفاني (س 1) بمياه الصرف المنزلية (س 2) من الأقسام الإدارية والمنزلية وغيرها من أقسام المؤسسة التي لا تلوث مياه الصرف الصحي بأيونات المعادن الثقيلة. كقاعدة عامة ، يبلغ حجم استهلاك المياه (التخلص من المياه) لإنتاج الطلاء الكهربائي حوالي 25 ٪ من إجمالي استهلاك المياه (التخلص من المياه) للمؤسسة (س 3). وبالتالي ، فإن تركيز أيونات المعادن الثقيلة في منفذ الشركة أقل بأربع مرات من تركيزها في مياه الصرف الصحي الجلفانية التي مرت عبر مرافق المعالجة. مع الكفاءة (التصميم) العادية لمرافق المعالجة ، سيكون التركيز الفعلي للمعادن الثقيلة في المجاري المنزلية عند مخرج المؤسسة (Q 3): Fe 2+ 0.075-0.250 mg / l، Fe 3+ 0.075- 0.125 مجم / لتر (مجموع الجنين 0.150-0.375 مجم / لتر) Cr 3+ 0.013-0.025 مجم / لتر ، Cu 2+ 0.025-0.038 مجم / لتر ، Ni 2+ 0.063-0.188 مجم / لتر ، Zn 2+ 0.013- 0.025 ملجم / لتر ، Cd 2+ 0.625 ملجم / لتر ، Al 3+ 0.025-0.125 ملجم / لتر.
وفقًا لـ "قواعد قبول مياه الصرف الصناعي في نظام الصرف الصحي لمدينة موسكو (مؤقت)" رقم 127 ، التي تمت الموافقة عليها بقرار من اللجنة التنفيذية لمجلس موسكو في 20 يناير 1984 ، حدد Mosvodokanal التركيزات القصوى التالية من المعادن الثقيلة في مياه الصرف الصحي المقبولة في نظام الصرف الصحي بالمدينة (في الشكل 2 MPC MVK): Fetot. 3.0 ملغم / لتر ؛ Cr 3+ 1.0 مجم / لتر ؛ النحاس 2+ 0.5 ملغم / لتر ؛ Ni 2+ 0.5 مجم / لتر ؛ Zn 2+ 2.0 مجم / لتر ؛ Cd 2+ 0.01 مجم / لتر ؛ Al 3+ 1.0 مجم / لتر.
وهكذا ، في موسكو ، فإن مياه الصرف الصحي القادمة من المؤسسات في نظام الصرف الصحي البلدية ، مع كفاءة (تصميم) عادية لتشغيل محطات معالجة مياه الصرف الصحي لمعالجة مياه الصرف من الإنتاج الجلفاني ، تلبي متطلبات MPC (باستثناء الكادميوم) التي أنشأتها Mosvodokanal . يتم تقليل تركيز الكادميوم في مياه الصرف الصحي للمؤسسات في موسكو من خلال الحد من استخدام الكادميوم وفقًا لمرسوم حكومة موسكو رقم 893 بتاريخ 05.11.96.
في الصرف الصحي المنزلي بالمدينة ، يتم خلط مياه الصرف الصحي من المؤسسات (س 3) بمياه الصرف الصحي المنزلية من مخزون المساكن بالمدينة (س 4) ، حيث تكون التركيزات المحتملة للمعادن الثقيلة كما يلي: فيتوت. 1-2 ملغم / لتر ؛ Cr 3+ 0 مجم / لتر ؛ النحاس 2+ 0.01-0.03 ملغم / لتر ؛ Ni 2+ 0 مجم / لتر ؛ Zn 2+ 0.02-0.3 ملجم / لتر ؛ Cd 2+ 0 مجم / لتر ؛ Al 3+ 0.5 مجم / لتر. شريطة أن يصل الحجم اليومي لمياه الصرف الصناعي إلى حد أقصى قدره 50٪ من إجمالي تدفق مياه الصرف الصحي في المدينة ، فإن تركيز المعادن الثقيلة في النفايات السائلة المختلطة ![]() ليس أكثر من: Fegen. - 0.575-1.188 ملغم / لتر ؛ Cr 3+ - 0.007-0.013 ملغم / لتر ؛ النحاس 2+ - 0.018-0.034 ملغم / لتر ؛ Ni 2+ - 0.032-0.094 ملغم / لتر ؛ Zn 2+ - 0.017-0.163 ملغم / لتر ؛ Cd 2+ - 0.313 ملغم / لتر ؛ Al 3+ - 0.253-0.313 ملغم / لتر.
ليس أكثر من: Fegen. - 0.575-1.188 ملغم / لتر ؛ Cr 3+ - 0.007-0.013 ملغم / لتر ؛ النحاس 2+ - 0.018-0.034 ملغم / لتر ؛ Ni 2+ - 0.032-0.094 ملغم / لتر ؛ Zn 2+ - 0.017-0.163 ملغم / لتر ؛ Cd 2+ - 0.313 ملغم / لتر ؛ Al 3+ - 0.253-0.313 ملغم / لتر.
يتم إرسال النفايات السائلة المختلطة (Q5) مع هذا التركيز من المعادن الثقيلة إلى محطات المعالجة البيولوجية البلدية. وفق قواعد القبول المياه الصناعيةفي أنظمة الصرف الصحي المستوطنات"التركيز المسموح به للمعادن الثقيلة في مياه الصرف الصحي المقبولة للمعالجة البيولوجية هو: مجموع الجنين 5.0 ملغم / لتر ؛ Cr 3+ 2.5 ملغم / لتر ؛ النحاس 2+ 0.5 ملغم / لتر ؛ Ni 2+ 0، 5 mg / l، Zn 2+ 1.0 مجم / لتر ، Cd 2+ 0.1 مجم / لتر ، Al 3+ 0.75 مجم / لتر ومياه الصرف المنزلية ، تلبي قائمة التركيزات المسموح بها من المعادن الثقيلة (باستثناء الكادميوم) للمعالجة البيولوجية.
أظهرت الممارسة أنه في عملية المعالجة البيولوجية لمياه الصرف هناك انخفاض كبير في تركيز أيونات المعادن الثقيلة (بنسبة 40-80٪) بسبب امتصاصها بواسطة الحمأة المنشطة. ولكن حتى دون أخذ ذلك في الاعتبار ، فإن النفايات السائلة الحضرية (س 5) التي تحتوي على مياه الصرف الصناعي والمنزلي ، من حيث تركيز أيونات المعادن الثقيلة ، تلبي متطلبات قائمة البلدان المتوسطية الشريكة للمواد الضارة (باستثناء الحديد والكادميوم) في الشرب المياه والأغراض الثقافية والمنزلية. يتم تحديد الفائض من محتوى الحديد في النفايات السائلة فوق MPC للأغراض الثقافية والمنزلية من خلال المساهمة الساحقة في هذا التلوث الفائض بالحديد للنفايات السائلة المحلية.
تطبيق متطلبات قائمة MPC للأغراض الثقافية والمجتمعية على مياه الصرف الصحي الحضرية صحيح منطقيًا ، بناءً على الأطروحة: "يجب التحكم في النفايات السائلة وفقًا لقائمة MPC نفسها ، والتي بموجبها يتم توفير المياه للمؤسسات والقطاع السكني يتم التحكم فيه ". علاوة على ذلك ، فإن MPC ITM في مياه الشرب (MPCp.) يتطابق عمليًا مع MPC في المياه للأغراض المنزلية والشرب والأغراض الثقافية
مع الأخذ في الاعتبار حقيقة أنه لا نهر موسكفا ولا يوزا ولا أنهار موسكو الأخرى ، مع كل الرغبة ، يمكن أن يعزى إلى المسطحات المائية السمكية ، ومتطلبات القواعد واللوائح لحماية المياه السطحية من التلوث الناتج عن يمكن تحقيق مياه الصرف الصحي الناتجة عن الإنتاج الجلفاني في موسكو تمامًا. لهذا ، من الضروري توفير عمل عاديمحطات التحييد. إذا تجاوز حجم النفايات السائلة الجلفانية 25 ٪ من إجمالي استهلاك المياه للمؤسسة ، فمن أجل تلبية هذه المتطلبات ، من الضروري تقليل استهلاك المياه للغسيل في ورش الجلفنة و / أو إدخال تركيبات محلية لتنظيف مياه الغسيل.
ومع ذلك ، فإن متطلبات قائمة MPC لخزانات مصايد الأسماك يتم تطبيقها عالميًا على مياه الصرف الصحي التي يتم تصريفها في المسطحات المائية ، وحتى على مياه الصرف الصحي من الشركات التي تدخل مجاري المدينة ، مما يجعل في الواقع من المستحيل تصريف مياه الشرب في مياه الصرف الصحي دون معالجة. عبثية متطلبات معالجة مياه الصرف الصحي من المؤسسات إلى نقاء أعمق من النقاء يشرب الماء، لا يمكن أن يكون موضع شك. ومع ذلك ، فإن جميع متطلبات الشركات بشأن نقاء النفايات السائلة اليوم قد تم تقليصها في الواقع (وإن كانت في شكل مستتر إلى حد ما) إلى حقيقة أن النفايات السائلة أنظف بكثير من المياه التي يتم توفيرها للمؤسسة. هناك حجة أخرى مضادة لتطبيق MPC لخزانات مصايد الأسماك لمياه الصرف الصناعي وهي الاستحالة العملية لتحقيق مثل هذا النقاء لمياه الصرف الصحي بأي من الطرق المعروفة. "عملي" بمعنى أن استخدام العديد من طرق المعالجة اللاحقة للمياه العادمة يجعل تشغيل المؤسسات الصناعية غير مبرر اقتصاديًا. وبالتالي ، فإن حقيقة وجود الإنتاج الجلفاني كجزء من المشروع تجعله منتهكًا للتشريعات البيئية.
ويتفاقم هذا الوضع بسبب وضع القواعد الإقليمية الطوعية. في العديد من المناطق ، تكون متطلبات المياه العادمة من الشركات أكثر صرامة بكثير حتى من دول البحر المتوسط الشريكة للمسطحات المائية السمكية. على سبيل المثال ، وفقًا للبند "تعليمات لتنظيم انبعاثات (تصريفات) الملوثات في الغلاف الجوي وفي المسطحات المائية" ، التي وافق عليها نائب رئيس اتحاد الجمهوريات الاشتراكية السوفياتية Goskompriroda في 11 سبتمبر 1989 ، إذا كان التصريف الفعلي للمواد بمياه الصرف الصحي أقل من الحد الأقصى المسموح به للتصريف (MPD) ، ثم يتم أخذ التصريف الفعلي على أنه نظام التوزيع العام (البند 3.4). يتم تفسير هذا الحكم من قبل السلطات البيئية الإقليمية بطريقة مباشرة ، دون الأخذ في الاعتبار الغرض الرئيسي من إنشاء معايير MPD - عدم جواز تجاوز MPC المنشأة الوثائق المعياريةعلى المستوى الاتحادي ، أو إذا تم تجاوزها تحت تأثير العوامل الطبيعية للحفاظ (وليس التدهور) على تكوين وخصائص مياه الخزان الطبيعي. لذلك ، تسمح السلطات الإقليمية لنفسها بوضع معايير الجودة لمخلفات الشركات على مستوى عملي ماء نظيف، على سبيل المثال ، إذا لم تتشكل النفايات السائلة الملوثة أثناء أخذ العينات في المؤسسة ، لسبب ما (توقف الإنتاج ، وإصلاح المعدات ، وما إلى ذلك). إن مثل هذه الإجراءات التي تتخذها السلطات البيئية الإقليمية لإنشاء MPDs ، بما في ذلك تلك القائمة على مبدأ "من المستوى المحقق" (على سبيل المثال ، نتيجة لزيادة كفاءة مرافق المعالجة) ، تؤثر سلبًا على مصلحة الشركات في تحسين جودة مياه الصرف الصحي علاج او معاملة.
غالبًا ما تصل المبادرة الإقليمية في وضع معايير جودة مياه الصرف الصحي إلى حد العبثية. لذلك ، على سبيل المثال ، في مدينة كالوغا ، يكون MPC للزنك في مياه الصرف الصحي المرسلة إلى الصرف الصحي المنزلي 3 مرات أقل من MPC للزنك في مياه الصرف الصحي. صرف الأمطار. وهذا في ضوء حقيقة أن مصارف المياهيتم تصريفها مباشرة في نهر أوكا ، وقبل تصريفها في خزان طبيعي ، يتم تخفيف مياه الصرف المنزلي بمياه الصرف المنزلية من المباني السكنية الحضرية ومعالجتها في المناطق الحضرية مرافق معالجة.
على سبيل المثال ، يوضح الجدول 2 بيانات مقارنة عن دول البحر المتوسط الشريكة لأيونات المعادن الثقيلة في النفايات السائلة التي يتم تصريفها من قبل الشركات في مجاري المدينة ، والمستخدمة في مختلف البلدان والمدن.
يوضح الجدول المعروض أنه ليس فقط اعتباراتنا الموضحة أعلاه ، ولكن أيضًا ممارسات البلدان الأخرى تُظهر الصلابة الشديدة غير المعقولة لمتطلبات جودة مياه الصرف الصحي من الشركات الروسية. وهذا على الرغم من حقيقة أنه ، على الرغم من وجود متطلبات أقل صرامة بآلاف المرات في أوروبا والولايات المتحدة (الجدول 2) ، في العقود الاخيرةكان هناك انتعاش لنهر الراين وانخفاض حاد في تلوث البحيرات الأمريكية العظمى ، حيث يُسمح بالفعل بالصيد التجاري ، وفي بلدنا ، حتى مع الأخذ في الاعتبار انخفاض الإنتاج الصناعي ، لم يكن هناك تقدم كبير في تحسين حالة الموارد المائية.
الجدول 2. البلدان المتوسطية الشريكة من المعادن الثقيلة في مياه الصرف الصحي التي تصرفها الشركات في الصرف الصحي الحضري ، والمستخدمة في مختلف البلدان والمدن
| مدينة البلد | Cu2 + | Zn2 + | Ni2 + | Cr3 + | Fe (إجمالي) |
| الولايات المتحدة الأمريكية | 2,07 | 1,48 | 2,38 | - | - |
| ألمانيا | 0,5 | 2 | 0,5 | - | 3 |
| النمسا | 0,5 | 2 | 0,5 | 0,5 | - |
| الاتحاد الأوروبي ، الاتحاد الأوروبي | 0,5 | 0,5 | 0,5 | 0,5 | - |
| ليتوانيا | 1 | 1 | 0,5 | 1 | - |
| بيلاروسيا ، مينسك | 1 | 5 | 0,44 | 2,5 | 3,3 |
| الاتحاد الروسي | |||||
| كيرزاخ | 0,0001 | 0,001 | 0,001 | 0,014 | 0,006 |
| كالوغا | 0,0026 | 0,0036 | 0,012 | 0,029 | 1,98 |
| متسينسك | 0,0009 | 0,04 | 0,028 | 0,01 | 0,1 |
| تولا | 0,0125 | 0,06 | 0,04 | 0,1 | 3,0 |
| قازان | 0,08 | 0,066 | 0,01 | 0,4 | 0,6 |
| نسر | 0,01 | 0,08 | 0,06 | 3,6 | 1 |
| إيجيفسك | 0,23 | 0,21 | 0,04 | 1,35 | 0,4 |
| سيرجيف بوساد | 0,73 | 0,11 | 0,14 | 2,4 | 1,2 |
| موسكو | 0,5 | 2 | 0,5 | 1 | 3 |
| MPC لمياه الشرب | 1 | 5 | 0,1 | 0,5 | 0,3 |
| MPC لخزانات المياه المنزلية والشرب واستخدامات المياه الثقافية والمنزلية | 1 | 1 | 0,1 | 0,5 | 0,3 |
| MPC لخزانات المصايد | 0,001 | 0,01 | 0,01 | 0,07 | 0,1 |
وبالتالي ، فإن النقطة ليست في التخفيض الفعلي لـ MPC في النفايات السائلة الصناعية ، ولكن في نهج مختلف للحفاظ على الجودة بيئة. في معظم البلدان الصناعية ، أنشأت مؤسسة مستخدم للمياه معايير جودة مياه الصرف الصحي التي يمكن أن تلبيها في مرافق معالجة مياه الصرف الصحي الحالية ، وهذه المعايير هي نفسها لجميع المرافق من أنواع وقدرات معينة. لذلك، المعايير المعمول بهاقابلة للتحقيق تمامًا وتهدف إلى جعل جميع مستخدمي المياه (بدون استثناء) لا يتجاوزون المعايير المعمول بها ويتحملون المسؤولية عن انتهاكاتهم. بالإضافة إلى ذلك ، عند بيعها في محطات معالجة مياه الصرف الصحي ، أكثر من تقنيات فعالةتخضع أعمال التنظيف للحوافز والإعفاءات الضريبية ، مما يجعل الشركة صاحبة مصلحة في العمل البيئي.
استحالة أساسية للتنفيذ المتطلبات التنظيميةجودة مياه الصرف الصحي في مناطق الاتحاد الروسي ، حتى عند تنفيذ معظمها التقنيات الحديثةيحول التنظيف ما يقرب من 100٪ من الشركات إلى منتهكين للقانون الطبيعي ويحرمهم تمامًا من الحافز لتحسين الوضع البيئي. المتطلبات القاسية وغير الواقعية بشكل غير معقول ورسوم التلوث غير العادلة والغرامات والعقوبات تضع الشركات على شفا الإفلاس.
كل هذا يشير إلى أنه من الضروري إجراء تغيير كبير في نظام جودة المياه وإدارة الموارد المائية على المستويين الاتحادي والإقليمي ، وكذلك تشريعات المياه. وقد أثيرت هذه القضية بشكل متكرر في الصحافة ، بما في ذلك على صفحات المجلات "إمدادات المياه والهندسة الصحية" و
العناصر الضارة هي معيار القواعد الصحية والنظافة التي تحددها قوانين الدولة. يعتبر عدم الامتثال للقيم الحدية المحددة فيه جريمة يتحمل مرتكبوها المسؤولية وفقًا للقانون. يعطي معيار MPC في الماء تعليمات حول تلك القيم الحدية للملوثات ، والتي لا يترتب على محتواها ضرر على صحة الإنسان أو الحياة.
المصادر الرئيسية للعناصر السامة هي العديد من المؤسسات العاملة في المجمع الصناعي. انبعاثاتها قوية بما يكفي للتربة والمياه. العناصر الكيميائية التي لديها التأثير السلبيفي البيئة من حولنا ، من المعتاد التقسيم إلى مجموعات اعتمادًا على درجة خطورتها على البشر. وتشمل هذه المواد الخطرة:
حالة طوارئ؛
متوسط؛
معتدل.
هناك أيضًا مجموعة من العناصر الخطرة.
تنعكس دول البحر المتوسط الشريكة في مياه مختلفة في جداول مصممة خصيصًا. هناك أيضًا العديد من الصيغ التي يسمح لك استخدامها بالحساب الحد من التسامحالسموم. يتم استخدامها من قبل المتخصصين لتنفيذ تدابير التحكم في المياه التي يستخدمها البشر. يمكن تنفيذ مثل هذه الإجراءات من قبل أي منا. للقيام بذلك ، يكفي تحليل حالة مياه الشرب في منزلك ومقارنتها معايير مقبولةالتواجد فيه عناصر مختلفة. على سبيل المثال ، يجب ألا يكون المحتوى بالملليغرام لكل لتر أعلى من:
بقايا جافة - 1000 ؛
الكبريتات - 500 ؛
كلوريدات - 350 ؛
زنك - 5 ؛
حديد - 0.3 ؛
المنغنيز - 0.1 ؛
البولي فوسفات المتبقي - 3.5.
يجب ألا يتجاوز المجموع سبعة ملليغرام لكل لتر.
أهمية عظيمةكما يتحكم في حالة التربة. إنها الأرض التي تعمل كمركب وفلتر للوصلات المختلفة. يجب أيضًا أن تتوافق دول البحر المتوسط الشريكة التي يتم تصريفها باستمرار في التربة مع المعايير ، منذ الهجرة المستمرة إليها الطبقات العليايلوث البيئة بأكملها بشدة.
حسب التربة لا يمكن أن يكون أكثر من:
0.02 ملغم / كغم من البنزابيرين ؛
3 ملغم / كغم من النحاس
130 ملغم / كغم من النترات ؛
0.3 مغ / كغ تولوين ؛
23 مجم / كجم زنك.
إذا تم تجاوز MPC في المياه ، فإن السلطات المعنية بمراقبة حالة البيئة ستحدد سبب هذه الظاهرة. في كثير من الأحيان ، مع زيادة الكمية في الطبيعة مواد كيميائيةتتأثر بالنفايات المنزلية العادية. حاليًا ، مشكلة تنظيف المسطحات المائية من مركبات الفوسفات والنيتروجين حادة بشكل خاص. يمكن استخدام ثلاث طرق مختلفة لحل هذه المشكلة:
المواد الكيميائية؛
بيولوجي؛
مزيج من أول طريقتين.
الوصول إلى القيمة القياسية لـ MPC في استخدام المياه التنظيف الكيميائييتضمن تكوين الفوسفات المعدني ، الذي يستقر في القاع ، كونه غير قابل للذوبان حاوية خاصة. تحدث هذه العملية بمساعدة الكواشف. باستخدام طريقة التنظيف الكيميائي يجد تطبيق واسععلى ال المؤسسات الصناعية. لا يجوز تنفيذ هذا العمل إلا من قبل موظفين مدربين تدريباً خاصاً.
إذا تم استخدام الفوسفور أو بكتيريا P في تنقية المياه ، فهذه الطريقة بيولوجية. هذه طريقة طبيعية حديثة لمنع فائض MPC. يتم توفير مناطق خاصة من خزانات المعالجة بالتناوب مع الهوائية و البكتيريا اللاهوائية. تستخدم هذه الطريقة في المرشحات الحيوية وخزانات الصرف الصحي وخزانات التهوية.
مزيج من البيولوجية و الطرق الكيميائيةتستخدم في أنظمة المعالجة ، حيث توجد حاجة لتسريع وتعزيز تفاعلات تحلل مياه الصرف الصحي.
مواد سامة خطيرة للغاية. في الوقت الحاضر ، يعد رصد مستويات مختلف هذه المواد أمرًا مهمًا بشكل خاص في المناطق الصناعية والحضرية.
على الرغم من أن الجميع يعرف ما هي المعادن الثقيلة ، إلا أنه لا يعرف الجميع العناصر الكيميائية التي لا تزال تندرج في هذه الفئة. هناك الكثير من المعايير التي يحدد بها علماء مختلفون المعادن الثقيلة: السمية ، والكثافة ، والكتلة الذرية ، والدورات الكيميائية الحيوية والجيوكيميائية ، والتوزيع في الطبيعة. وفقًا لمعيار واحد ، تشمل المعادن الثقيلة الزرنيخ (الفلزات) والبزموت (معدن هش).
حقائق عامة عن المعادن الثقيلة
من المعروف أن أكثر من 40 عنصرًا مصنفة على أنها معادن ثقيلة. لديهم كتلة ذرية أكبر من 50 au. قد يبدو غريبًا أن هذه العناصر شديدة السمية حتى عند التراكم المنخفض للكائنات الحية. V ، Cr ، Mn ، Fe ، Co ، Ni ، Cu ، Zn ، Mo ... Pb ، Hg ، U ، Th ... كلهم يقعون في هذه الفئة. حتى مع سميتها ، فإن العديد منها مهم بصرف النظر عن الكادميوم والزئبق والرصاص والبزموت التي لم يتم العثور على دور بيولوجي لها.
وفقًا لتصنيف آخر (وهو N. Reimers) ، فإن المعادن الثقيلة هي عناصر لها كثافة أكبر من 8 جم / سم 3. وبالتالي ، سيكون هناك عدد أقل من هذه العناصر: Pb ، Zn ، Bi ، Sn ، Cd ، Cu ، Ni ، Co ، Sb.
نظريًا ، يمكن تسمية المعادن الثقيلة بالجدول الدوري الكامل للعناصر بدءًا من الفاناديوم ، لكن الباحثين أثبتوا لنا أن هذا ليس صحيحًا تمامًا. تعود هذه النظرية إلى حقيقة أنه ليس كلهم موجودون في الطبيعة ضمن الحدود السامة ، والارتباك في العمليات البيولوجية يكون ضئيلًا بالنسبة للكثيرين. هذا هو السبب في أن الكثيرين يدرجون فقط الرصاص والزئبق والكادميوم والزرنيخ في هذه الفئة. لا تتفق لجنة الأمم المتحدة الاقتصادية لأوروبا مع هذا الرأي وتعتبر أن المعادن الثقيلة هي الزنك والزرنيخ والسيلينيوم والأنتيمون. يعتقد نفس N. Reimers أنه من خلال إزالة العناصر النادرة والنبيلة من الجدول الدوري ، تبقى المعادن الثقيلة. لكن هذه أيضًا ليست قاعدة ، يضيف آخرون الذهب والبلاتين والفضة والتنغستن والحديد والمنغنيز إلى هذه الفئة. لهذا السبب أخبرك أنه لا يزال غير واضح بشأن هذا الموضوع ...
مناقشة توازن الأيونات مواد مختلفةفي المحلول ، سنجد أن قابلية ذوبان هذه الجسيمات مرتبطة بعدة عوامل. عوامل الذوبان الرئيسية هي الرقم الهيدروجيني ، ووجود الروابط في المحلول ، وإمكانية الأكسدة والاختزال. يشاركون في عمليات أكسدة هذه العناصر من حالة أكسدة إلى أخرى ، حيث تكون قابلية ذوبان الأيون في المحلول أعلى.
اعتمادًا على طبيعة الأيونات ، يمكن أن تحدث عمليات مختلفة في المحلول:
- التحلل المائي،
- معقدات بروابط مختلفة ؛
- البلمرة المائي.
بسبب هذه العمليات ، يمكن أن تترسب الأيونات أو تظل مستقرة في المحلول. تعتمد الخصائص التحفيزية لعنصر معين وتوافره للكائنات الحية على هذا.
العديد من المعادن الثقيلة تشكل مجمعات مستقرة إلى حد ما مع المواد العضوية. هذه المجمعات هي جزء من آلية هجرة هذه العناصر في البرك. تقريبًا جميع مخلّبات المعادن الثقيلة مستقرة في المحلول. أيضا ، مجمعات أحماض التربة بالأملاح معادن مختلفة(الموليبدينوم والنحاس واليورانيوم والألومنيوم والحديد والتيتانيوم والفاناديوم) لها قابلية ذوبان جيدة في البيئات المحايدة والقلوية قليلاً والحمضية قليلاً. هذه الحقيقة مهمة للغاية ، لأن مثل هذه المجمعات يمكن أن تنتقل في الحالة المنحلة إلى مسافات طويلة. الموارد المائية الأكثر ضعفاً هي المسطحات المائية السطحية قليلة المعادن ، حيث لا يحدث تكوين مثل هذه المجمعات الأخرى. لفهم العوامل التي تنظم مستوى عنصر كيميائي في الأنهار والبحيرات ، وتفاعلها الكيميائي ، والتوافر البيولوجي والسمية ، من الضروري معرفة ليس فقط المحتوى الكلي ، ولكن أيضًا نسبة الأشكال الحرة والمحدودة من المعدن.
نتيجة لهجرة المعادن الثقيلة إلى مجمعات معدنية في المحلول ، يمكن أن تحدث العواقب التالية:
- أولاً ، يزداد تراكم أيونات عنصر كيميائي بسبب انتقال هذه الأيونات من رواسب القاع إلى المحاليل الطبيعية ؛
- ثانيًا ، هناك إمكانية لتغيير نفاذية الغشاء للمجمعات الناتجة ، على عكس الأيونات التقليدية ؛
- أيضًا ، قد تختلف سمية عنصر في الشكل المعقد عن الشكل الأيوني المعتاد.
على سبيل المثال ، الكادميوم والزئبق والنحاس في الأشكال المخلبة أقل سمية من الأيونات الحرة. لهذا السبب من الخطأ التحدث عن السمية ، التوافر البيولوجي، التفاعل الكيميائي فقط من خلال المحتوى الكلي لعنصر معين ، مع عدم مراعاة نسبة الأشكال الحرة والمقيدة للعنصر الكيميائي.
من أين تأتي المعادن الثقيلة في بيئتنا؟ قد تكون أسباب وجود هذه العناصر هي مياه الصرف الصحي من مختلفة منشأت صناعيةتعمل في مجال المعادن الحديدية وغير الحديدية والهندسة الميكانيكية والجلفنة. توجد بعض المواد الكيميائية في المبيدات والأسمدة وبالتالي يمكن أن تكون مصدر تلوث للأحواض المحلية.
وإذا أدخلت أسرار الكيمياء ، فإن السبب الرئيسي في زيادة مستوى الأملاح الذائبة للمعادن الثقيلة هو المطر الحمضي (التحميض). يستلزم انخفاض حموضة البيئة (انخفاض في الرقم الهيدروجيني) انتقال المعادن الثقيلة من المركبات ضعيفة الذوبان (الهيدروكسيدات ، والكربونات ، والكبريتات) إلى المركبات القابلة للذوبان بسهولة (النترات ، والكبريتات ، والنتريت ، والبيكربونات ، والكلوريدات) في التربة المحلول.
الفاناديوم (الخامس)
تجدر الإشارة أولاً وقبل كل شيء إلى أن التلوث بهذا العنصر بالوسائل الطبيعية أمر غير محتمل ، لأن هذا العنصر منتشر جدًا في قشرة الأرض. في الطبيعة ، يوجد في الأسفلت ، القار ، الفحم ، خامات الحديد. النفط مصدر مهم للتلوث.
محتوى الفاناديوم في الخزانات الطبيعية
تحتوي الخزانات الطبيعية على كمية ضئيلة من الفاناديوم:
- في الأنهار - 0.2 - 4.5 ميكروغرام / لتر ،
- في البحار (في المتوسط) - 2 ميكروغرام / لتر.
تعتبر المجمعات الأنيونية (V 10 O 26) 6- و (V 4 O 12) 4- مهمة جدًا في عمليات انتقال الفاناديوم في الحالة الذائبة. تعتبر معقدات الفاناديوم القابلة للذوبان مع المواد العضوية ، مثل الأحماض الدبالية ، مهمة جدًا أيضًا.
أقصى تركيز مسموح به من الفاناديوم للبيئة المائية
الفاناديوم بجرعات عالية ضار جدا للإنسان. أقصى تركيز مسموح به للبيئة المائية (MPC) هو 0.1 مجم / لتر ، وفي أحواض المصايد ، يكون MPC لمزرعة الأسماك أقل - 0.001 مجم / لتر.
البزموت (ثنائي)
بشكل أساسي ، يمكن أن يدخل البزموت الأنهار والبحيرات نتيجة لعمليات ترشيح المعادن التي تحتوي على البزموت. هناك أيضًا مصادر تلوث من صنع الإنسان بهذا العنصر. يمكن أن تكون هذه مصانع للزجاج والعطور والأدوية.
محتوى البزموت في الخزانات الطبيعية
- تحتوي الأنهار والبحيرات على أقل من ميكروجرام من البزموت لكل لتر.
- و هنا المياه الجوفيةقد تحتوي حتى على 20 ميكروغرام / لتر.
- في البحار ، لا يتجاوز البزموت ، كقاعدة عامة ، 0.02 ميكروغرام / لتر.
أقصى تركيز مسموح به من البزموت للبيئة المائية
أقصى تركيز مسموح به من البزموت للبيئة المائية هو 0.1 مجم / لتر.
الحديد (Fe)
حديد - عنصر كيميائيليس نادرًا ، فهو موجود في العديد من المعادن والصخور ، وبالتالي يكون مستوى هذا العنصر في المكامن الطبيعية أعلى من المعادن الأخرى. يمكن أن يحدث نتيجة لعمليات التجوية. الصخوروتدمير هذه الصخور وانحلالها. بتكوين مجمعات مختلفة بمواد عضوية من محلول ، يمكن أن يكون الحديد في حالة غروانية ومذابة ومعلقة. من المستحيل عدم ذكر المصادر البشرية للتلوث بالحديد. تنحرف مياه الصرف الصحي الناتجة عن مصانع التعدين والمعادن والطلاء والورنيش والنسيج في بعض الأحيان بسبب زيادة الحديد.
كمية الحديد في الأنهار والبحيرات تعتمد على التركيب الكيميائيالمحلول ودرجة الحموضة وجزئيًا على درجة الحرارة. يزيد حجم الأشكال الموزونة من مركبات الحديد عن 0.45 ميكروغرام. المواد الرئيسية التي تشكل جزءًا من هذه الجسيمات هي معلقات بمركبات الحديد الممتصة وهيدرات أكسيد الحديد والمعادن الأخرى التي تحتوي على الحديد. تعتبر الجسيمات الأصغر ، أي الأشكال الغروية من الحديد ، مع مركبات الحديد المذابة. يتكون الحديد في الحالة المذابة من الأيونات والمركبات المائية والمجمعات. اعتمادًا على التكافؤ ، يُلاحظ أن Fe (II) يهاجر في شكل أيوني ، بينما يظل Fe (III) في حالة مذابة في غياب مجمعات مختلفة.
في توازن مركبات الحديد في محلول مائي ، فإن دور عمليات الأكسدة ، الكيميائية والكيميائية الحيوية (بكتيريا الحديد) ، مهم جدًا أيضًا. هذه البكتيريا مسؤولة عن انتقال أيونات الحديد (II) إلى حالة الحديد (III). تميل مركبات الحديد إلى التحلل المائي وترسيب Fe (OH) 3. يميل كل من Fe (II) و Fe (III) إلى تكوين معقدات هيدروكسو من النوع - ، + ، 3+ ، 4+ ، + ، اعتمادًا على حموضة المحلول. في الظروف الطبيعيةفي الأنهار والبحيرات ، يرتبط الحديد (III) بمختلف المواد العضوية وغير العضوية المذابة. عندما يكون الرقم الهيدروجيني أكبر من 8 ، يتحول Fe (III) إلى Fe (OH) 3. الأشكال الغروية لمركبات الحديد هي الأقل دراسة.
محتوى الحديد في المياه الطبيعية
في الأنهار والبحيرات ، يتقلب مستوى الحديد عند مستوى n * 0.1 مجم / لتر ، ولكن يمكن أن يرتفع بالقرب من المستنقعات إلى عدة مجم / لتر. يتركز الحديد في المستنقعات على شكل أملاح هيوميت (أملاح الأحماض الدبالية).
تحتوي الخزانات الجوفية ذات الأس الهيدروجيني المنخفض على كميات قياسية من الحديد - تصل إلى عدة مئات من الملليغرام لكل لتر.
يعتبر الحديد عنصرًا نادرًا مهمًا وتعتمد عليه العديد من العمليات البيولوجية المهمة. إنه يؤثر على شدة تطور العوالق النباتية وتعتمد عليه جودة النباتات الدقيقة في المسطحات المائية.
مستوى الحديد في الأنهار والبحيرات موسمي. تُلاحظ أعلى التركيزات في المسطحات المائية في الشتاء والصيف بسبب ركود المياه ، ولكن في الربيع والخريف ينخفض مستوى هذا العنصر بشكل ملحوظ بسبب اختلاط الكتل المائية.
وبالتالي ، فإن كمية كبيرة من الأكسجين تؤدي إلى أكسدة الحديد من الشكل ثنائي التكافؤ إلى الشكل ثلاثي التكافؤ ، مكونًا هيدروكسيد الحديد الذي يترسب.
أقصى تركيز مسموح به للحديد في البيئة المائية
يتميز الماء الذي يحتوي على كمية كبيرة من الحديد (أكثر من 1-2 مجم / لتر) بالضعف استساغة. له طعم قابض غير سار وغير مناسب للأغراض الصناعية.
يبلغ MPC من الحديد للبيئة المائية 0.3 مجم / لتر ، وفي أحواض المصايد يبلغ MPC لمزارع الأسماك 0.1 مجم / لتر.
الكادميوم (سي دي)
يمكن أن يحدث تلوث الكادميوم أثناء ترشيح التربة ، وأثناء تحلل الكائنات الحية الدقيقة المختلفة التي تتراكم فيها ، وأيضًا بسبب الهجرة من خامات النحاس والمعادن المتعددة.
كما يقع اللوم على الإنسان في التلوث بهذا المعدن. قد تحتوي مياه الصرف الصحي من مختلف الشركات العاملة في إنتاج المعادن والجلفانية والكيميائية والمعدنية على كميات كبيرة من مركبات الكادميوم.
العمليات الطبيعية لتقليل مستوى مركبات الكادميوم هي الامتصاص واستهلاك الكائنات الحية الدقيقة وترسيب كربونات الكادميوم ضعيفة الذوبان.
في المحلول ، يكون الكادميوم ، كقاعدة عامة ، في شكل معقدات عضوية معدنية ومعدنية. المواد الممتصة المكونة من الكادميوم هي أهم الأشكال المعلقة لهذا العنصر. تعتبر هجرة الكادميوم في الكائنات الحية (hydrobionites) مهمة للغاية.
محتوى الكادميوم في المسطحات المائية الطبيعية
يتقلب مستوى الكادميوم في الأنهار والبحيرات النظيفة عند مستوى أقل من ميكروجرام لكل لتر ، وفي المياه الملوثة يصل مستوى هذا العنصر إلى عدة ميكروجرام لكل لتر.
يعتقد بعض الباحثين أن الكادميوم بكميات صغيرة قد يكون مهمًا للتطور الطبيعي للحيوانات والبشر. تركيزات الكادميوم المرتفعة خطيرة جدًا على الكائنات الحية.
الحد الأقصى المسموح به من تركيز الكادميوم للبيئة المائية
لا تتجاوز MPC للبيئة المائية 1 ميكروجرام / لتر ، وفي أحواض المصايد يكون MPC للمزارع السمكية أقل من 0.5 ميكروجرام / لتر.
كوبالت (كو)
يمكن أن تتلوث الأنهار والبحيرات بالكوبالت نتيجة لترشيح النحاس وخامات أخرى ، من التربة أثناء تحلل الكائنات الحية المنقرضة (الحيوانات والنباتات) ، وبالطبع نتيجة نشاط المؤسسات الكيميائية والمعدنية وتشغيل المعادن .
توجد الأشكال الرئيسية لمركبات الكوبالت في حالات مذابة ومعلقة. يمكن أن تحدث الاختلافات بين هاتين الحالتين بسبب التغيرات في الأس الهيدروجيني ودرجة الحرارة وتكوين المحلول. في الحالة المذابة ، يوجد الكوبالت في شكل معقدات عضوية. تتميز الأنهار والبحيرات بخاصية أن الكوبالت يمثله كاتيون ثنائي التكافؤ. في حضور عدد كبيرالمؤكسدات في المحلول ، يمكن أن يتأكسد الكوبالت إلى كاتيون ثلاثي التكافؤ.
إنه جزء من النباتات والحيوانات ، لأنه يلعب دورا هامافي تنميتها. إنه أحد العناصر النزرة الرئيسية. إذا كان هناك نقص في الكوبالت في التربة ، فسيكون مستواه في النباتات أقل من المعتاد ، ونتيجة لذلك ، قد تظهر مشاكل صحية في الحيوانات (هناك خطر الإصابة بفقر الدم). لوحظت هذه الحقيقة بشكل خاص في منطقة غابات التايغا غير شيرنوزم. إنه جزء من B 12 ، ينظم امتصاص المواد النيتروجينية ، ويزيد من مستوى الكلوروفيل وحمض الأسكوربيك. بدونها ، لا يمكن للنباتات أن تنمو المبلغ المطلوبسنجاب. مثل جميع المعادن الثقيلة ، يمكن أن تكون سامة فيها كميات كبيرة.
محتوى الكوبالت في المياه الطبيعية
- تتراوح مستويات الكوبالت في الأنهار من بضعة ميكروغرامات إلى ملليغرام لكل لتر.
- في البحار ، يبلغ متوسط مستوى الكادميوم 0.5 ميكروغرام / لتر.
التركيز الأقصى المسموح به للكوبالت في البيئة المائية
يبلغ MPC للكوبالت للبيئة المائية 0.1 مجم / لتر ، وفي أحواض المصايد يبلغ MPC لمزارع الأسماك 0.01 مجم / لتر.
المنغنيز (مينيسوتا)
يدخل المنغنيز في الأنهار والبحيرات من خلال نفس آليات الحديد. يحدث إطلاق هذا العنصر في المحلول بشكل أساسي أثناء ترشيح المعادن والخامات التي تحتوي على المنغنيز (المغرة السوداء ، البراونايت ، البيرولوزيت ، السيلوميلان). يمكن أن يأتي المنغنيز أيضًا من تحلل الكائنات الحية المختلفة. أعتقد أن الصناعة لها الدور الأكبر في تلوث المنغنيز (مياه الصرف الصحي من المناجم ، صناعة كيميائية، علم المعادن).
يحدث الانخفاض في كمية المعدن القابل للاستيعاب في المحلول ، كما في حالة المعادن الأخرى في الظروف الهوائية. يتأكسد Mn (II) إلى Mn (IV) ، ونتيجة لذلك يترسب على شكل MnO 2. عوامل مهمةفي مثل هذه العمليات ، يتم النظر في درجة الحرارة وكمية الأكسجين المذاب في المحلول ودرجة الحموضة. يمكن أن يحدث انخفاض في المنجنيز المذاب في المحلول عندما تستهلكه الطحالب.
يهاجر المنغنيز بشكل رئيسي في شكل معلقات ، والتي ، كقاعدة عامة ، تشير إلى تكوين الصخور المحيطة. أنها تحتوي عليه كمزيج مع معادن أخرى في شكل هيدروكسيدات. تشير غلبة المنغنيز في الشكل الغروي والمذاب إلى ارتباطها بـ مركبات العضويةتشكيل المجمعات. تظهر المجمعات المستقرة مع الكبريتات والبيكربونات. مع الكلور ، يشكل المنجنيز مجمعات أقل تواتراً. على عكس المعادن الأخرى ، فإنه يتم الاحتفاظ به أضعف في المجمعات. يشكل المنغنيز ثلاثي التكافؤ مثل هذه المركبات فقط في وجود روابط عدوانية. الأشكال الأيونية الأخرى (Mn 4+ ، Mn 7+) أقل ندرة أو لا توجد على الإطلاق في الظروف العادية في الأنهار والبحيرات.
محتوى المنغنيز في المسطحات المائية الطبيعية
تعتبر البحار الأفقر في المنغنيز - 2 ميكروغرام / لتر ، في الأنهار محتواها أعلى - يصل إلى 160 ميكروغرام / لتر ، لكن الخزانات الجوفية هي حاملات قياسية هذه المرة - من 100 ميكروغرام إلى عدة مجم / لتر.
يتميز المنغنيز بتقلبات موسمية في التركيز ، مثل الحديد.
تم تحديد العديد من العوامل التي تؤثر على مستوى المنجنيز الحر في المحلول: اتصال الأنهار والبحيرات بالخزانات الجوفية ، ووجود كائنات التمثيل الضوئي ، الظروف الهوائية، تحلل الكتلة الحيوية (الكائنات الحية والنباتات الميتة).
دور كيميائي حيوي مهم لهذا العنصر ، لأنه مدرج في مجموعة العناصر الدقيقة. يتم منع العديد من العمليات في نقص المنجنيز. يزيد من شدة التمثيل الضوئي ، ويشارك في التمثيل الغذائي للنيتروجين ، ويحمي الخلايا من التأثير السلبي Fe (II) أثناء أكسدة إلى شكل ثلاثي التكافؤ.
أقصى تركيز مسموح به من المنجنيز للبيئة المائية
MPC للمنغنيز للخزانات - 0.1 مجم / لتر.
النحاس (نحاس)
لا يوجد عنصر دقيق واحد له مثل هذا الدور المهم للكائنات الحية! النحاس هو أحد العناصر النزرة الأكثر طلبًا. إنه جزء من العديد من الإنزيمات. بدونها ، لا شيء تقريبًا يعمل في كائن حي: تخليق البروتينات والفيتامينات ويتعطل. بدونها ، لا يمكن للنباتات التكاثر. ومع ذلك ، فإن الكمية الزائدة من النحاس تسبب تسممًا كبيرًا في جميع أنواع الكائنات الحية.
مستويات النحاس في المياه الطبيعية
على الرغم من أن النحاس له شكلين أيونيين ، فإن النحاس (II) يحدث بشكل متكرر في المحلول. عادةً ما تكون مركبات النحاس (I) غير قابلة للذوبان في المحلول (Cu 2 S ، CuCl ، Cu 2 O). يمكن أن تنشأ نحاسيات مائية مختلفة في وجود أي روابط.
مع ارتفاع استخدام النحاس اليوم في الصناعة و زراعة، يمكن أن يتسبب هذا المعدن في تلوث البيئة. المصانع الكيماوية والمعدنية والمناجم يمكن أن تكون مصادر لمياه الصرف الصحي ذات المحتوى العالي من النحاس. تساهم عمليات تآكل خطوط الأنابيب أيضًا في تلوث النحاس. أهم المعادن التي تحتوي على نسبة عالية من النحاس هي الملكيت ، البورنيت ، كالكوبايرايت ، الكالكوسيت ، الأزوريت ، البرونتان.
أقصى تركيز مسموح به للنحاس في البيئة المائية
يعتبر MPC للنحاس للبيئة المائية 0.1 مجم / لتر ؛ في أحواض الأسماك ، يتم تقليل MPC لمزرعة أسماك النحاس إلى 0.001 مجم / لتر.
الموليبدينوم (مو)
أثناء ترشيح المعادن التي تحتوي على نسبة عالية من الموليبدينوم ، وصلات مختلفةالموليبدينوم. مستوى عاليمكن رؤية الموليبدينوم في الأنهار والبحيرات القريبة من مصانع الإثراء ومؤسسات التعدين غير الحديدية. بسبب عمليات الترسيب المختلفة للمركبات قليلة الذوبان ، والامتزاز على السطح سلالات مختلفة، وكذلك استخدام الطحالب المائية والنباتات ، قد تنخفض بشكل ملحوظ كميتها.
في الغالب في المحلول ، يمكن أن يكون الموليبدينوم على شكل MoO 4 2- أنيون. هناك احتمال وجود مجمعات الموليبدينوم العضوية. نظرًا لحقيقة أن المركبات المتناثرة الرخوة تتشكل أثناء أكسدة الموليبدينيت ، يزداد مستوى الموليبدينوم الغروي.
محتوى الموليبدينوم في الخزانات الطبيعية
تتراوح مستويات الموليبدينوم في الأنهار بين 2.1 و 10.6 ميكروغرام / لتر. في البحار والمحيطات محتواها 10 ميكروغرام / لتر.
بتركيزات منخفضة ، يساعد الموليبدينوم على التطور الطبيعي للكائن الحي (النباتي والحيواني على حد سواء) ، لأنه مدرج في فئة العناصر الدقيقة. وهو كذلك جزء لا يتجزأإنزيمات مختلفة مثل زانثين أوكسيليز. مع نقص الموليبدينوم ، يحدث نقص في هذا الإنزيم وبالتالي يمكن أن تحدث آثار سلبية. كما أن الزيادة في هذا العنصر غير مرحب بها ، لأن عملية التمثيل الغذائي الطبيعية تكون مضطربة.
أقصى تركيز مسموح به من الموليبدينوم للبيئة المائية
يجب ألا يتجاوز MPC للموليبدينوم في المسطحات المائية 0.25 مجم / لتر.
الزرنيخ (As)
المناطق الملوثة بالزرنيخ هي بشكل رئيسي المناطق القريبة من مناجم المعادن التي تحتوي على نسبة عالية من هذا العنصر (التنغستن ، والنحاس - الكوبالت ، والخامات المتعددة الفلزات). يمكن أن تحدث كمية صغيرة جدًا من الزرنيخ أثناء تحلل الكائنات الحية. بفضل الكائنات المائية ، يمكن أن تمتصه هذه الكائنات. لوحظ امتصاص مكثف للزرنيخ من المحلول خلال فترة التطور السريع للعوالق.
أهم ملوثات الزرنيخ هي صناعة التخصيب ، ومؤسسات إنتاج الأصباغ ، وكذلك الزراعة.
تحتوي البحيرات والأنهار على الزرنيخ في دولتين: معلق ومنحل. قد تختلف النسب بين هذه الأشكال اعتمادًا على الرقم الهيدروجيني للمحلول والتركيب الكيميائي للمحلول. في الحالة المذابة ، يمكن أن يكون الزرنيخ ثلاثي التكافؤ أو خماسي التكافؤ ، ويدخل في أشكال أنيونية.
مستويات الزرنيخ في المياه الطبيعية
في الأنهار ، كقاعدة عامة ، يكون محتوى الزرنيخ منخفضًا جدًا (عند مستوى ميكروغرام / لتر) ، وفي البحار - بمتوسط 3 ميكروغرام / لتر. بعض مياه معدنيةقد تحتوي على كميات كبيرة من الزرنيخ (تصل إلى عدة ملليغرام لكل لتر).
يمكن أن يحتوي معظم الزرنيخ على خزانات جوفية - تصل إلى عدة عشرات من المليغرامات لكل لتر.
مركباته شديدة السمية لجميع الحيوانات وللبشر. بكميات كبيرة ، تتعطل عمليات الأكسدة ونقل الأكسجين إلى الخلايا.
أقصى تركيز مسموح به للزرنيخ في البيئة المائية
يبلغ MPC للزرنيخ في البيئة المائية 50 ميكروغرام / لتر ، وفي أحواض المصايد يكون MPC لمزارع الأسماك أيضًا 50 ميكروغرام / لتر.
نيكل (ني)
يتأثر محتوى النيكل في البحيرات والأنهار بالصخور المحلية. إذا كانت هناك رواسب من خامات النيكل والحديد والنيكل بالقرب من الخزان ، فقد يكون التركيز أعلى من المعتاد. يمكن للنيكل أن يدخل البحيرات والأنهار عندما تتحلل النباتات والحيوانات. تحتوي الطحالب الخضراء المزرقة على كميات قياسية من النيكل مقارنة بالكائنات الحية النباتية الأخرى. يتم إطلاق مياه الصرف الهامة ذات المحتوى العالي من النيكل أثناء إنتاج المطاط الصناعي ، أثناء عمليات طلاء النيكل. كما يتم إطلاق النيكل بكميات كبيرة أثناء احتراق الفحم والنفط.
يمكن أن يتسبب ارتفاع درجة الحموضة في ترسب النيكل على شكل كبريتات أو سيانيدات أو كربونات أو هيدروكسيدات. يمكن للكائنات الحية أن تقلل من مستوى النيكل المتحرك عن طريق استهلاكه. عمليات الامتزاز على سطح الصخور مهمة أيضًا.
يمكن أن يحتوي الماء على نيكل في أشكال مذابة وغروية ومعلقة (يعتمد التوازن بين هذه الحالات على الأس الهيدروجيني للوسط ودرجة الحرارة وتكوين الماء). يمتص هيدروكسيد الحديد وكربونات الكالسيوم والطين المركبات المحتوية على النيكل جيدًا. النيكل المذاب في شكل معقدات تحتوي على أحماض فولفيك ودوميك ، وكذلك مع أحماض أمينية وسيانيد. يعتبر Ni 2+ أكثر الأشكال الأيونية استقرارًا. عادة ما يتكون Ni 3+ عند درجة حموضة عالية.
في منتصف الخمسينيات من القرن الماضي ، أضيف النيكل إلى قائمة العناصر النزرة لأنه يلعب دورًا مهمًا فيها عمليات مختلفةكمحفز. في الجرعات المنخفضة ، يكون له تأثير إيجابي على عمليات تكوين الدم. لا تزال الجرعات الكبيرة تشكل خطورة كبيرة على الصحة ، لأن النيكل عنصر كيميائي مسرطن ويمكن أن يثير أمراضًا مختلفة في الجهاز التنفسي. يعتبر النيكل الحر 2+ أكثر سمية مما هو عليه في شكل معقدات (مرتين تقريبًا).
مستوى النيكل في المياه الطبيعية
أقصى تركيز مسموح به للنيكل في البيئة المائية
يبلغ MPC للنيكل للبيئة المائية 0.1 مجم / لتر ، ولكن في أحواض المصايد يبلغ MPC لمزارع الأسماك 0.01 مجم / لتر.
تين (سن)
المصادر الطبيعية للقصدير هي المعادن التي تحتوي على هذا العنصر (ستانين ، حجر القصدير). المصادر البشرية هي نباتات ومصانع لإنتاج الدهانات العضوية المختلفة وصناعة المعادن التي تعمل مع إضافة القصدير.
القصدير معدن منخفض السمية ، ولهذا لا نخاطر بصحتنا بتناول الطعام من المعدن المعلب.
تحتوي البحيرات والأنهار على أقل من ميكروجرام من القصدير لكل لتر من الماء. قد تحتوي الخزانات الجوفية على عدة ميكروجرامات من القصدير لكل لتر.
أقصى تركيز مسموح به للقصدير في البيئة المائية
MPC من القصدير للبيئة المائية - 2 ملغم / لتر.
الزئبق (Hg)
في الأساس، مستوى مرتفعيظهر الزئبق في الماء في المناطق التي توجد بها رواسب من الزئبق. المعادن الأكثر شيوعًا هي ليفينجستون ، سينابار ، ميتاسيناباريت. يمكن أن تحتوي المياه العادمة من مصانع الأدوية ومبيدات الآفات والأصباغ على كميات كبيرة من الزئبق. مصدر مهم آخر للتلوث بالزئبق هو محطات توليد الطاقة الحرارية(التي تستخدم الفحم كوقود).
ينخفض مستواه في المحلول بشكل أساسي بسبب الحيوانات والنباتات البحرية التي تتراكم وتركز الزئبق! أحيانًا يرتفع محتوى الزئبق في الحياة البحرية عدة مرات أعلى منه في البيئة البحرية.
تحتوي المياه الطبيعية على الزئبق في شكلين: معلق (على شكل مركبات ممتصة) ومذاب (مركب ، مركبات معدنية من الزئبق). في مناطق معينة من المحيطات ، يمكن أن يظهر الزئبق كمجمعات ميثيل الزئبق.
الزئبق ومركباته شديدة السمية. في التركيزات العالية ، يكون لها تأثير سلبي على الجهاز العصبي، يسبب تغيرات في الدم ، ويؤثر على إفراز الجهاز الهضمي والوظيفة الحركية. تعتبر منتجات معالجة الزئبق بالبكتيريا خطيرة للغاية. يمكنهم تصنيع المواد العضوية على أساس الزئبق ، والتي هي أكثر سمية مرات عديدة من المركبات غير العضوية. عند تناول الأسماك ، يمكن لمركبات الزئبق أن تدخل أجسامنا.
أقصى تركيز مسموح به للزئبق في البيئة المائية
MPC من الزئبق في ماء عادي- 0.5 ميكروجرام / لتر ، وفي أحواض المصايد تقل نسبة MPC للمزارع السمكية عن 0.1 ميكروجرام / لتر.
الرصاص (الرصاص)
يمكن أن تتلوث الأنهار والبحيرات بالرصاص بطريقة طبيعية عندما يتم غسل معادن الرصاص (غالينا ، أنجليسايت ، سيروسيت) ، وبطريقة بشرية المنشأ (حرق الفحم ، استخدام رباعي إيثيل الرصاص في الوقود ، التصريف من مصانع تجهيز الخام ، مياه الصرف الصحي من المناجم والنباتات المعدنية). يعتبر ترسيب مركبات الرصاص وامتصاص هذه المواد على سطح الصخور المختلفة من أهم الطرق الطبيعية لخفض مستواها في المحلول. من العوامل البيولوجية ، تؤدي hydrobionts إلى انخفاض مستوى الرصاص في المحلول.
يكون الرصاص في الأنهار والبحيرات معلقًا ومذابًا (معقدات معدنية وعضوية معدنية). كما أن الرصاص في صورة مواد غير قابلة للذوبان: كبريتات ، كربونات ، كبريتيد.
محتوى الرصاص في المياه الطبيعية
لقد سمعنا الكثير عن سمية هذا المعدن الثقيل. إنه خطير للغاية حتى بكميات صغيرة ويمكن أن يسبب التسمم. يدخل الرصاص الجسم عن طريق الجهاز التنفسي والجهاز الهضمي. يتم إفرازه من الجسم ببطء شديد ، ويمكن أن يتراكم في الكلى والعظام والكبد.
أقصى تركيز مسموح به للرصاص في البيئة المائية
يبلغ MPC للرصاص في البيئة المائية 0.03 مجم / لتر ، وفي أحواض المصايد يبلغ MPC لمزارع الأسماك 0.1 مجم / لتر.
رباعي إيثيل الرصاص
إنه بمثابة عامل مضاد للارتجاج في وقود المحركات. وبالتالي ، فإن المصادر الرئيسية للتلوث بهذه المادة هي المركبات.
هذا المركب شديد السمية ويمكن أن يتراكم في الجسم.
أقصى تركيز مسموح به لرابع إيثيل الرصاص في البيئة المائيةالحد الأقصى المسموح به لهذه المادة يقترب من الصفر.
لا يُسمح عمومًا باستخدام رباعي إيثيل الرصاص في تكوين المياه.
الفضة (AG)
تدخل الفضة بشكل أساسي في الأنهار والبحيرات من الخزانات الجوفية ونتيجة لتصريف المياه العادمة من المؤسسات (شركات التصوير الفوتوغرافي ومصانع التخصيب) والمناجم. يمكن أن يكون مصدر آخر للفضة عوامل مبيدات الجراثيم والجراثيم.
في المحلول ، أهم المركبات هي أملاح هاليد الفضة.
محتوى الفضة في المياه الطبيعية
في الأنهار والبحيرات النظيفة ، يكون محتوى الفضة أقل من ميكروغرام لكل لتر ، وفي البحار - 0.3 ميكروغرام / لتر. تحتوي الخزانات الجوفية على عدة عشرات من الميكروجرام لكل لتر.
الفضة في شكل أيوني (بتركيزات معينة) لها تأثير جراثيم ومبيد للجراثيم. لكي تتمكن من تعقيم المياه بالفضة يجب أن يكون تركيزها أكبر من 2 * 10-11 مول / لتر. الدور البيولوجيالفضة في الجسم لا تزال غير معروفة.
أقصى تركيز مسموح به للفضة للبيئة المائية
الحد الأقصى المسموح به للفضة للبيئة المائية هو 0.05 مجم / لتر.
اللمحة - أقصى تركيز مسموح به لمادة ما في ماء خزان للشرب واستخدام المياه المنزلية ، مجم / لتر. يجب ألا يكون لهذا التركيز تأثير مباشر أو غير مباشر على جسم الإنسان طوال الحياة ، وكذلك على صحة الأجيال اللاحقة ، ويجب ألا يؤدي إلى تفاقم الظروف الصحية لاستخدام المياه. زقزقة. - التركيز الأقصى المسموح به لمادة ما في مياه الخزان المستخدم في أغراض الصيد ، مجم / لتر.
يعتمد تقييم جودة النظم الإيكولوجية المائية على الوثائق المعيارية والتوجيهية باستخدام التقييمات الهيدروجيوكيميائية المباشرة. في الجدول. 2-4 ، على سبيل المثال ، تم تقديم معايير تقييم التلوث الكيميائي للمياه السطحية.
تم وضع حدود للمياه التركيزات المسموح بهاأكثر من 960 مركبات كيميائية، والتي يتم تجميعها في ثلاث مجموعات وفقًا لمؤشرات الحد التالية للضرر (LPV): السمية الصحية (s.-t.) ؛ الصرف الصحي العام (عام) ؛ الحسية (org.).
MPC لبعض المواد الضارة في البيئة المائيةمعروضة في الجدول. 2.1.4.
معظم متطلبات عاليةتطبق على مياه الشرب. معيار الدولةعلى المياه المستخدمة للشرب و الصناعات الغذائية(SanPiN 2.1.4.1074-01) ، يحدد المؤشرات الحسية للمياه الملائمة للإنسان: الطعم والرائحة واللون والشفافية ، فضلاً عن عدم ضرر تركيبته الكيميائية والسلامة الوبائية.
الجدول 2.1.4
MPC من المواد الضارة في المسطحات المائية المنزلية والشرب
استخدام المياه في الأغراض الثقافية والمنزلية ، ملغم / لتر
(GN 2.1.5.689-98)
| مواد | LPV | MPC |
| 1 | 2 | 3 |
| /> بور | شارع. | 0,5 |
| البروم | شارع. | 0,2 |
| البزموت | شارع. | 0,1 |
| سداسي كلور البنزين | شارع. | 0,05 |
| ديميثيلامين | شارع. | 0,1 |
| ديفلورودي كلورو ميثان (الفريون) | شارع. | 10 |
| ثنائي إيثيل الأثير | منظمة. | 0,3 |
| حديد | منظمة. | 0,3 |
| الايزوبرين | منظمة. | 0,005 |
| الكادميوم | شارع. | 0,001 |
| كاربوفوس | منظمة. | 0,05 |
| الكيروسين: | | |
| مؤكسد | منظمة. | 0,01 |
| الإضاءة (GOST 4753-68) | منظمة. | 0,05 |
| اِصطِلاحِيّ | منظمة. | 0,001 |
| حامض: | | |
| البنزويك | توت. | 0,6 |
| ثنائي فينيل أسيتيك | توت. | 0,5 |
| زيتي | توت. | 0,7 |
| فورميك | توت. | 3,5 |
| خليك | توت. | 1,2 |
| الأحماض الدهنية الاصطناعية | توت. | 0,1 |
| سي 5 سي 20 | | |
| المنغنيز | منظمة. | 0,1 |
| نحاس | منظمة. | 1 |
| الميثانول | شارع. | 3 |
| الموليبدينوم | شارع. | 0,25 |
| اليوريا | توت. | 1 |
| النفثالين | منظمة. | 0,01 |
| نفط: | | |
| متعدد الكبريتات | منظمة. | 0,1 |
| متين | منظمة. | 0,3 |
| النترات ل: | | |
| رقم 3- | شارع. | 45 |
| NO2- | شارع. | 3,3 |
| بولي إيثيلين أمين | شارع. | 0,1 |
| الثيوسيانات | شارع. | 0,1 |
| الزئبق | شارع. | 0,0005 |
| قيادة | شارع. | 0,03 |
| ثاني كبريتيد الكربون | منظمة. | 1 |
| زيت التربنتين | منظمة. | 0,2 |
| كبريتيدات | توت. | غياب |
| رباعي إيثيل الرصاص | شارع. | غياب |
| فوسفات ثلاثي بوتيل | توت. | 0,01 |
يجب ألا تحتوي مياه الشرب في أي وقت من السنة على أقل من 4 جم / م من الأكسجين ، ويجب ألا يتجاوز وجود الشوائب المعدنية (ملغم / لتر): الكبريتات (SO4 -) - 500 ؛ كلوريدات (Cl -) - 350 ؛ الحديد (Fe2 + Fe3 +) - 0.3 ؛ المنغنيز (Mn2 +) - 0.1 ؛ نحاس (Cu2 +) - 1.0 ؛ زنك (Zn2 +) - 5.0 ؛ ألومنيوم (Al) - 0.5 ؛ الميتافوسفات (PO3 ") - 3.5 ؛ الفوسفات (PO4
3 ") - 3.5 ؛ بقايا جافة - 1000. وبالتالي ، فإن الماء مناسب للشرب إذا كان محتواه المعدني الإجمالي لا يتجاوز 1000 مجم / لتر. كما يؤدي المحتوى المعدني المنخفض جدًا للماء (أقل من 1000 مجم / لتر) إلى تفاقم مذاقه ، و الماء الخالي بشكل عام من الأملاح (المقطر) ضار بالصحة ، حيث أن استخدامه يعطل الهضم ونشاط الغدد الصماء ، وأحيانًا ، بالاتفاق مع الخدمات الصحية والوبائية ، محتوى جاف يصل إلى 1500 مجم / لتر. مسموح.
المؤشرات التي تميز تلوث الخزانات ومياه الشرب بمواد مصنفة على أنها من رتب الخطر 3 و 4 وكذلك الخصائص الفيزيائية والكيميائيةوخصائص الماء الحسية إضافية. يتم استخدامها لتأكيد درجة كثافة التلوث البشري لمصادر المياه ، والتي تحددها مؤشرات الأولوية.
يجب أن يعتمد تطبيق معايير مختلفة لتقييم جودة المياه على ميزة متطلبات استخدام المياه التي تكون معاييرها أكثر صرامة. على سبيل المثال ، إذا كان الجسم المائي يخدم أغراض الشرب ومصايد الأسماك في وقت واحد ، فقد يتم فرض متطلبات أكثر صرامة (البيئة ومصايد الأسماك) على تقييم جودة المياه.
PCP-10 (مؤشر التلوث الكيميائي). هذا المؤشر مهم بشكل خاص للمناطق التي لوحظ فيها التلوث الكيميائي لعدة مواد في وقت واحد ، كل منها يتجاوز عدة مرات MPC. يتم حسابه فقط عند تحديد مناطق الطوارئ البيئية ومناطق الكوارث البيئية.
يتم الحساب لعشرة مركبات تتجاوز الحد الأقصى من MPC ، وفقًا للصيغة:
PKhZ-10 = C1 / MPC1 + C2 / MPC2 + C3 / MPC3 + ... C10 / MPC10 ،
حيث Cb C2، C3 ... Cb - تركيز المواد الكيميائية في الماء: MPC - مصايد الأسماك.
عند تحديد PCP-10 للمواد الكيميائية التي لا توجد لها قيمة مرضية نسبيًا لتلوث المياه ، تؤخذ نسبة C / MAC بشكل مشروط مساوية لـ 1.
لإنشاء PCP-10 ، يوصى بتحليل المياه وفقًا لأقصى عدد ممكن من المؤشرات.
تشمل المؤشرات الإضافية فيزيائيًا كيميائيًا مقبولًا بشكل عام و الخصائص البيولوجيةإعطاء فكرة عامةعلى تكوين ونوعية المياه. تُستخدم هذه المؤشرات للتوصيف الإضافي للعمليات التي تحدث في المسطحات المائية. الى جانب ذلك ، في خصائص إضافيةتشمل المؤشرات التي تأخذ في الاعتبار قدرة الملوثات على التراكم في رواسب القاع والهيدروبيونات.
يتم حساب معامل التراكم السفلي لـ CDA بالصيغة:
KDA \ u003d Sd.o. / Sv ،
حيث SD. حول. و Sv - تركيز الملوثات في رواسب القاع والمياه ، على التوالي.
معامل التراكم في Hydrobionts:
كن \ u003d Sg / Sv ،
حيث Cr هو تركيز الملوثات في hydrobionts.
يتم تحديد التركيزات الحرجة للمواد الكيميائية (CC) وفقًا لطريقة تحديد التركيزات الحرجة للملوثات التي طورتها لجنة الدولة للأرصاد الجوية المائية في عام 1983.
متوسط قيم CC لبعض الملوثات هو ، mg / l: النحاس - 0.001 ... 0.003 ؛ الكادميوم - 0.008 ... 0.020 ؛ زنك - 0.05 ... 0.10 ؛ ثنائي الفينيل متعدد الكلور - 0.005 ؛ بنزو (أ) بيرين - 0.005.
عند تقييم حالة النظم الإيكولوجية المائية ، فإن المؤشرات الموثوقة بدرجة كافية هي خصائص الحالة وتطور الجميع مجموعات بيئيةمجتمع المياه.
عند تحديد المناطق قيد الدراسة ، يتم استخدام المؤشرات للعوالق الجرثومية والنباتية والحيوانية ، وكذلك للإكثيوفونا. بالإضافة إلى ذلك ، لتحديد درجة سمية المياه ، يتم استخدام مؤشر متكامل - الاختبار الأحيائي (للقشريات المنخفضة). في هذه الحالة ، يجب ملاحظة السمية المقابلة لكتلة الماء في جميع المراحل الرئيسية للدورة الهيدرولوجية.
تم اعتماد المؤشرات الرئيسية للعوالق النباتية والعوالق الحيوانية ، وكذلك لحيوانات البعوض ، على أساس البيانات الواردة من خدمات المراقبة المائية الإقليمية التي تميز درجة التدهور الإيكولوجي للنظم الإيكولوجية للمياه العذبة.
يجب تشكيل معلمات المؤشرات المقترحة لتخصيص المناطق في إقليم معين على أساس ملاحظات طويلة الأجل بما فيه الكفاية (ثلاث سنوات على الأقل).
يجب ألا يغيب عن البال أن قيم مؤشرات الأنواع قد تختلف باختلاف المناطق المناخية.
عند تقييم حالة النظم البيئية المائية ، تعتبر المؤشرات الخاصة بالإكثيوفونا مهمة ، خاصة بالنسبة للأجسام المائية الفريدة والمحمية بشكل خاص والخزانات من فئة المصايد الأولى والأعلى.
الطلب الأوكسجيني البيولوجي - الطلب البيولوجي على الأكسجين - كمية الأكسجين المستخدمة في العمليات الكيميائية الحيوية لأكسدة المواد العضوية (باستثناء عمليات النترجة) لفترة معينة من حضانة العينة (2 ، 5 ، 20 ، 120 يومًا) ، ملجم أآسجين / لتر من الماء (BODp - لمدة 20 يومًا ، BOD5 - لمدة 5 أيام).
تتم عملية الأكسدة في ظل هذه الظروف بواسطة كائنات دقيقة تستخدم مكونات عضوية كغذاء. طريقة الطلب الأوكسجيني البيولوجي هي على النحو التالي. بعد استقرار لمدة ساعتين ، يتم تخفيف مياه الصرف التي تم فحصها بالماء النظيف ، ويتم تناولها بكمية كافية بحيث يكون الأكسجين الموجود فيها كافياً لأكسدة جميع المواد العضوية في مياه الصرف الصحي. بعد تحديد محتوى الأكسجين المذاب في الخليط الناتج ، يتم تركه في زجاجة مغلقة لمدة 2 ، 3 ، 5 ، 10 ، 15 يومًا ، مع تحديد محتوى الأكسجين بعد كل فترة زمنية مدرجة (فترة الحضانة). يوضح الانخفاض في كمية الأكسجين في الماء مقدار ما تم إنفاقه خلال هذا الوقت على أكسدة المواد العضوية في مياه الصرف الصحي. هذه الكمية ، المرتبطة بـ 1 لتر من مياه الصرف الصحي ، هي مؤشر على استهلاك الأكسجين الكيميائي الحيوي بواسطة مياه الصرف لفترة زمنية معينة (BOD2 ، BODz ، BOD5 ، BODw ، BOD15).
وتجدر الإشارة إلى أن استهلاك الأكسجين الكيميائي الحيوي لا يشمل استهلاكه من أجل النترجة. لذلك ، يجب تنفيذ الطلب الأوكسجيني البيولوجي الكامل قبل بدء النترجة ، والتي تبدأ عادةً بعد 15-20 يومًا. يتم حساب الطلب الأوكسجيني البيولوجي لمياه الصرف باستخدام الصيغة التالية:
BOD = [(a1 ~ b1) ~ (a2 ~ b2)] × 1000
الخامس'
حيث ai هو تركيز الأكسجين في العينة المعدة للتحديد في بداية الحضانة (في "يوم الصفر") ، ملغم / لتر ؛ a2 - تركيز الأكسجين في الماء المخفف في بداية الحضانة ، ملغم / لتر ؛ ب 1 - تركيز الأكسجين في العينة في نهاية الحضانة ، ملغم / لتر ؛ b2 هو تركيز الأكسجين في الماء المخفف في نهاية الحضانة ، ملغم / لتر ؛ V هو حجم مياه الصرف الموجودة في 1 لتر من العينة ، بعد كل التخفيفات ، مل.
COD - الحاجة الكيميائيةفي الأكسجين الذي تحدده طريقة ثنائي كرومات ، أي كمية الأكسجين التي تعادل كمية المؤكسد المستهلك المطلوب لأكسدة جميع عوامل الاختزال الموجودة في الماء ، ملجم O2 / لتر من الماء.
يتم حساب استهلاك الأكسجين الكيميائي ، معبرًا عنه بعدد ملليغرام من الأكسجين لكل لتر واحد من مياه الصرف الصحي ، من خلال الصيغة:
HPC - 8 (أ - ب) × N1000
الخامس'
حيث a هو حجم محلول ملح Mohr المستخدم في المعايرة في تجربة فارغة ، ml ؛ ب هو حجم نفس المحلول المستخدم لمعايرة العينة ، مل ؛ N هي الحالة الطبيعية للمحلول المعاير لملح Mohr ؛ V هو حجم مياه الصرف التي تم تحليلها ، مل ؛ 8 - مكافئ الأكسجين.
فيما يتعلق BODp / COD ، يتم الحكم على كفاءة الأكسدة الكيميائية الحيوية للمواد.
