Какви неорганични вещества са включени в състава. неорганични вещества
След като се запознаем с химичните елементи, съдържащи се в живите организми, нека се обърнем към изучаването на веществата, в които са включени тези елементи. Сред тях са неорганични (вода, минерални соли и киселини) и органични съединения(Фиг. 1). По-голямата част от масата в живите организми съдържа вода.
Вода.Съдържанието на вода в живите организми е 60-75% от масата им, а в някои, като медузите, до 98%. в листата и сочни плодовеСъдържанието на вода в растенията също може да достигне 98%.
Количеството вода не е същото различни тъкании органи. И така, при човек в сивото вещество на мозъка неговото съдържание е 85%, а в костната тъкан - 22%. Най-високо съдържание на вода в организма се наблюдава в ембрионалния период (95%) и постепенно намалява с възрастта. Без използване на вода човек може да живее не повече от 5-7 дни.
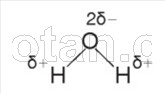
Както вече знаете от курса по химия, водната молекула (H 2 0) се състои от два водородни атома, свързани чрез ковалентни полярни връзки с кислороден атом.
Връзките H–O–H са разположени под ъгъл от 104,5° една спрямо друга. Кислородът има по-голяма електроотрицателност от водорода, така че кислородният атом привлича споделени електронни двойки и придобива частично отрицателен заряд. Водородните атоми придобиват частично положителен заряд, т.е. водната молекула е полярни.
Възниква електростатично привличане между кислородния атом на една водна молекула и водородния атом на друга молекула. Такова взаимодействие
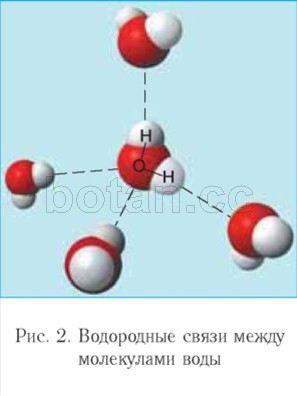
по-слаба от йонна връзка се нарича водородна връзка.Всяка водна молекула, подобно на малък магнит, привлича към себе си още четири молекули поради образуването на водородни връзки (фиг. 2). Поради образуването на водородни връзки водните молекули са свързани една с друга. Следователно водата при температури от 0 ° C до 100 ° C може да задържа течност агрегатно състояние, докато подобните водородни съединения (например H 2 S, NH 3 , HF) са газове.
Биологичната роля на водата в живите организми е свързана с нейните свойства, преди всичко с малкия размер на молекулите, тяхната полярност и способността да образуват водородни връзки помежду си и с други съединения.
Водата е тази, която определя обема на клетките и вътреклетъчните (тургор)налягане. Поради своята полярност, водните молекули са в състояние да образуват така наречените хидратиращи черупки около йони и полярни молекули. Това допринася за отделянето на частиците и предотвратява слепването им, което е особено важно, например, за протеиновите молекули.
Полярността на молекулите и способността да образуват водородни връзки правят водата универсален разтворител за полярни вещества,по-добре от повечето известни течности. В зависимост от разтворимостта във вода, съединенията условно се разделят на разтворими или хидрофилен(от гръцки. водач- вода, fshsha- любов), и неразтворими, или хидрофобни(от гръцки. фобос- страх). Хидрофилните вещества са моно- и дизахариди, много минерални соли и киселини, нисши алкохоли, нисши карбоксилни киселини и др. Висшите карбоксилни киселини, мазнините и някои други вещества са хидрофобни.
Водата е средата за потока на много хора метаболитни процеси. Мнозинство химична реакцияв организма се среща именно във водни разтвори. Влизането и излизането на веществата от клетката се извършват като правило в разтворена форма. Водата участва пряко в много химични реакции, които протичат в клетките, включително процесите на разцепване на органични съединения. Той е един от изходните материали в реакциите на фотосинтеза. Кислородът, произведен по време на фотосинтезата, се освобождава, когато водните молекули се разпадат.
Водата като разтворител участва в явленията на осмозата, играейки важна роляв дейността на телесните клетки. Осмоза- това е движението на водните молекули през полупропусклива мембрана (например през цитоплазмената мембрана на клетка) от зона с по-ниска концентрация на разтворени вещества (например соли, захари или урея) към зона с по-висока концентрация от тези вещества (фиг. 3). Благодарение на осмозата концентрациите на разтворените вещества в клетката и извънклетъчната среда се изравняват.
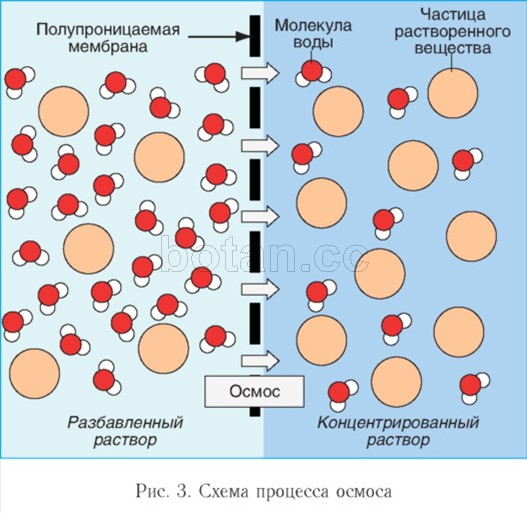
Ако разтвор и разтворител (например вода) са разделени от селективно пропусклива мембрана, се наблюдава движението на молекулите на разтворителя през мембраната в разтвора. За да се предотврати навлизането на разтворителя, върху разтвора трябва да се приложи определено налягане, което се нарича осмотично налягане. Колкото по-концентриран е разтворът, толкова по-високо е осмотичното му налягане.
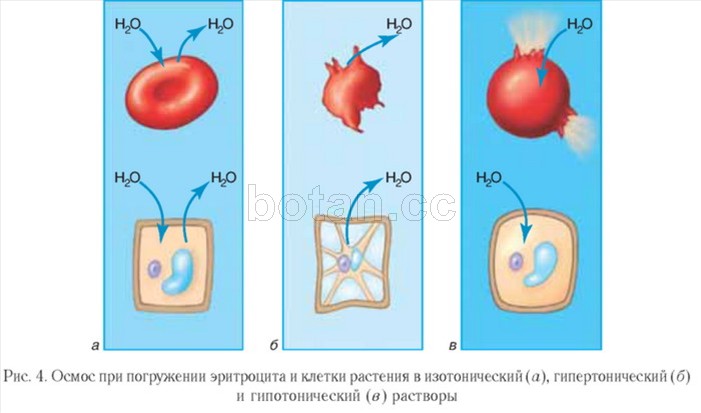
Разтворите, чието осмотично налягане е същото като в клетките, се наричат изотонични. Обемът на клетките, потопени в изотонични разтвори, остава непроменен (фиг. 4, а).В медицината се използват изотонични разтвори, по-специално физиологичен разтвор (воден разтвор на NaCl с масова фракция 0,9%). Използват се при тежка дехидратация и кръвозагуба от пациенти, за разтваряне лекарстваприлаган чрез инжектиране.
Разтвор, чието осмотично налягане е по-високо, отколкото в клетките, се нарича хипертоничен. Клетките, потопени в хипертоничен разтвор, губят вода и намаляват обема си, т.е. се свиват (фиг. 4, б).Хипертоничният физиологичен разтвор намира приложение при лечението на рани. Марлена превръзка, навлажнена с такъв разтвор, абсорбира добре гнойта, което помага за почистване и заздравяване на раната.
Обратната картина се наблюдава при потапяне на клетките в хипотоничен разтвор, в който концентрацията на разтворените вещества е по-ниска, отколкото в клетките. В този случай водата се втурва в клетката, клетката набъбва и може да лизира, т.е. да се спука (фиг. 4, в).
Също така се свързва с водата регулиране топлинен режим организми. Водата има висок топлинен капацитет - способност да абсорбира голям бройтоплина за малки промени в температурата. Благодарение на това водата предотвратява внезапни промени в температурата в клетките и тялото като цяло, дори когато температурните колебания в заобикаляща средаса достатъчно големи.
Общият брой на водородните връзки между водните молекули варира в зависимост от температурата. Когато ледът се стопи, около 15% от водородните връзки се разрушават, а при 40 ° C - половината. При преминаване в състояние на пара всички водородни връзки се разрушават. При промяна на температурата външна средаводата абсорбира (или освобождава) топлина поради разкъсването (или образуването) на множество водородни връзки. Това обяснява високото специфична топлинавода.
При изпаряването на водата от организмите (транспирация в растенията, изпотяване при бозайници) се изразходва много топлина, която ги предпазва от прегряване.
Поради високата си топлопроводимост, водата осигурява равномерно разпределениетоплина между телесните тъкани (например през кръвоносната система). Така водата участва в регулирането на топлинния режим на тялото.
минерални соли и киселини.Минералните соли са необходими за поддържане на жизнената активност на клетките и тялото като цяло. В живите организми те са или в разтворена форма (дисоциирани на йони), или в твърдо състояние. От биологична гледна точка най-важните сред йоните са катионите K +, Na +, Ca 2+, Mgr + и анионите SG, HCO3, HPO ^, H0PO4.
Общото съдържание на минерални соли в различни клеткиварира от един до няколко процента. Ролята им в клетката е разнообразна. Така различни концентрации на йони K + и Na + вътре и извън клетките водят до появата на разлика в електрическите потенциали върху цитоплазмената мембрана, което е много важно за предаването на нервните импулси, както и за транспорта на вещества през мембраната. С намаляване на тази разлика възбудимостта на клетките намалява.
Някои йони са от съществено значение за синтеза на органични вещества. Например, остатъците от фосфорна киселина са част от нуклеотидите и АТФ, йонът Fe 2+ е част от хемоглобина, Mg 2+ е част от хлорофила и т.н. Йоните NO3, NHJ са източници на азотни атоми, йони SO 2- - серни атоми, които са необходими на автотрофните организми за синтеза на аминокиселини. Регулаторната функция и активирането на много ензими се осъществяват от Ca 2+ и Mg 2+ йони. Освен това йони Mg 2 * активират енергийния метаболизъм и синтеза на АТФ.
Калциевите съединения (например CaCO 3) са част от черупките на мекотели, черупки на ракообразни и други животни. При някои протести вътреклетъчният скелет е изграден от силициев (IV) оксид Si0 2 или стронциев сулфат SrS0 4 .
Неорганичните киселини също действат важни характеристикив тялото. И така, в стомаха на гръбначните, солната киселина създава кисела среда, допринасяйки за унищожаването на патогените и активирането на ензимите на стомашния сок и стимулира контракциите на стомашните стени. Въглеродната киселина и нейните аниони образуват бикарбонатна буферна система, а анионите на фосфорната киселина образуват фосфатна буферна система.
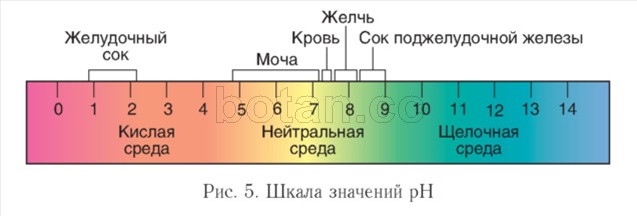
Киселинност на околната среда.Ходът на биохимичните реакции в живите организми се влияе значително от концентрацията на водородни йони (H +) - киселинност на околната среда. ATв неутрални разтвори тази концентрация е 1 (G 7 mol/l. За да се характеризира киселинността на средата, е удобно да се използва pH стойност ( pH) и шкалено рН(фиг. 5).
Във водни разтвори стойността на pH обикновено приема стойности от 0 до 14. Неутралната среда се характеризира със стойност на pH = 7, в алкална среда pH е по-голяма от 7, в кисела е по-малко от 7. Колкото повече стойността на pH се различава от 7, толкова по-кисел или алкален е разтворът.
Вътре в клетките средата е неутрална или слабо алкална (рН = 7,0-7,3), в кръвта рН е малко по-високо, отколкото в клетките и обикновено варира от 7,35-7,45. В храносмилателния тракт pH варира значително. Екстремни стойности на pH са характерни за стомаха (1-2) и тънките черва (повече от 8). В урината се наблюдават значителни колебания в pH (4,8-7,4).
Концепцията за буферни разтвори.Живите организми като цяло и техните отделни клетки имат способността да поддържат киселинността на околната среда на определено ниво. При поддържане на слабо алкална реакция на извънклетъчната среда
участват въглеродна киселина H 2 CO 3 и хидрокарбонатен йон HCO3. Въглеродната киселина е слаб електролит, в разтвор определена част от нейните молекули се дисоциира и се наблюдава баланс:
H 2 C0 3 ^ H + + HCod.
Ако по някаква причина концентрацията на H + йони в разтвора се увеличи (средата става по-кисела), HCO аниони ги свързват:
H + + HCO3 ->. H 2 C0 3.
Ако киселинността на средата намалее, молекулите на въглеродната киселина се дисоциират, освобождавайки допълнителни водородни йони:
H2C03H + + HCO3.
Така в разтвора се поддържа относително постоянна концентрация на Н + йони. По подобен начин анионите на фосфорната киселина HoPO^ и HPO^ поддържат неутрална или леко алкална среда вътре в клетките. Разтвори, в които при промяна на състава на средата се осигурява относително постоянство на концентрацията на водородните йони (H +) се наричат буфер.
1. Какви неорганични вещества влизат в състава на живите организми?
2. Кои вещества се наричат хидрофилни? Хидрофобни? Дай примери.
3. Опишете биологична роляминерални соли и киселини.
4. Колко вода се съдържа в живите организми? От какво зависи? Защо растенията изсъхват при липса на вода?
5. Два разтвора на глюкоза са разделени от мембрана, която не позволява на глюкозните молекули да преминават, но позволява на водата да преминава. Концентрацията на глюкоза в първия разтвор е 1%, във втория - 0,1%. Какво се случва с водните молекули? Как се казва това явление?
6. Какви са основните функции на водата в живите организми? Както физически, така и Химични свойствавода, свързана с нейните биологични функции?
7. Защо според вас повечето полярни вещества се разтварят добре във вода, докато неполярните по правило са неразтворими в нея?
8. Буферните свойства на извънклетъчната среда се осигуряват от въглеродната киселина и бикарбонатния йон, а вътре в клетките тази функция се изпълнява от аниони на фосфорната киселина. Защо тези съединения правят възможно поддържането на определена концентрация на водородни йони в разтворите, докато азотът и солна киселина, както и техните аниони, нямат такива свойства?
- § 1. Съдържанието на химичните елементи в организма. Макро- и микроелементи
- § 2. Химични съединения в живите организми. неорганични вещества
- § 10. Историята на откриването на клетката. Създаване на клетъчната теория
- § 15. Ендоплазмен ретикулум. комплекс Голджи. лизозоми
Глава 1. Химични компоненти на живите организми
Глава 2. Клетка – структурна и функционална единица на живите организми
Глава 3
1. Какви неорганични вещества влизат в състава на живите организми?
Съставът на живите организми включва такива неорганични вещества като вода, минерални соли, неорганични (минерални) киселини и някои други.
2. Кои вещества се наричат хидрофилни? Хидрофобни? Дай примери.
Хидрофилните вещества са вещества, които активно взаимодействат с водните молекули с образуването на водородни връзки. Като правило хидрофилните вещества са силно разтворими във вода. Хидрофобните вещества слабо взаимодействат с водните молекули, "стремят се" да избягват контакт с нея. Такива вещества не се разтварят във вода. За основно ниво на обучение по биология е достатъчно студентите да характеризират хидрофилните вещества като разтворими във вода, а хидрофобните вещества като неразтворими във вода.
Хидрофилни вещества са например моно- и дизахариди, нисши алкохоли, нисши карбоксилни киселини, много неорганични киселини и соли. Хидрофобните включват мазнини, висши карбоксилни киселини и някои други вещества.
3. Опишете биологичната роля на минералните соли и киселини.
Неразтворимите минерални соли са част от различни поддържащи структури на живите организми, например калциевият карбонат (CaCO 3) е част от черупките на мекотели и ракообразни. Вътреклетъчният скелет на някои протисти е изграден от стронциев сулфат (SrSO 4).
Разтворимите минерални соли в живите организми са под формата на йони. в водна среданастъпва тяхната дисоциация. От биологична гледна точка сред йоните най-важни са катионите K + , Na + , Ca 2+ , Mg 2+ и анионите Cl - , HCO 3 - , HPO 4 2- , H 2 RO 4 - . Различна концентрацияК + и Na + йони вътре и извън клетките води до появата на разлика в електрическите потенциали на цитоплазмената мембрана, което е важно за предаването на нервните импулси и за транспорта на вещества през мембраната. С намаляване на тази разлика възбудимостта на клетките намалява. Остатъците от фосфорна киселина са част от нуклеотидите и АТФ. Fe 2+ е част от хемоглобина, Mg 2+ е част от хлорофила. Йоните NO 3 - и NH 4 + са източници на азотни атоми, а йони SO 4 2 - - на серни атоми, които са необходими на автотрофните организми за синтеза на аминокиселини. Йоните на Ca 2+ и Mg 2+ изпълняват регулаторна функция, активират много ензими. Например йони Mg 2+ активират енергийния метаболизъм и синтеза на АТФ.
Минералните (неорганични) киселини също изпълняват важни биологични функции. Солната киселина създава киселинна среда в стомаха на гръбначните животни и хората, като допринася за унищожаването на патогените и активирането на ензимите на стомашния сок и стимулира контракциите на стомашните стени. Анионите на фосфорната киселина образуват фосфатна буферна система, която поддържа неутрална или леко алкална среда вътре в клетките. Въглеродната киселина и нейните аниони образуват бикарбонатна буферна система, която поддържа леко алкална реакция на извънклетъчната среда.
4. Колко вода се съдържа в живите организми? От какво зависи? Защо растенията изсъхват при липса на вода?
Съдържанието на вода зависи от вида на организма, неговата възраст, вида на клетките (тъканите) и тяхното физиологично състояние. Например при хората сивото вещество на мозъка съдържа около 85% вода, а костната тъкан - 22%. Най-високо водно съдържание в организма се наблюдава в ембрионалния период (около 95%) и постепенно намалява с възрастта, което води до намаляване на функционалната активност на клетките, тъканите и тялото като цяло.
Водата определя обема на клетката и вътреклетъчното (тургорно) налягане, което причинява стресово състояние на клетъчната мембрана. При липса на вода в клетките тургорното налягане намалява, така че растенията изсъхват.
5. Два разтвора на глюкоза са разделени от мембрана, която не позволява на глюкозните молекули да преминават, но позволява на водата да преминава. Концентрацията на глюкоза в първия разтвор е 1%, във втория - 0,1%. Какво се случва с водните молекули? Как се казва това явление?
Водните молекули се движат през полупропусклива мембрана от по-малко концентриран разтвор (с масова част на глюкоза 0,1%) към по-концентриран разтвор (с масова част на глюкоза 1%). Това явление се нарича осмоза. Осмозата изравнява концентрациите на глюкоза в разтвори, разделени от полупропусклива мембрана.
6. Какви са основните функции на водата в живите организми? Как физичните и химичните свойства на водата са свързани с нейните биологични функции?
Водата е част от клетките и междуклетъчното вещество, е в основата на кръвта, лимфата, тъканната течност, секретите на жлезите. Той определя обема на клетките и осигурява поддържането на тургорното налягане. Водата е универсален разтворител за полярните съединения и основна среда, в която протичат метаболитните процеси на живите организми. Повечето химични реакции в тялото протичат във водни разтвори. Влизането и излизането на вещества от клетките по правило се извършва в разтворена форма. Водата като разтворител участва в явленията на осмозата, поради което се изравняват концентрациите на разтворените вещества в клетките и извънклетъчната среда.
Водата е пряк участник в много биохимични реакции, например реакции на хидролитично разцепване (хидролиза) на органични съединения. Той е един от изходните материали в реакциите на фотосинтеза. Кислородът, освободен по време на фотосинтезата, идва от разграждането на водните молекули.
Водата участва в регулирането на топлинния режим на организмите. Осигурява равномерно разпределение на топлината между тъканите и органите, предотвратява резки температурни промени в клетките и тялото като цяло, дори когато температурните колебания в околната среда са достатъчно големи. При изпаряването на водата от организмите (транспирация в растенията, изпотяване при бозайници) се изразходва много топлина, която ги предпазва от прегряване.
Водата е универсален разтворител и среда за метаболитни процеси поради полярността на молекулите и способността им да образуват междумолекулни водородни връзки с други съединения. Малкият размер на водните молекули играе важна роля в осмотичните явления. Участието на водата в регулирането на топлинния режим на организмите е свързано с нейния висок топлинен капацитет, добра топлопроводимост и висока топлина на изпаряване. Това от своя страна се дължи на способността на водните молекули да образуват множество водородни връзки помежду си.
7. Защо според вас повечето полярни вещества се разтварят добре във вода, докато неполярните по правило са неразтворими в нея?
Водните молекули са полярни, което им позволява да взаимодействат интензивно с други полярни вещества. Водата допринася за отделянето на структурни частици от полярни съединения (йони, молекули), преминаването им в разтвор, образува хидратационни обвивки около йони и полярни молекули.
Водните молекули взаимодействат много слабо с неполярни съединения. Такива вещества са практически неразтворими във вода, но лесно разтворими в неполярни разтворители (например в бензин). Тук е уместно да си припомним древното правило на алхимиците: „Подобното се разтваря в подобно”.
осем*. Буферните свойства на извънклетъчната среда се осигуряват от въглеродна киселина и бикарбонатен йон, вътре в клетките тази функция се изпълнява от аниони на фосфорната киселина. Защо тези съединения позволяват поддържането на определена концентрация на водородни йони в разтворите, докато азотната и солната киселина, както и техните аниони, нямат такива свойства?
Въглеродната киселина е слаб електролит. Във водните разтвори само малка част от нейните молекули се дисоциират на йони, следователно в междуклетъчната среда, заедно с бикарбонатните йони (HCO 3 -), се съдържат и недисоциирани молекули на въглеродна киселина (H 2 CO 3). Вътре в клетките има известен баланс (равновесие) между анионите на фосфорната киселина H 2 PO 4 - и HPO 4 2-:
H 2 CO 3 ↔ H + + HCO 3 -
H 2 RO 4 – ↔ H + + HRO 4 2–
С намаляване на киселинността на средата, равновесието се измества вдясно - отделят се допълнителни водородни йони (H +). С повишаване на киселинността равновесието се измества наляво - има свързване на "допълнителни" H + йони. Поради това реакцията на извънклетъчната среда (или вътреклетъчното съдържание) практически не се променя.
Азотната и солната киселина са силни електролити. Когато се разтварят във вода, те почти напълно се дисоциират в йони:
HNO 3 → H + + NO 3 -
HCl → H + + Cl –
Дисоциацията на силните електролити е практически необратима, така че техните разтвори нямат буферни свойства.
* Задачите, отбелязани със звездичка, изискват от учениците да изложат различни хипотези. Следователно, когато поставя оценка, учителят трябва да се съсредоточи не само върху дадения тук отговор, но да вземе предвид всяка хипотеза, оценявайки биологичното мислене на учениците, логиката на техните разсъждения, оригиналността на идеите и т.н. Препоръчително е учениците да бъдат запознати с дадения отговор.
Както вече знаем, клетката се състои от химични веществаорганични и неорганични видове. Основните неорганични вещества, които изграждат клетката, са солите и водата.
Водата като компонент на живота
Водата е доминиращият компонент на всички организми. Важни биологични функции на водата се изпълняват от уникални свойстванеговите молекули, по-специално наличието на диполи, които правят възможно възникването на водородни връзки между клетките.
Благодарение на водните молекули в тялото на живите същества протичат процесите на термична стабилизация и терморегулация. Процесът на терморегулация се дължи на високия топлинен капацитет на водните молекули: външните температурни промени не влияят на температурните промени вътре в тялото.
Благодарение на водата, органите човешкото тялозапазват своята еластичност. Водата е един от основните компоненти на смазочните течности, необходими за ставите на гръбначните животни или перикардната торбичка.
Той е включен в слузта, което улеснява движението на веществата през червата. Водата е компонент на жлъчката, сълзите и слюнката.
Соли и други неорганични вещества
Клетките на живия организъм, освен вода, съдържат и такива неорганични вещества като киселини, основи и соли. Повечето важноств живота на тялото имат Mg2+, H2PO4, K, CA2, Na, C1-. Слаби киселинигаранция стабилна вътрешна средаклетки (леко алкални).
Концентрацията на йони в междуклетъчното вещество и вътре в клетката може да бъде различна. Така, например, Na + йони са концентрирани само в междуклетъчната течност, докато K + се намира изключително в клетката.
Рязкото намаляване или увеличаване на броя на определени йони в състава на клетката води не само до нейната дисфункция, но и до смърт. Например, намаляването на количеството Ca + в клетката причинява гърчове вътре в клетката и нейната по-нататъшна смърт.
Някои неорганични вещества често взаимодействат с мазнини, протеини и въглехидрати. Така ярък примерса органични съединения с фосфор и сяра.
Сярата, която е част от протеиновите молекули, е отговорна за образуването на молекулярни връзки в тялото. Благодарение на синтеза на фосфор и органични вещества, енергията се освобождава от протеиновите молекули.
Калциеви соли
Калциевите соли допринасят за нормалното развитие на костната тъкан, както и за функционирането на мозъка и гръбначния мозък. Калциевият метаболизъм в организма се осъществява благодарение на витамин D. Излишъкът или липсата на калциеви соли води до дисфункция на организма.
