Koja jedinjenja reaguju sa vodom. Uloga vode u hemijskim procesima
Golikova Olga
Prezentacija odražava fizička svojstva vode; data je klasifikacija supstanci prema njihovoj rastvorljivosti u vodi; određivanje vodenih otopina i elektrolita. Prikazane su glavne odredbe teorije elektrolitičke disocijacije (TED). Date su definicije kiselina, baza i soli sa pozicije TED.Uloga vode prikazana je kao vozilo i kao učesnik u hemijskim reakcijama
Skinuti:
Pregled:
Za korištenje pregleda prezentacija, kreirajte Google račun (nalog) i prijavite se: https://accounts.google.com
Naslovi slajdova:
Ispunila učenica 11. razreda Golikova Olga Prezentacija iz hemije na temu: Uloga vode u hemijske reakcije
Voda je najčešći rastvarač na Zemlji, koji u velikoj mjeri određuje prirodu zemaljske hemije kao nauke. Većina hemije, na početku kao nauka, započela je upravo kao hemija vodenih rastvora supstanci. Sistematski naziv: vodonik oksid Tradicionalni nazivi: voda Hemijska formula: H 2 O Molarna masa: 18,01528 g/mol
Voda je bezbojna tečnost bez mirisa i ukusa, t bp = 100 °C, t pl = 0 °C, p = 1g/cm 3 (na 4 °C). Voda ne provodi struja, loš provodnik toplote, specifična toplota voda je veoma visoka. Voda je jedina supstanca koja se skuplja kada se očvrsne. Zbog toga je gustina leda manja od gustine tečne vode. Zbog toga led pluta na površini vode. Voda
Voda je jedinstvena Hemijska supstanca, čiju je ulogu u hemijskim reakcijama teško precijeniti voda Reakcioni medij Faktor disocijacije Reagens za transport tvari katalizator
U njemu se odvija veliki broj hemijskih reakcija vodena sredina. Prema rastvorljivosti u vodi, sve supstance se uslovno dele u tri grupe.Rastvorljivost supstanci u vodi
To su homogeni sistemi koji se sastoje od molekula vode, čestica otopljene tvari i proizvoda njihove interakcije.Proces hidratacije je rezultat interakcije vode sa molekulima otopljene tvari. Vodeni rastvori -
Supstance koje se u rastvorima raspadaju na ione se disociraju. Odnos broja molova supstance razložene na jone prema ukupnoj količini otopljene supstance naziva se stepen elektrolitičke disocijacije.Svi elektroliti se dele na: - jake (stepen disocijacije teži jedinstvu) - slabe (disociraju veoma malo u rastvorima) Elektroliti
Svante August Arrhenius (1859-1927) švedski hemičar i fizičar. 1887. konačno je formulirao teoriju elektrolitičke disocijacije, 1887. je objasnio odstupanje otopina elektrolita od Vant Hoffovih zakona i Raoultovog zakona (prikazano fizičko značenje faktor korekcije i). Stvorio je teoriju izohidričnosti, razvio teoriju hidrolize soli. Utvrđena egzotermna priroda većine procesa disocijacije elektrolita i zavisnost brzine i potpunosti ovih procesa od temperature. Teorija elektrolitičke disocijacije
Kiseline su elektroliti koji se disociraju na vodikove katione i anjone kiselinskog ostatka; Baze su elektroliti koji se disociraju na metalne (amonijum ili organske baze) katione i hidroksidne anjone.
Svi tekući mediji su više od 90-98% vode; Krv prenosi kiseonik po celom telu hranljive materije, hormone i druga jedinjenja, dok se uklanjaju ugljen-dioksid i produkti raspadanja Uloga vode kao vozila
Reakcija hidratacije (reakcija adicije) reakcija hidratacije acetilenskih jedinjenja sa stvaranjem karbonilnih jedinjenja. Prilikom hidratacije acetilena nastaje acetaldehid, u slučaju supstituiranih acetilena - uglavnom ketoni Voda kao učesnik u hemijskim reakcijama
Izvor je čistog vodonika i kiseonika. Interakcija vodika i kisika služi kao reakcija koja vam omogućava da stavite u orbitu svemirski brodovi Voda je uključena u procese elektrolize
Hvala vam na pažnji
1. Kakva je struktura molekula vode? Koja su njegova fizička svojstva?
2. Proširiti integrativnu ulogu vode u prirodnim naukama – između hemije, biologije, fizike i geografije. Da li je moguće to učiniti sasvim u potpunosti bez problema sa strukturiranjem i ažuriranjem integracije? 
3. Razgovarajte o ulozi vode u rastvoru ekonomski problemi društvo. 
4. Otvorite globalni problem humanost je problem svježa voda na Zemlji i ponuditi način da se to riješi. 
5. Recite nam o ulozi vode u hemijskim reakcijama. 
6. Dokažite da je disocijacija elektrolita rezultat procesa hidratacije. Koju su ulogu imali ruski hemičari u proučavanju ove strane teorije elektrolitičke disocijacije? 
7. Koliki je stepen elektrolitičke disocijacije? Na koje se grupe dijele elektroliti prema stupnju elektrolitičke disocijacije? Navedite primjere predstavnika svake grupe. 
8. Navedite hemijska svojstva vode. Koje od ovih svojstava su od praktične koristi? 
9. Šta su kristalni hidrati? Koji proces je u osnovi primjene gipsanih odljevaka ili izrade komada od alabastera? 
10. Zapišite jednadžbe reakcija pomoću kojih možete izvršiti sljedeće transformacije: 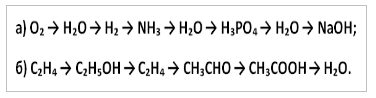
MBOU "Srednja škola Molodkovskaya"
Mglinsky okrug, Bryansk regija
Nastavnica hemije: Shtyrhunova Tatyana Alexandrovna
Sinopsis časa hemije u 11. razredu na temu: "Uloga vode u hemijskim reakcijama."
Svrha časa: Sistematizirati znanje o sastavu, strukturi, svojstvima vode, značenju, bivstvu u njoj priroda, problemi svježa voda.
Ciljevi lekcije: 1. Razmotriti raznim oblastima uloga vode u hemijskim reakcijama.
2. Razvijati logičko mišljenje, veštine dobijanja informacija iz različitih izvora, usaditi veštine samoorganizacije i samopoštovanja.
3. Obrazovati učenike u odnosu na vodu kao nezamjenjivu supstancu u životu svih živih organizama.
Vrsta lekcije: Kombinovani čas.
Polovna oprema:kompjuter, multimedijalni projektor, kartice, tabela rastvorljivosti, veliki broj aktivnih metala.
Korišteni COR:kompjuterska prezentacija.
Formirana hemijska znanja, sposobnosti, veštine učenika: sistematizacija znanja učenika o rasprostranjenosti vode u prirodi, fizičkim i hemijska svojstva, oblasti primene vode, proširivanje znanja učenika o ulozi vode, o pitanja životne sredine svježa voda.
Formirane kompetencije:
obrazovna i kognitivna kompetencija: razvoj vještina za upoređivanje, analizu, dokazivanje, sposobnost rješavanja sljedećih vitalnih praktičnih zadataka: sposobnost procjene stanja okruženje, iznoseći svoje ideje za zaštitu vodnih resursa svog rodnog kraja;informatička kompetencija: razvoj sposobnosti analize i odabira potrebne informacije, sposobnost pripreme i sastavljanja poruka, mogućnost korištenja interneta za traženje obrazovnih informacija.
Tokom nastave.
1. Organizacioni momenat.
Provjera d.z.
Odgovaraju na brojna pitanja na temu: Reverzibilne i ireverzibilne reakcije Hemijska ravnoteža.
2. Uvodna reč nastavnika.
Učitelju. Ljudi, u današnjoj lekciji ćemo se upoznati sa neverovatnom supstancom, njegovom fizička svojstva, anomalije, bitak u prirodi, vrijednosti i prirodni rezervati. Pozivam vas da otputujete u Zemlju čudesnih transformacija i provedete naš čas pod motom „Radost viđenja i razumijevanja je najveći dar prirode.“ (A. Einstein) Koga ćemo stanovnika ove zemlje danas sresti?
Slajd 1. Pročitao sam pjesmu o vodi.
Dakle, o kojoj će se materiji govoriti u lekciji?
Formuliram temu lekcije, predstavljam svrhu lekcije.
„Voda… Nemaš ukus, boju, miris, ne možeš se opisati – uživaš ne znajući šta si.
Vi niste samo neophodni za život, vi ste sam život. Ti si bog, ti si savršenstvo, jesinajveće bogatstvo na svijetu"
Ove riječi o vodi je napisao francuski pisacAntoine de Saint-Exupery.
I naša lekcija je posvećenanajpoznatije i u isto vreme najmisterioznijematerija je voda.
Temu lekcije zapisujemo u sveske: « Uloga vode u hemijskim reakcijama.
Uvodni govor nastavnika o vodi:
Voda je poznata i neshvatljiva, nevjerovatna, paradoksalna, misteriozna, nepredvidiva. Ne postoji broj epiteta koji bi u potpunosti mogli okarakterizirati ovu jedinstvenu supstancu. Bila je i ostala muza, izvor inspiracije za pjesnike, umjetnike, kompozitore, naučnike koji dugi niz godina otkrivaju tajne ovog velikog stvaranja prirode i ne prestaju da se čude onome što uče.
Upoznavanje sa slajdovima" 2-6.
Učitelju. Iz kursa geografije znate da je voda najčešća supstanca na Zemlji.
Poruka 1. "Voda na Zemlji"
Voda je najvažnija, najvažnija supstanca u svijetu oko nas. I poznata je i nepoznata, i poznata, i tajanstvena... Prirodna voda! Pogledajte nebo i vidjet ćete oblake ili oblake koji se protežu miljama. Kako lako lebde! Ali nemojte zamišljati da su bestežinski. Masa od 1 km3 oblaka je oko 2000 tona, au Zemljinoj atmosferi vodene pare je oko 12300 km3 i to je takođe prirodna voda. Svi znaju strujukopneni tokovi: potoci, rječice, rijeke. Ponekad se široko i slobodno šire po ravnici, ponekad formiraju snažne brzake, padaju sa visine od desetine i stotine metara u vodopadima, noseći svoje vode u okeane i mora. Oko 71% površine naše Zemlje prekriveno je Svjetskim okeanom, što čini oko 97% svih površinske vode i polovina litosfere.
Toliko ili malo vode na Zemlji? Veoma malo! Voda čini oko 2,5 milijardi km3 ukupne zapremine Zemlje.
Vodena ljuska Zemlje je 1,5 milijardi km3, a ostatak je u dubokim slojevima zemljine kore. Većina vode je slana, a useljiva, slatka, svega oko 5 miliona km3. Svake godine čovjeku je potrebno sve više svježe vode, čista voda. Čovječanstvu prijeti kriza zbog zagađenja vode. Neke zemlje već imaju nedostatak čiste slatke vode i prisiljene su je uvoziti iz inostranstva. Voda mora biti zaštićena.
Učitelju. Iz vašeg kursa biologije znate da je voda neraskidivo povezana sa postojanjem života na Zemlji.
Koliko vode ima u ljudskom tijelu?(65%- 75%)
Jeste li znali da mozak sadrži80% vode.6 slajd.
Poruka 3. "Voda u živom organizmu"
Sva živa bića na našoj planeti su 2/3 vode. Po sadržaju vode u živom organizmu, mikroorganizmi su na prvom mjestu po masi, biljke na drugom, životinje na trećem, a ljudi na posljednjem.
Bakterije čine 81% vode, spore 50%, životinjsko tkivo u prosjeku 70%, limfa 90%. Najbogatije vodom je staklasto tijelo oka, koje sadrži do 99% vlage.
Voda u tijelu obavlja nekoliko funkcija: tvari otopljene u njoj reagiraju jedna na drugu, voda pomaže u uklanjanju metaboličkog otpada, služi kao regulator temperature, dobar je nosač topline, kao i mazivo.
U živim organizmima voda se može sintetizirati u tkivima. Tako, na primjer, kod kamile, mast u grbi, oksidirana, može odustati do40 litara vode. Osoba koja dnevno popije 2,5 litara vode dnevno ispira stomak sa 10 litara tečnosti i ispari 0,7 litara vode.
2 .Struktura molekula vode ifizička svojstva (7 slajdova i 8).
(prednja anketa)
Slajd 9. Pronađite hemijske greške u tekstu (rad radimo frontalno).
Učitelj: Vaši odgovori su pokazali da ste spremni za sljedeće putovanje.
Da, uloga vode u hemijskim reakcijama je višestruka. Slajd 11.
12. Voda je reakcioni medij.
Voda je najbolji rastvarač na svetu, rastvara mnoge čvrste, tečne i gasovitim materijama. Voda mora i okeana sadrži gotovo sve elemente periodični sistem, milijarde tona metalnih ruda. okeanska voda Zbog toga je zovu „tečna ruda“, iz nje se vade natrijum, hlor, zlato, uranijum i razne soli.Ovo svojstvo vode je od velikog značaja za prirodu, gotovo sve hemijske transformacije na Zemlji, uključujući i one u živim organizmima, dešavaju se u vodi, u njenom prisustvu ili uz njeno učešće.
Zbog visokog polariteta molekula, voda je u stanju otopiti mnoge tvari s jonskim i kovalentnim polarnim vezama.
U odnosu na vodu, tvari se dijele na:
1) rastvorljiv2) nerastvorljiv3) teško rastvorljiv Slide13.
Razmotrite tabelu rastvorljivosti supstanci.
Koristeći tablicu rastvorljivosti,napišite primjere na tabli.
Ba(OH)2,KCl,BaSO4, CaSO4,NaNO3, CuSO4, HNO3, AgCl,FeS, Ca(OH)2
Slajd 14. Voda je faktor disocijacije.
Slajd 15. Vodeni katalizator.
Zapamtite, šta je katalizator?
Slajd 16. Voda je transporter materija.
Poruka.
Doslovno svaki proces u tijelu odvija se uz pomoć vode. Svaka ćelija je zasićena vodom, svaka hemijska reakcija se odvija uz pomoć vode. To uključuje kemijske reakcije koje se odvijaju u vašem tijelu koje proizvode energiju, pomažući vam da ostanete aktivni i imate efikasan metabolizam. Budući da je voda komponenta krvi koja opskrbljuje vaše tijelo hranjivim tvarima, u krvi mora biti dovoljno vode da isporuči hranjive tvari u svaku ćeliju. Nedostatak vode usporava metabolizam.
Slajd 17. Voda je reagens.Prisjetimo se s čime voda reaguje?
Voda je jedna od najreaktivnijih supstanci.
Učenik: Iz obrađenog materijala znamo da oksidi, hidridi, alkalni metali stupaju u interakciju sa vodom....i drugim supstancama (takozvanim)
Odgovaraju na brojna pitanja.
Šta nastaje kada bazični oksid reaguje sa vodom?kiseli oksid?.....
Zapišite jednačine reakcija u svesku.
Kontrola usvajanja nastavnog materijala.
Učitelj: Dakle, otplovili smo do krajnje stanice, hajde da uradimo nekoliko zadataka.
Slajd 19. Sa kojim materijama reaguje voda? Zapišite jednačine reakcija (Rad u parovima) Zatim provjeravamo zadatak.
Slajd 18. Navedite ulogu vode u navedenim procesima.
Zapišite u svesku, pa provjerite.
Slajd 20. O čemu u pitanju u ovom odlomku? Kakvu ulogu igra voda?
Sumiranje lekcije Slajd 21. Christina čita stih o vodi.
Zaključak: Šta je voda?
Slajd 22. Štedi vodu.
Učitelju : Zapamtite da se zalihe čiste vode stalno iscrpljuju, imoramo čuvati vodu.
10. Refleksija.
Na stolovima učenika su tri kartice u boji uz pomoć kojih ćemo ocjenjivati čas.
Plavi karton - "3", žuti karton - "4", crveni karton - "5".
Kako biste ocijenili svoje znanje stečeno na današnjoj lekciji?
Kako ocjenjujete rad svojih drugova iz razreda na času?
Kako ocjenjujete lekciju u cjelini?
Ocjenjivanje lekcije.
11. Domaći zadatak: pasus 17, br. 3,4,5.
