Какие соединения реагируют с водой. Роль воды в химических процессах
Голикова Ольга
В презентации отражены физические свойства воды; дана классификация веществ по растворимости в воде; определения водных растворов и электролитов. Представлены основные положения теории электролитической диссоциации (ТЭД). Даны определения кислот, оснований и солей с позиции ТЭД Показана роль воды как транспортного средства и как участника химических реакций
Скачать:
Предварительный просмотр:
Чтобы пользоваться предварительным просмотром презентаций создайте себе аккаунт (учетную запись) Google и войдите в него: https://accounts.google.com
Подписи к слайдам:
Выполнила ученица 11 класса Голикова Ольга Презентация по химии на тему: Роль воды в химических реакциях
Вода является наиболее распространённым растворителем на Земле, во многом определяющим характер земной химии, как науки. Большая часть химии, при её зарождении как науки, начиналась именно как химия водных растворов веществ. Систематическое наименование: оксид водорода Традиционные названия: вода Химическая формула: Н 2 O Молярная масса: 18,01528 г/моль
Вода – это жидкость без цвета, запаха и вкуса, t кип = 100 °C, t пл = 0 °C, p= 1г/см 3 (при 4 °С). Вода не проводит электрический ток, плохо проводит тепло, удельная теплоемкость воды очень высокая. Вода - единственное вещество, которое при затвердении сжимается. Поэтому плотность льда меньше плотности жидкой воды. Вот почему лёд плавает на поверхности воды. Вода
Вода – уникальное химическое вещество, роль которого в химических реакциях трудно переоценить вода Реакционная среда Фактор диссоциации Транспорт веществ реагент катализатор
Огромное число химических реакций протекает в водной среде. По растворимости в воде все вещества условно делятся на три группы Растворимость веществ в воде
Это гомогенные системы, состоящие из молекул воды, частиц растворенного вещества и продуктов их взаимодействия Процесс гидратации – результат взаимодействия воды с молекулами растворяемого вещества Водные растворы -
Вещества, которые в растворах распадаются на ионы – диссоциируют. Отношение числа молей вещества, распавшегося на ионы, к общему количеству растворенного вещества называют степенью электролитической диссоциации Все электролиты подразделяют на: - сильные (степень диссоциации стремится к единицы) - слабые (в растворах диссоциируют очень незначительно) Электролиты
Сванте Август Аррениус (1859-1927) Шведский химик и физик. В 1887 окончательно сформулировал теорию электролитической диссоциации, в 1887 объяснил отступление растворов электролитов от законов Вант-Гоффа и закон Рауля (показал физический смысл поправочного коэффициента i). Создал учение об изогидричности, разработал теорию гидролиза солей. Установил экзотермический характер большинства процессов диссоциации электролитов и зависимость скорости и полноты протекания этих процессов от температуры. Теория электролитической диссоциации
Кислоты – это электролиты, диссоциирующие на катионы водорода и анионы кислотного остатка; Основания – это электролиты, диссоциирующие на катионы металла (аммония или органического основания) и гидроксид-анионы Соли – это электролиты, диссоциирующие на катионы металла (аммония или органического основания) и анионы кислотного остатка Три типа электролитов
Все жидкие среды более чем на 90-98 % состоят из воды; Кровь разносит по организму кислород, питательные вещества, гормоны и другие соединения, удаляя при этом углекислый газ и продукты распада Роль воды как транспортного средства
Реакция гидратации (реакция присоединения) реакция гидратации ацетиленовых соединений с образованием карбонильных соединений. При гидратации ацетилена образуется ацетальдегид, в случае замещенных ацетиленов - главным образом кетоны Вода как участник химических реакций
Является источником получения чистых водорода и кислорода. Взаимодействие водорода и кислорода служит той реакцией, которая позволяет выводить на орбиту космические корабли Вода участвует в процессах электролиза
Спасибо за внимание
1. Какое строение имеет молекула воды? Каковы ее физические свойства?
2. Раскройте интегрирующую роль воды в естествознании – между химией, биологией, физикой и географией. Возможно ли без структурирования и актуализации интеграционных проблем достаточно полно сделать это?
3. Расскажите о роли воды в решении экономических проблем общества.
4. Раскройте глобальную проблему человечества – проблему пресной воды на Земле и предложите путь ее решения.
5. Расскажите о роли воды в химических реакциях.
6. Докажите, что диссоциация электролита – это результат процесса гидратации. Какую роль сыграли русские химики в изучении этой стороны теории электролитической диссоциации?
7. Что такое степень электролитической диссоциации? На какие группы делят электролиты по степени электролитической диссоциации? Приведите примеры представителей каждой группы.
8. Перечислите химические свойства воды. Какие из этих свойств находят практическое применение?
9. Что такое кристаллогидраты? Какой процесс лежит в основе наложения гипсовых повязок или изготовления изделий из алебастра?
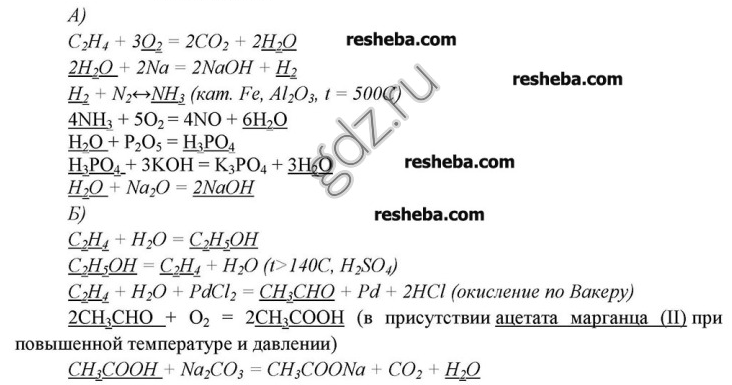
10. Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения: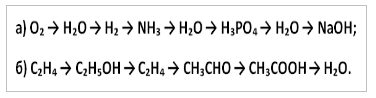
МБОУ»Молодьковская СОШ»
Мглинский район Брянская обл.
Учитель химии:Штырхунова Татьяна Александровна
Конспект урока химии в 11 классе по теме:»Роль воды в химических реакциях.»
Цель урока: Систематизировать знания о составе, строении,свойствах воды,значении,нахождении в природе,о проблемах пресной воды.
Задачи урока:1.Рассмотреть различные области роли воды в химических реакциях.
2.Развивать логическое мышление,навыки получения информации из различных источников.Прививать навыки самоорганизации и самооценки.
3.Воспитывать у уч-ся отношение к воде как незаменимому веществу в жизни всех живых организмов.
Тип урока: Комбинированный урок.
Используемое оборудование: компьютер, мультимедийный проектор,карточки,таблица растворимости,ряд акт.металлов.
Используемые ЦОР: компьютерная презентация .
Формируемые химические знания, умения, навыки учащихся: систематизация знаний учащихся о распространенности воды в природе, физических и химических свойствах, областях применения воды, расширение знаний учащихся о роли воды, об экологических проблемах пресной воды.
Формируемые компетенции:
учебно-познавательная компетенция: развитие умений сравнивать, анализировать, доказывать, быть способными решать следующие жизненно-практические задачи: умение давать оценку состояния окружающей среды, выдвижение своих идей по охране водных ресурсов родного края; информационная компетенция: развитие умения анализировать и отбирать необходимую информацию, умения готовить и делать сообщения, умения пользоваться интернетом для поиска учебной информации.
Ход урока.
1.Оранизационный момент.
Проверка д.з.
Отвечают на ряд вопросов по теме:Обратимые и необратимые реакции.Химическое равновесие.
2.Вступительное слово учителя.
Учитель. Ребята, на сегодняшнем уроке мы познакомимся с удивительным веществом, его физическими свойствами, аномалиями, нахождением в природе, значением и природными запасами. Приглашаю вас совершить путешествие в Страну чудесных превращений и провести наш урок под девизом»Радость видеть и понимать есть самый великий дар природы.»(А.Эйнштейн) С каким же жителем этой страны мы познакомимся сегодня?
Слайд1.Читаю стих.о воде.
Итак, о каком веществе речь пойдет на уроке?
Формулирую тему урока,знакомлю с целью урока.
«Вода… Ты не имеешь ни вкуса, ни цвета, ни запаха, тебя невозможно описать – тобой наслаждаешься, не ведая, что ты такое.
Ты не просто необходима для жизни, ты и есть сама жизнь. Ты божество, ты совершенство, ты самое большое богатство на свете »
Такие слова написал о воде французский писатель Антуан де Сент –Экзюпери.
И наш урок посвящается самому знакомому и в то же время самому загадочному веществу – воде.
Записываем в тетрадях тему урока: « Роль воды в химических реакциях».
Вступительное слово учителя о воде:
Вода – знакомая и непостижимая, удивительная, парадоксальная, загадочная, непредсказуемая. Нет числа эпитетам, которые могли бы в полной мере охарактеризовать это уникальное вещество. Она была и остается музой, источником вдохновения поэтов, художников, композиторов, ученых, которые многие годы разгадывают тайны этого великого создания природы и не перестают удивляться тому, что узнают.
Знакомство со слайдами»2- 6.
Учитель. Из курса географии вам известно, что вода это самое распространенное вещество на Земле.
Сообщение 1. «Вода на Земле»
Вода – это самое главное, самое важное вещество в окружающем нас мире. Она и знакома, и незнакома, и известна, и загадочна…Природная вода! Взгляните на небо, и вы увидите облака или тучи, которые тянутся на многие километры. Как легко плывут они! Но не воображайте, что они невесомы. Масса 1км3 облаков составляет около 2000 т, а в атмосфере Земли водяного пара около 12300 км3, и это тоже природная вода. Все знают текущие по суше потоки: ручьи, речушки, реки. Иногда они широко и вольно разливаются по равнине, иногда образуют мощные стремнины, падают с высоты десятков и сотен метров водопадами, неся свои воды в океаны и моря. Около 71% поверхности нашей Земли покрыто Мировым океаном, составляющим около 97% всех поверхностных вод и половину литосферных.
Так много или мало воды на Земле? Очень мало! От всего объема Земли на воду приходится около 2,5 млрд. км3.
Водная оболочка Земли составляет 1,5 млрд. км3, а остальная находится в глубоких слоях земной коры. Большая часть воды соленая, а пригодной для жизни, пресной, всего около 5 млн. км3. Человеку же с каждым годом требуется все больше пресной, чистой воды. Человечеству угрожает кризис из –за загрязнения воды. Некоторые страны уже испытывают нехватку чистой пресной воды и вынуждены ввозить ее из –за рубежа. Воду надо беречь.
Учитель. Из курса биологии вам известно, что вода неразделимо связана с существованием жизни на Земле.
Сколько воды в организме человека? (65%- 75%)
А известно ли вам, что мозг содержит 80% воды. 6 слайд.
Сообщение 3. «Вода в живом организме»
Все живое на нашей планете на 2/3 состоит из воды. На первом месте по содержанию воды в живом организме по массе стоят микроорганизмы, на втором - растения, на третьем – животные, на последнем – человек.
Бактерии на 81% состоят из воды, споры на 50%, ткани животных в среднем на 70%, лимфа – 90%. Самая богатая водой ткань -стекловидное тело глаза, которое содержит до 99% влаги.
Вода в организме выполняет несколько функций: растворенные в ней вещества реагируют друг с другом, вода помогает удалению отходов обмена веществ, служит регулятором температуры, являясь хорошим переносчиком тепла, а так же смазочным веществом.
У живых организмов вода может синтезироваться в тканях. Так, например, у верблюда жир в горбу, окисляясь, может дать до 40 л воды. Человек, выпивая 2,5 л воды в сутки, ежедневно промывает желудок 10 л жидкости и испаряет 0,7 л воды.
2 .Строение молекулы воды и физические свойства (7 слайд и 8).
(фронтальный опрос)
Слайд 9.Найдите химические ошибки в тексте(выполняем работу фронтально).
Учитель.Ваши ответы показали,что вы готовы к дальнейшему путешествию.
Да,многогранна роль воды в химических реакциях. Слайд 11.
12 слайд.Вода –реакционная среда.
Вода – самый лучший растворитель мире, она растворяет многие твердые, жидкие и газообразные вещества. В воде морей и океанов содержится почти все элементы периодической системы, миллиарды тонн металлических руд. Океанскую воду называют поэтому «жидкой рудой», из неё извлекают натрий, хлор, золото, уран, различные соли. Это свойство воды имеет огромное значение для природы, практически все химические превращения на Земле, в том числе и в живых организмах, происходят в воде, в её присутствии, или с её участием.
В силу высокой полярности молекул – вода способна растворять многие вещества с ионной и ковалентной полярной связью.
По отношению к воде вещества делятся на:
1)растворимые 2) нерастворимые 3) малорастворимые Слайд13.
Рассмотреть таблицу растворимости веществ.
Пользуясь таблицей растворимости, записать на доске примеры веществ.
Ba(OH)2, KCl, BaSO4, CaSO4, NaNO3, CuSO4, HNO3, AgCl, FeS, Ca(OH)2
Слайд14 .Вода-фактор диссоциации.
Слайд 15.Вода катализатор.
Вспомним,а что такое катализатор?
Слайд 16.Вода транспортировщик веществ.
Сообщение.
Буквально каждый процесс в организме происходит с помощью воды. Каждая клетка напитана водой, каждая химическая реакция происходит с помощью воды. Это включает в себя и те химические реакции, которые происходят в вашем теле и производят энергию, помогая вам оставаться активными и обладать эффективным обменом веществ. Поскольку вода является компонентом крови, которая снабжает ваш организм питательными веществами, в крови должно быть достаточно воды, чтобы доставлять питательные вещества в каждую клетку. Недостаток воды замедляет скорость обмена веществ.
Слайд17.Вода –реагент.Вспомним с чем реагирует вода?
Вода – одно из наиболее реакционно-способных веществ.
Ученик:Из пройденного материала нам известно, что с водой взаимодействуют оксиды,гидриды,щелочные металлы ….и др.вещества(наз. их)
Отвечают на ряд вопросов.
Что образуется при взаимодействии основного оксида с водой?кислотного оксида?.....
Записывают уравнения реакций в тетради.
Контроль над усвоением материала урока.
Учитель:Итак,мы приплыли на итоговую станцию.Выполним несколько заданий.
Слайд19.С какими веществами реагирует вода? Записать уравнения реакций.(работа в парах)Затем проверяем выполнение задания.
Слайд18.Укажите роль воды в перечисленных процессах.
Записать в тетрадь,затем проверяем.
Слайд20.О чем идет речь в данном отрывке? Какую роль выполняет вода?
Подведение итога урока.Слайд21.Читает Кристина стих о воде.
Делаем вывод:Что такое вода?
Слайд22.Берегите воду.
Учитель : Помните, что запасы чистой воды постоянно сокращаются, и мы должны экономно расходовать воду.
10. Рефлексия.
На столах у учеников лежат три цветные карточки, с помощью которых проведем оценку урока.
Синяя карточка – «3», жёлтая карточка – «4», красная карточка – «5».
Как вы оцениваете свои знания полученные на сегодняшнем уроке?
Как вы оцениваете работу ваших одноклассников на уроке?
Как вы оцениваете урок в целом?
Выставление оценок за урок.
11. Домашнее задание:параграф17,№3,4,5.
