Amoniacul aparține unui grup de substanțe chimice. Producția de amoniac în industrie. Obținerea amoniacului în laborator
amoniac -NH 3
Amoniacul (în limbile europene, numele său sună ca „amoniac”) își datorează numele oazei lui Ammon din Africa de Nord situate la răscrucea rutelor de rulote. În climatele calde, ureea (NH 2 ) 2 CO conținută în deșeurile animale se descompune deosebit de rapid. Unul dintre produsele de degradare este amoniacul. Potrivit altor surse, amoniacul și-a primit numele de la cuvântul egiptean antic amonian. Așa numiți oameni care se închină pe zeul Amon. În timpul ritualurilor lor rituale, ei adulmecau amoniac NH 4 Cl, care, atunci când este încălzit, evaporă amoniacul.
1. Structura moleculei
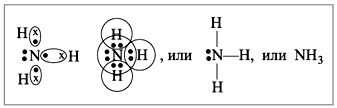
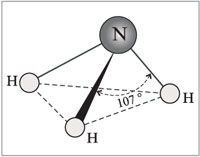
Molecula de amoniac are forma unei piramide trigonale cu un atom de azot în vârf. Trei electroni p neperechi ai atomului de azot participă la formarea legăturilor covalente polare cu electroni 1s a trei atomi de hidrogen (legături N-H), a patra pereche de electroni externi este neîmpărtășită, poate forma o legătură donor-acceptor cu un hidrogen ion, formând un ion de amoniu NH 4 + .
Vedere legătură chimică: polar covalent, trei simpleσ - Legătura N-H sigma
2. Proprietățile fizice ale amoniacului
La conditii normale- un gaz incolor cu un miros caracteristic ascuțit (miros de amoniac), aproape de două ori mai ușor decât aerul, otrăvitor.În funcție de efectul fiziologic asupra organismului, aparține grupului de substanțe cu efect asfixiant și neurotrop, capabile să provoace edem pulmonar toxic și vătămare gravă în caz de afectare prin inhalare. sistem nervos. Vaporii de amoniac irită puternic membranele mucoase ale ochilor și ale organelor respiratorii, precum și piele. Acesta este ceea ce percepem ca un miros înțepător. Vaporii de amoniac provoacă lacrimare abundentă, dureri la nivelul ochilor, arsuri chimice ale conjunctivei și corneei, pierderea vederii, accese de tuse, roșeață și mâncărime ale pielii. Solubilitatea NH 3 în apă este extrem de mare - aproximativ 1200 de volume (la 0 °C) sau 700 de volume (la 20 °C) într-un volum de apă.
3.
|
In laborator |
În industrie |
|
Pentru a obține amoniac în laborator, se utilizează acțiunea alcalinelor puternice asupra sărurilor de amoniu: NH4CI + NaOH = NH3 + NaCI + H2O (NH 4 ) 2 SO 4 + Ca(OH) 2 = 2NH 3 + CaSO 4 + 2H 2 O Atentie!Hidroxidul de amoniu este o bază instabilă, se descompune: NH4OH ↔ NH3 + H2O Când primiți amoniac, țineți eprubeta - receptorul cu susul în jos, deoarece amoniacul este mai ușor decât aerul: |
Metoda industrială de producere a amoniacului se bazează pe interacțiunea directă a hidrogenului și azotului: N2 (g) + 3H2 (g) ↔ 2NH3 (g) + 45,9k J Termeni: catalizator - fier poros temperatura - 450 - 500 ˚С presiune - 25 - 30 MPa Acesta este așa-numitul proces Haber (fizicianul german, a dezvoltat bazele fizico-chimice ale metodei). |
4. Proprietăți chimice amoniac
Pentru amoniac, reacțiile sunt caracteristice:
- cu o modificare a stării de oxidare a atomului de azot (reacții de oxidare)
- fără modificarea stării de oxidare a atomului de azot (adăugare)
|
Reacții cu modificarea stării de oxidare a atomului de azot (reacții de oxidare) N-3 → N 0 → N +2 NH3-agent reducător puternic. |
|
cu oxigen 1. Arderea amoniacului (atunci cand este incalzit) 4 NH 3 + 3 O 2 → 2 N 2 + 6 H 2 0 2. Oxidarea catalitică a amoniacului (catalizatorPt – Rh, temperatura) 4NH3 + 5O2 → 4NO + 6H2O Video - Experiment „Oxidarea amoniacului în prezența oxidului de crom” |
|
cu oxizi metalici 2 NH 3 + 3CuO \u003d 3Cu + N 2 + 3 H 2 O |
|
cu oxidanți puternici 2 NH 3 + 3 Cl 2 \u003d N 2 + 6 HCl (atunci cand este incalzit) |
|
amoniacul este un compus fragil, se descompune atunci când este încălzit 2NH 3 ↔ N 2 + 3H 2 |
|
Reacții fără modificarea stării de oxidare a atomului de azot (adăugare - Formarea ionului de amoniu NH4+conform mecanismului donor-acceptor) Video - Experiment „Reacția calitativă la amoniac” Video - Experimentul „Fum fără foc” Video - Experiment „Interacțiunea amoniacului cu acizi concentrați” Video - Experimentul „Fântână” Video - Experiment „Dizolvarea amoniacului în apă” |
5. Aplicarea amoniacului
În ceea ce privește volumele de producție, amoniacul ocupă unul dintre primele locuri; anual în întreaga lume primesc aproximativ 100 de milioane de tone din acest compus. Amoniacul este produs sub formă lichidă sau sub formă de soluție apoasă - apa cu amoniac, care conţine de obicei 25% NH3. În continuare sunt folosite cantități uriașe de amoniac pentru a produce acid azotic care merge la producția de îngrășăminte si multe alte produse. Apa amoniacală este, de asemenea, folosită direct ca îngrășământ, iar uneori câmpurile sunt udate din rezervoare direct cu amoniac lichid. Din amoniac primesc diverse săruri de amoniu, uree, urotropină. A lui folosit și ca agent frigorific ieftinîn sistemele frigorifice industriale.
Se folosește și amoniac pentru producerea fibrelor sintetice, de exemplu, nailon și capron. LA industria ușoară el folosit la curățarea și vopsirea bumbacului, lânii și mătasei. În ulei industria chimica amoniacul este folosit pentru neutralizarea deșeurilor acide, iar în producția de cauciuc natural, amoniacul ajută la conservarea latexului în timpul transportului acestuia de la plantație la fabrică. Amoniacul este, de asemenea, utilizat în producția de sifon folosind metoda Solvay. În industria siderurgică, amoniacul este folosit pentru nitrurare - saturarea straturilor de suprafață ale oțelului cu azot, ceea ce crește semnificativ duritatea acestuia.
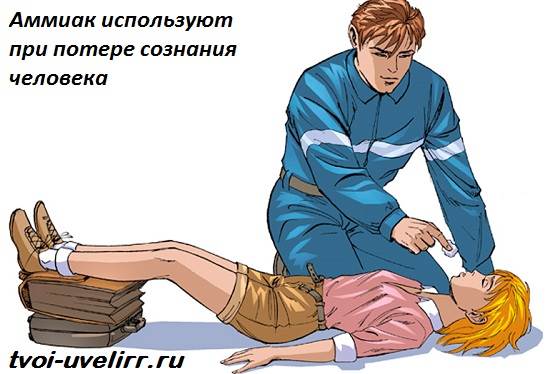
Medicii folosesc soluții apoase de amoniac (amoniac) în practica de zi cu zi: un tampon de bumbac înmuiat în amoniac, scoate o persoană dintr-un leșin. Pentru oameni, amoniacul într-o astfel de doză nu este periculos.
SIMULAtoare
Simulatorul №1 „Arderea amoniacului”
Simulatorul №2 „Proprietățile chimice ale amoniacului”
SARCINI DE INFORTARE
№1. Efectuați transformări conform schemei:
a) Azot → Amoniac → Oxid azotic (II)
b) Nitrat de amoniu → Amoniac → Azot
c) Amoniac → Clorura de amoniu → Amoniac → Sulfat de amoniu
Pentru OVR, întocmește o balanță electronică, pentru RIO, ecuații complete, ionice.nr 2. Scrieți patru ecuații reacții chimice rezultând formarea amoniacului.
Petalele devin verzi și - devin negre.
Florarii, după cum se spune, iau notă. In orice caz, amoniac utile în alte domenii de activitate. Învățăm restul proprietăților substanței, ne familiarizăm cu modalitățile de aplicare a acesteia.
Proprietățile amoniacului
Când lucrați cu vapori de amoniac, ar trebui să fiți atenți. La o anumită concentrație, amestecul reactivului cu aerul este exploziv.
În plus, gazul este toxic. „Comunicarea” cu el este plină de tulburări nervoase, pierderea auzului, pierderea parțială a memoriei, tulburarea lentilelor. Aceste simptome sunt observate la persoanele care lucrează în producția de amoniac.
Vaporii de amoniac se grăbesc mereu, deoarece gazul este mai ușor decât aerul. O substanță este un gaz în condiții normale. Amoniacul este lichefiat pentru transport și vânzare.
Pentru asta ai nevoie tensiune arterială crescută. Luați concentrat anhidru. Pentru el, există 6221-90 GOST.
Amoniac lichefiatîn vase, cu toate acestea, are o fază gazoasă. Sub presiune, ambele stări ale materiei sunt în echilibru.
În acest caz, temperatura trebuie să fie sub cea critică, la fel ca și presiunea. Dacă sunt mai mult de 132 de grade și 11 megapascali, echilibrul va fi perturbat.
Coeficientul de compresie volumetrică al unei substanțe este de câteva ori mai mic decât coeficientul său de dilatare.
Dacă vasul este umplut până la vârf, o creștere a temperaturii poate duce la o presiune de 52 megapascali.
Acest lucru este suficient pentru a rupe cusăturile metalice ale vasului care conține. În consecință, va avea loc o explozie.
Din concentrat de amoniac puteți obține soluție de amoniac orice intensitate. Deși, versiunea fără apă este utilă și pentru umanitate.
De exemplu, este unul dintre îngrășăminte. În plus, în substanță este prezent doar hidrogenul. Ultimii 3 atomi, adică formula gazului este următoarea: - NH3.
Acest conținut de hidrogen este motivul solubilității excelente a amoniacului în apă. Alte gaze nu se pot lăuda cu asta.
Între amoniac și apă se formează legături puternice de hidrogen. Cu cât soluția este mai saturată, cu atât proprietățile sale de dizolvare sunt mai mari.
Pentru ei, substanța concurează cu Alcool etilic, singura diferență fiind că acesta din urmă este de origine organică.
Asa de, amoniac apos, precum și un concentrat, sunt capabile să dizolve metale din grupări alcaline și alcalino-pământoase.
Reacția are ca rezultat lichide de culoare albastru închis. Acesta este rezultatul ionizării și solvației electronilor de valență.
Acest din urmă concept denotă un contact electrostatic între moleculele de metale dizolvate și amoniac.
Din amoniac miros de amoniac vine de nicăieri. Agentul este o soluție apoasă de hidroxid de amoniu.
Acesta este, amoniacul este amoniac alcool. Hidroxidul de amoniu se găsește și în urină, precum și în produșii organici de descompunere.
De aceea, de exemplu, masele putrezite de pe fundul mlaștinilor miros neplăcut. Ele descompun rămășițele de plante, pești,.
În aceleași iazuri, amoniacul se amestecă în mod natural cu apa. O grupare OH este prezentă în soluție.
Aceasta înseamnă că amestecul este capabil de o reacție alcalină, este o bază slabă. Dizolvă eroul și alcool. Amoniac nu a fost amestecat accidental cu el în amoniac.
În formă concentrată, nitrura de hidrogen refractă puternic lumina, adică își schimbă direcția razelor.
O altă proprietate curioasă a eroului articolului se fierbe temperaturi sub zero. Ar trebui să fie în jur de 34 sub zero.
Dacă coborâți temperatura la 78 de grade, lichidul se va întări complet. Se dovedește fulgi albicios, asemănători zăpezii. substanțele au o formă regulată, simetrică.
Exploatarea amoniacului
Producția de amoniac redus la 100.000.000 de tone anual. Se extrage aproximativ aceeași cantitate de clor. În același timp, amoniacul este mai puțin toxic.
În cele specificate volumul de amoniac include o substanță extrasă din surse naturale de azot și sintetizată în condiții.
Metoda industrială se bazează pe combinarea hidrogenului și azot. Amoniac dintre ele se obține la o temperatură nu mai mică de 500 de grade Celsius.
O alta conditie: - presiune de 350 atmosfere. Nu te poți descurca fără catalizator. Accelerează o reacție lentă, fără a intra în ea însăși.
Rolul catalizatorului este îndeplinit de obicei de spongioasa. Dintre asistenții mai scumpi, se alege oxidul sau.
Randamentul final al produsului în timpul interacțiunii substanțelor simple este de aproximativ 30-35%.
Acesta este valoarea maximă, supusă celei mai scăzute temperaturi posibile și cea mai mare presiune. Acest duet este cel care asigură eficacitatea reacției.
Cu toate acestea, la bara de temperatură inferioară, viteza procesului scade. Dacă porniți căldura, veți rămâne parțial fără amoniac dar o vei primi mai repede.
Metoda sintetică de producere a amoniacului nu lasă practic nicio șansă pentru extragerea acestuia în natură din produsele de degradare a materiei organice. Acest proces este lung.
Amoniac format, dar se volatilizează rapid. În capcane Scoarta terestra gazul este rar.
De obicei, amoniacul se evaporă puțin câte puțin, ceea ce face depozitele naturale nelichide.
Aplicarea amoniacului
Aplicație substanțele din sectorul agricol au fost deja menționate. Acum, să trecem la industria frumuseții, amintindu-ne despre amoniac pentru par.
Aici ne amintim că soluția unei substanțe este un alcalin slab. De aici si numirea: - sa furnizeze vopsele alcaline Ph, in zona de 10.
Un astfel de mediu contribuie la umflarea părului, ceea ce declanșează reacția de descompunere a peroxidului de hidrogen.
Acesta din urmă este un clarificator, prin urmare, este folosit neapărat în nuanțe de blond.
Există vopsea fara amoniac. Cu toate acestea, producătorii sunt parțial vicleni. În loc de substanta pura sunt aplicate derivatele sale.
De asemenea, ridică Ph la un nivel alcalin, dar sunt mai scumpe. În consecință, și vopsea de par fara amoniac necesită costuri.

Cu toate acestea, consumatorii sunt pregătiți pentru ele pentru a-și salva părul. Faptul este că amoniacul pur deschide porii părului mai puternic.
Încep să semene cu un burete, a cărui suprafață poate fi netezită doar cu produse cosmetice scumpe din silicon care umplu golurile.
Din alimente exprimate alcalii -. Pentru fabricarea sa, de asemenea regizat sinteza amoniacului.
De asemenea, este produs pentru a obține azot acizi. Amoniac transformat în oxid nitric.
Acesta din urmă este oxidat la dioxid. Apoi, oxizii sunt absorbiți de apă. Așa o primesc.
Formula de amoniac, după cum sa menționat deja, stă la baza creării de substanțe explozive.
Substanța este necesară și în producția de echipamente frigorifice. Acțiunea sa se bazează pe evaporare gaz lichefiat. În același timp, se absoarbe multă căldură, care, de fapt, oferă răcoare.
În bijuterii a fost implicat și amoniacul. Se folosește pentru curățarea produselor după lustruire cu pastă.
Nevoia omenirii de amoniac reflectă tendința în producția sa. Chiar și în urmă cu 30 de ani, se formau 70.000.000 de tone de reactiv pe an.
Acum, așa cum se menționează în capitolul „Producție”, este de 100.000.000. Numai liderii producției nu s-au schimbat. Aceasta este încă SUA și, acum,.
În cărțile de referință din anii trecuți, desigur, apare URSS. Că costul substanței s-a schimbat și nu este nevoie să ghicim. Să facem cunoștință cu prețul actual pentru amoniac.
Pretul amoniacului
cumpara amoniac poate fi en-gros și cu amănuntul. Livrările mari se efectuează, de regulă, în tone.
Pentru 1000 de kilograme ei cer de la 19.000 de ruble. Întreprinderile mici sunt gata să vândă la kilogram, cerând aproximativ 30 de ruble.
La comerțul cu amănuntul, kilogramele sunt rar oferite, tone nu se oferă deloc. Să studiem lista de prețuri a farmaciilor, acordând atenție amoniacului.
De obicei, se toarnă în sticle de 40 de mililitri. Un astfel de volum costă de la 15 la 31 de ruble.
Interesant, dacă există sticle de 25 și 100 de mililitri, costă aproximativ la fel, de la 13 la 55 de ruble.
În același timp, merită luat în considerare faptul că soluția de alcool este de 10 la sută. Amoniacul lichefiat la livrările angro este concentrat.
Prin urmare, industriașii trebuie să se gândească la transportul corect al mărfurilor. Există semiremorci speciale cu cisterne.
Vechimea containerelor nu trebuie să depășească 30 de ani. Compoziția pentru rezervoare este de asemenea importantă, deoarece amoniacul dizolvă multe metale.
De asemenea, este necesar să se țină cont de presiunea din rezervor, de temperatură. Prin urmare, pe lângă reclamele de vânzare a reactivului, de regulă, există și oferte de vânzare și închiriere de semiremorci. Nu te poți descurca fără ele.
Lichid
Amoniac- NH 3, nitrură de hidrogen, în condiții normale - un gaz incolor cu un miros caracteristic ascuțit (miros de amoniac), aproape de două ori mai ușor decât aerul, otrăvitor. Solubilitatea NH 3 în apă este extrem de mare - aproximativ 1200 de volume (la 0 ° C) sau 700 de volume (la 20 ° C) într-un volum de apă. LA refrigerare se numește R717, unde R este agent frigorific (refrigerant), 7 este tipul de agent frigorific (compus anorganic), 17 este greutatea moleculară.
Molecula de amoniac are forma unei piramide trigonale cu un atom de azot în vârf. Trei electroni p neperechi ai atomului de azot participă la formarea legăturilor covalente polare cu electroni 1s a trei atomi de hidrogen (legături N-H), a patra pereche de electroni externi este neîmpărtășită, poate forma o legătură donor-acceptor cu un hidrogen ion, formând un ion de amoniu NH 4 + . Datorită faptului că norul de doi electroni nelegativ este strict orientat în spațiu, molecula de amoniac are o polaritate ridicată, ceea ce duce la o bună solubilitate în apă.
În amoniacul lichid, moleculele sunt legate prin legături de hidrogen. O comparație a proprietăților fizice ale amoniacului lichid cu apa arată că amoniacul are puncte de fierbere mai mici (t bale -33,35 ° C) și puncte de topire (t pl -77,70 ° C), precum și mai multe densitate scazuta, vâscozitatea (vâscozitatea amoniacului lichid este de 7 ori mai mică decât vâscozitatea apei), conductivitate și constantă dielectrică. Acest lucru se explică într-o oarecare măsură prin faptul că puterea acestor legături în amoniacul lichid este semnificativ mai mică decât cea a apei și, de asemenea, prin faptul că există o singură pereche de electroni neîmpărțiți în molecula de amoniac, spre deosebire de două perechi. în molecula de apă, ceea ce nu face posibilă formarea unei rețele extinse de legături de hidrogen între mai multe molecule. Amoniacul trece cu ușurință într-un lichid incolor cu o densitate de 681,4 kg / m³, care refractă puternic lumina. La fel ca apa, amoniacul lichid este foarte asociat, în principal prin formarea de legături de hidrogen. Amoniacul lichid practic nu conduce electricitate. Amoniacul lichid este un solvent bun pentru foarte un numar mare organice, precum și pentru mulți compuși anorganici. Amoniacul solid este cristale cubice incolore.
Proprietăți chimice
- Datorită prezenței unei perechi de electroni singuri, amoniacul acționează ca un nucleofil sau agent de complexare în multe reacții. Deci, atașează un proton, formând un ion de amoniu:
- O soluție apoasă de amoniac ("amoniac") are o reacție ușor alcalină datorită procesului:
- Interacțiunea cu acizii dă sărurile de amoniu corespunzătoare:
- Amoniacul este, de asemenea, foarte acid slab(de 10.000.000.000 de ori mai slab decât apa), capabil să formeze săruri cu metalele – amide. Compușii care conțin ioni NH 2 − se numesc amide, NH 2− - imide și N 3− - nitruri. Amidele metalelor alcaline se obțin prin acțiunea asupra lor cu amoniac:
Amidele, imidele și nitrururile unui număr de metale se formează ca urmare a anumitor reacții în amoniacul lichid. Nitrururile pot fi obținute prin încălzirea metalelor într-o atmosferă de azot.
Amidele metalice sunt analogi ai hidroxizilor. Această analogie este întărită de faptul că ionii OH - și NH 2 -, precum și moleculele de H 2 O și NH 3, sunt izoelectronice. Amidele sunt baze mai puternice decât hidroxizii și, prin urmare, suferă hidroliză ireversibilă în soluții apoase:
NaNH 2 + H 2 O → NaOH + NH 3 CaNH + 2H 2 O → Ca(OH) 2 + NH 3 Zn 3 N 2 + 6H 2 O → 3Zn(OH) 2 + 2NH 3
si in alcooli:
KNH2 + C2H5OH → C2H5OK + NH3
La fel ca soluțiile apoase de alcali, soluțiile de amoniac ale amidelor conduc bine curentul electric, care se datorează disocierii:
MNH2 → M + + NH2 -
Fenolftaleina din aceste soluții devine roșie; atunci când se adaugă acizi, ei sunt neutralizați. Solubilitatea amidelor se modifică în aceeași secvență ca și solubilitatea hidroxizilor: LiNH 2 este insolubil, NaNH 2 este ușor solubil, KNH 2 , RbNH 2 și CsNH 2 sunt foarte solubili.
- Când este încălzit, amoniacul prezintă proprietăți reducătoare. Deci, arde într-o atmosferă de oxigen, formând apă și azot. Oxidarea amoniacului cu aer pe un catalizator de platină dă oxizi de azot, care sunt utilizați în industrie pentru a produce acid azotic:
Utilizarea amoniacului NH 4 Cl pentru curățarea suprafeței metalice de oxizi în timpul lipirii acestora se bazează pe capacitatea de reducere a NH 3:
3CuO + 2NH 4 Cl → 3Cu + 3H 2 O + 2HCl + N 2
Oxizând amoniacul cu hipoclorit de sodiu în prezența gelatinei, se obține hidrazină:
2NH3 + NaClO → N2H4 + NaCI + H2O
- Halogenii (clorul, iodul) formează explozivi periculoși cu amoniac - halogenuri de azot (clorură de azot, iodură de azot).
- Cu haloalcanii, amoniacul intră într-o reacție de adiție nucleofilă, formând un ion de amoniu substituit (o metodă de obținere a aminelor):
- Cu acizii carboxilici, anhidridele, halogenurile, esterii și alți derivați ai acestora dă amide. Cu aldehide și cetone - baze Schiff, care pot fi reduse la aminele corespunzătoare (aminare reductivă).
- La 1000 °C, amoniacul reacționează cu cărbunele, formând HCN și descompunându-se parțial în azot și hidrogen. De asemenea, poate reacționa cu metanul, formând același acid cianhidric:
Istoricul numelui
Amoniacul (în limbile europene numele său sună ca „amoniac”) își datorează numele oazei Ammon din Africa de Nord, situată la intersecția rutelor caravanelor. În climatele calde, ureea (NH 2 ) 2 CO conținută în deșeurile animale se descompune deosebit de rapid. Unul dintre produsele de degradare este amoniacul. Potrivit altor surse, amoniacul și-a primit numele de la cuvântul egiptean antic amonian. Așa numiți oameni care se închină pe zeul Amon. În timpul ceremoniilor lor rituale, au adulmecat amoniac NH 4 Cl, care evaporă amoniacul atunci când este încălzit.
Amoniac lichid
Amoniacul lichid, deși într-o mică măsură, se disociază în ioni, în care se manifestă asemănarea sa cu apa:
2NH 3 → NH 4 + + NH 2 -
Constanta de autoionizare a amoniacului lichid la -50 °C este de aproximativ 10 -33 (mol/l)².
Amoniacul lichid, ca și apa, este un solvent ionizant puternic în care se dizolvă un număr de metale active: alcaline, alcalino-pământoase, Mg, Al, precum și Eu și Yb. Solubilitatea metalelor alcaline în NH3 lichid este de câteva zeci de procente. Amoniacul lichid NH3 dizolvă, de asemenea, unii compuși intermetalici care conțin metale alcaline, cum ar fi Na4Pb9.
Soluțiile diluate de metale în amoniac lichid sunt colorate Culoarea albastră, soluțiile concentrate au un luciu metalic și sunt asemănătoare bronzului. Când amoniacul se evaporă, metalele alcaline sunt eliberate în formă pură, și alcalino-pământoase - sub formă de complecși cu amoniac [E (NH 3) 6] cu conductivitate metalică. La o încălzire ușoară, acești complexe se descompun în metal și NH3.
Metalul dizolvat în NH3 reacționează treptat pentru a forma o amidă:
2Na + 2NH 3 → 2NaNH 2 + H 2 -
Amidele metalice rezultate în urma reacţiei cu amoniacul conţin ion negativ NH 2 - , care se formează și în timpul autoionizării amoniacului. Astfel, amidele metalice sunt analogi ai hidroxizilor. Viteza de reacție crește atunci când se trece de la Li la Cs. Reacția este foarte accelerată în prezența chiar și a impurităților mici de H2O.
Soluțiile de metal-amoniac au conductivitate electrică metalică; în ele, atomii de metal se descompun în ioni pozitivi și electroni solvați înconjurați de molecule de NH3. Soluțiile de metal-amoniac care conțin electroni liberi sunt cei mai puternici agenți reducători.
complexare
Datorită proprietăților lor de donare de electroni, moleculele de NH 3 pot intra în compuși complecși ca ligand. Astfel, introducerea excesului de amoniac în soluții de săruri ale metalelor d duce la formarea complecșilor lor amino:
CuSO 4 + 4NH 3 → SO 4 Ni(NO 3) 2 + 6NH 3 → (NO 3) 2
Complexarea este de obicei însoțită de o schimbare a culorii soluției, astfel încât în prima reacție culoarea albastră (CuSO4) se transformă în albastru închis (culoarea complexului), iar în a doua reacție culoarea se schimbă din verde (Ni ( NU 3) 2) la albastru-violet. Cele mai puternice complexe cu NH 3 formează crom și cobalt în starea de oxidare +3.
Rolul biologic
Amoniacul este produsul final al metabolismului azotului la oameni și animale. Se formează în timpul metabolismului proteinelor, aminoacizilor și altor compuși azotați. Este foarte toxic pentru organism, astfel încât cea mai mare parte a amoniacului din timpul ciclului ornitinei este transformată de ficat într-un compus mai inofensiv și mai puțin toxic - ureea (ureea). Ureea este apoi excretată prin rinichi, iar o parte din uree poate fi transformată de către ficat sau rinichi înapoi în amoniac.
Amoniacul poate fi folosit și de către ficat pentru procesul invers, resinteza aminoacizilor din amoniac și analogii ceto de aminoacizi. Acest proces se numește „aminare reductivă”. Deci din măcriș acid acetic se dovedește aspartic, din α-cetoglutaric - glutamină etc.
Acțiune fiziologică
În funcție de efectul fiziologic asupra organismului, acesta aparține grupului de substanțe cu efect asfixiant și neurotrop, care, atunci când sunt inhalate, pot provoca edem pulmonar toxic și leziuni severe ale sistemului nervos. Amoniacul are atât efecte locale, cât și efecte de resorbție.
Vaporii de amoniac irită puternic membranele mucoase ale ochilor și ale organelor respiratorii, precum și pielea. Acesta este ceea ce percepem ca un miros înțepător. Vaporii de amoniac provoacă lacrimare abundentă, dureri la nivelul ochilor, arsuri chimice ale conjunctivei și corneei, pierderea vederii, accese de tuse, roșeață și mâncărime ale pielii. Când amoniacul lichefiat și soluțiile sale intră în contact cu pielea, apare o senzație de arsură, este posibilă o arsură chimică cu vezicule și ulcerații. În plus, amoniacul lichefiat absoarbe căldura în timpul evaporării, iar degerăturile de grade diferite apar atunci când intră în contact cu pielea. Mirosul de amoniac se simte la o concentrație de 37 mg/m³.
În cele din urmă concentrație admisă in aer zonă de muncă spațiile de producție este de 20 mg/m³. Prin urmare, dacă se simte mirosul de amoniac, atunci este deja periculos să lucrezi fără echipament de protecție. Iritația faringelui se manifestă atunci când conținutul de amoniac din aer este de 280 mg / m³, ochi - 490 mg / m³. Când este expus la concentrații foarte mari, amoniacul provoacă leziuni cutanate: 7-14 g/m³ - eritematos, 21 g/m³ sau mai mult - dermatită buloasă. Edemul pulmonar toxic se dezvoltă la expunerea la amoniac timp de o oră cu o concentrație de 1,5 g/m³. Expunerea pe termen scurt la amoniac la o concentrație de 3,5 g/m³ sau mai rapid duce la dezvoltarea unor efecte toxice generale. Concentrația maximă admisă de amoniac în aerul atmosferic aşezări este egal cu: mediu zilnic 0,04 mg/m³; doză unică maximă 0,2 mg/m³.
În lume, concentrația maximă de amoniac în atmosferă (mai mult de 1 mg/m³) se observă în Câmpia Indo-gangetică, în Valea Centrală a SUA și în regiunea Kazahstanului de Sud.
Aplicație
Amoniacul este unul dintre cele mai importante produse ale industriei chimice, producția sa mondială anuală atinge 150 de milioane de tone. Este utilizat în principal pentru producerea de îngrășăminte cu azot (nitrat și sulfat de amoniu, uree), explozivi și polimeri, acid azotic, sodă (metoda amoniacului) și alte produse chimice. Amoniacul lichid este folosit ca solvent.
În refrigerare, este folosit ca agent frigorific (R717)
În medicină, o soluție de 10% de amoniac, numită adesea amoniac, este utilizată pentru leșin (pentru a stimula respirația), pentru a stimula vărsăturile, precum și extern - nevralgie, miozită, mușcături de insecte, tratamentul mâinilor chirurgului. La aplicare greșită poate provoca arsuri ale esofagului și stomacului (în cazul luării unei soluții nediluate), stop respirator reflex (la inhalare în concentrații mari).
Aplicați local, prin inhalare și în interior. Pentru a stimula respirația și pentru a elimina pacientul de leșin, aduceți cu atenție o bucată mică de tifon sau vată umezită cu amoniac la nasul pacientului (timp de 0,5-1 s). În interior (numai în reproducere) pentru a induce vărsăturile. Cu mușcături de insecte - sub formă de loțiuni; cu nevralgie și miozită – frecare cu liniment de amoniac. În practica chirurgicală, ei sunt crescuți în apă caldă fiartă și se spală pe mâini.
Deoarece este o bază slabă, neutralizează acizii atunci când interacționează.
Efectul fiziologic al amoniacului se datorează mirosului înțepător al amoniacului, care irită receptorii specifici ai mucoasei nazale și excită centrii respiratori și vasomotori ai creierului, determinând creșterea respirației și creșterea tensiunii arteriale.
chitanta
Metoda industrială de producere a amoniacului se bazează pe interacțiunea directă a hidrogenului și azotului:
N2 (g) + 3H2 (g) ↔ 2NH3 (g) + 45,9 kJ
Acesta este așa-numitul proces Haber (fizicianul german, a dezvoltat bazele fizico-chimice ale metodei).
Reacția are loc cu degajarea de căldură și scăderea volumului. Prin urmare, pe baza principiului Le Chatelier, reacția ar trebui efectuată la temperaturi scăzute iar la presiuni mari - atunci echilibrul va fi deplasat spre dreapta. Cu toate acestea, viteza de reacție la temperaturi scăzute este neglijabilă, iar la temperaturi ridicate, viteza reacției inverse crește. Efectuarea reacției la presiuni foarte mari necesită crearea unei rezistențe speciale presiune ridicata echipamente și, prin urmare, o investiție mare. În plus, echilibrul reacției, chiar și la 700 °C, este stabilit prea lent pentru utilizarea sa practică.
Utilizarea unui catalizator (fier poros cu impurități de Al 2 O 3 și K 2 O) a făcut posibilă accelerarea atingerii unei stări de echilibru. Interesant este că în căutarea unui catalizator pentru acest rol, au fost încercate peste 20 de mii de substanțe diferite.
Luând în considerare toți factorii de mai sus, procesul de obținere a amoniacului se realizează la urmatoarele conditii: temperatura 500 °C, presiune 350 atmosfere, catalizator. Randamentul de amoniac în astfel de condiții este de aproximativ 30%. LA mediu industrial se folosește principiul circulației - amoniacul este îndepărtat prin răcire, iar azotul și hidrogenul nereacționat sunt returnate în coloana de sinteză. Acest lucru se dovedește a fi mai economic decât obținerea unui randament de reacție mai mare prin creșterea presiunii.
Pentru a obține amoniac în laborator, se utilizează acțiunea alcalinelor puternice asupra sărurilor de amoniu:
NH4CI + NaOH = NH3 + NaCI + H2O.
Obținut de obicei în laborator, se obține prin încălzirea slabă a unui amestec de clorură de amoniu cu var stins. 2NH 4 Cl + Ca(OH) 2 = CaCl 2 + 2NH 3 + 2H 2 O
Pentru a usca amoniacul, acesta este trecut printr-un amestec de var și sodă caustică.
Amoniacul foarte uscat poate fi obținut prin dizolvarea sodiului metalic în el și ulterior distilarea acestuia. Acest lucru se face cel mai bine într-un sistem realizat din metal sub vid. Sistemul trebuie să poată rezista la presiune ridicată temperatura camerei presiune vapori saturati amoniac aproximativ 10 atmosfere). În industrie, amoniacul este uscat în coloane de absorbție.
Amoniacul în medicină
Pentru mușcăturile de insecte, amoniacul se aplică extern sub formă de loțiuni. Posibil efecte secundare: La expunere prelungită (utilizare prin inhalare), amoniacul poate provoca stop respirator reflex. Aplicarea locală este contraindicată în dermatită, eczeme și altele boli de piele, precum și cu leziuni traumatice deschise ale pielii. Cu aplicare prin inhalare - stop respirator reflex, cu aplicare topică - iritație, dermatită, eczemă la locul aplicării. Aplicarea locală este posibilă numai pe pielea intactă. În caz de lezare accidentală a membranei mucoase a ochiului, clătiți cu apă (timp de 15 minute la fiecare 10 minute) sau cu o soluție de 5%. acid boric. Nu se folosesc uleiuri și unguente. Odată cu înfrângerea nasului și a faringelui - soluție 0,5%. acid citric sau sucuri naturale. În caz de ingerare, se bea apă, suc de fructe, lapte, de preferință soluție de acid citric 0,5% sau soluție de acid acetic 1% până la neutralizarea completă a conținutului stomacului. Interacțiunea cu ceilalți medicamente necunoscut. (Instructiuni de folosire)
In apa
- Halogenii (clorul, iodul) formează explozivi periculoși cu amoniac - halogenuri de azot (clorură de azot, iodură de azot).
- Cu haloalcanii, amoniacul intră într-o reacție de adiție nucleofilă, formând un ion de amoniu substituit (o metodă de obținere a aminelor):
- Cu acizii carboxilici, anhidridele lor, halogenurile acide, esterii și alți derivați dau amide. Cu aldehide și cetone - baze Schiff, care pot fi reduse la aminele corespunzătoare (aminare reductivă).
- La 1000 °C, amoniacul reacționează cu cărbunele, formând acidul cianhidric HCN și descompunându-se parțial în azot și hidrogen. De asemenea, poate reacționa cu metanul, formând același acid cianhidric:
Istoricul numelui
Amoniacul (în limbile europene, numele său sună ca „amoniac”) își datorează numele oazei Ammon din Africa de Nord, situată la intersecția rutelor caravanelor. În climatele calde, ureea (NH 2 ) 2 CO conținută în deșeurile animale se descompune deosebit de rapid. Unul dintre produsele de degradare este amoniacul. Potrivit altor surse, amoniacul și-a primit numele de la cuvântul egiptean antic amonian. Așa numiți oameni care se închină pe zeul Amon. În timpul ceremoniilor lor rituale, au adulmecat amoniac NH 4 Cl, care evaporă amoniacul atunci când este încălzit.
Amoniac lichid
Amoniacul lichid, deși într-o mică măsură, se disociază în ioni (autoprotoliza), în care se manifestă asemănarea sa cu apa:
Constanta de autoionizare a amoniacului lichid la -50 °C este de aproximativ 10 -33 (mol/l)².
Amidele metalice rezultate din reacția cu amoniacul conțin ionul NH 2 − negativ, care se formează și în timpul autoionizării amoniacului. Astfel, amidele metalice sunt analogi ai hidroxizilor. Viteza de reacție crește atunci când se trece de la Li la Cs. Reacția este foarte accelerată în prezența chiar și a impurităților mici de H2O.
Soluțiile de metal-amoniac au conductivitate electrică metalică; în ele, atomii de metal se descompun în ioni pozitivi și electroni solvați înconjurați de molecule de NH3. Soluțiile de metal-amoniac care conțin electroni liberi sunt cei mai puternici agenți reducători.
complexare
Datorită proprietăților lor de donare de electroni, moleculele de NH 3 pot intra în compuși complecși ca ligand. Astfel, introducerea excesului de amoniac în soluții de săruri ale metalelor d duce la formarea complecșilor lor amino:
Complexarea este de obicei însoțită de o schimbare a culorii soluției. Deci, în prima reacție, culoarea albastră (CuSO 4) se transformă în albastru închis (culoarea complexului), iar în a doua reacție, culoarea se schimbă de la verde (Ni (NO 3) 2) la albastru-violet. Cele mai puternice complexe cu NH 3 formează crom și cobalt în starea de oxidare +3.
Rolul biologic
Amoniacul este produsul final al metabolismului azotului la oameni și animale. Se formează în timpul metabolismului proteinelor, aminoacizilor și altor compuși azotați. Este foarte toxic pentru organism, astfel încât cea mai mare parte a amoniacului din timpul ciclului ornitinei este transformată de ficat într-un compus mai inofensiv și mai puțin toxic - ureea (ureea). Ureea este apoi excretată prin rinichi, iar o parte din uree poate fi transformată de către ficat sau rinichi înapoi în amoniac.
Amoniacul poate fi folosit și de către ficat pentru procesul invers - resinteza aminoacizilor din amoniac și analogii ceto ai aminoacizilor. Acest proces se numește „aminare reductivă”. Astfel, acidul aspartic se obține din acidul oxaloacetic, acidul glutamic se obține din acidul α-cetoglutaric etc.
Acțiune fiziologică
În funcție de efectul fiziologic asupra organismului, acesta aparține grupului de substanțe cu efect asfixiant și neurotrop, care, atunci când sunt inhalate, pot provoca edem pulmonar toxic și leziuni severe ale sistemului nervos. Amoniacul are atât efecte locale, cât și efecte de resorbție.
Vaporii de amoniac irită puternic membranele mucoase ale ochilor și ale organelor respiratorii, precum și pielea. Aceasta este o persoană și percepe ca un miros înțepător. Vaporii de amoniac provoacă lacrimare abundentă, dureri la nivelul ochilor, arsuri chimice ale conjunctivei și corneei, pierderea vederii, accese de tuse, roșeață și mâncărime ale pielii. Când amoniacul lichefiat și soluțiile sale intră în contact cu pielea, apare o senzație de arsură, este posibilă o arsură chimică cu vezicule și ulcerații. În plus, amoniacul lichefiat absoarbe căldura în timpul evaporării, iar degerăturile de grade diferite apar atunci când intră în contact cu pielea. Mirosul de amoniac se simte la o concentrație de 37 mg/m³.
Aplicație
Amoniacul este unul dintre cele mai importante produse ale industriei chimice, producția sa mondială anuală ajunge la 150 de milioane de tone. Este folosit în principal pentru producerea de îngrășăminte cu azot (nitrat și sulfat de amoniu, uree), explozivi și polimeri, acid azotic, sodă (metoda amoniacului) și alte produse chimice. Amoniacul lichid este folosit ca solvent.
Rate de consum pe tona de amoniac
Producția de o tonă de amoniac în Rusia consumă în medie 1200 nm³ gaz natural, în Europa - 900 nm³.
„Grodno Azot” din Belarus consumă 1200 Nm³ de gaz natural pe tonă de amoniac, după modernizare consumul este de așteptat să scadă la 876 Nm³.
Producătorii ucraineni consumă de la 750 Nm³ la 1170 Nm³ de gaz natural pe tonă de amoniac.
Tehnologia UHDE susține un consum de 6,7 - 7,4 Gcal de resurse energetice per tonă de amoniac.
Amoniacul în medicină
Pentru mușcăturile de insecte, amoniacul se aplică extern sub formă de loțiuni. O soluție apoasă de amoniac 10% este cunoscută sub numele de amoniac.
Sunt posibile efecte secundare: la expunere prelungită (utilizare prin inhalare), amoniacul poate provoca stop respirator reflex.
Aplicarea locală este contraindicată în dermatită, eczeme, alte boli ale pielii, precum și leziuni traumatice deschise ale pielii.
În caz de lezare accidentală a membranei mucoase a ochiului, clătiți cu apă (timp de 15 minute la fiecare 10 minute) sau cu o soluție de acid boric 5%. Nu se folosesc uleiuri și unguente. Odată cu înfrângerea nasului și a faringelui - soluție 0,5% de acid citric sau sucuri naturale. În caz de ingerare, se bea apă, suc de fructe, lapte, de preferință soluție de acid citric 0,5% sau soluție de acid acetic 1% până la neutralizarea completă a conținutului stomacului.
Interacțiunea cu alte medicamente este necunoscută.
Producători de amoniac
Producătorii de amoniac din Rusia
| Companie | 2006, mii de tone | 2007, mii de tone |
|---|---|---|
| SA „Togliattiazot”]] | 2 635 | 2 403,3 |
| OAO NAK Azot | 1 526 | 1 514,8 |
| SA „Akron” | 1 526 | 1 114,2 |
| OAO Nevinnomyssky Azot, Nevinnomyssk | 1 065 | 1 087,2 |
| Minudobreniya JSC (Rossosh) | 959 | 986,2 |
| SA „AZOT” | 854 | 957,3 |
| OJSC „Azot” | 869 | 920,1 |
| OJSC „Kirovo-Chepetsky Khim. combina" | 956 | 881,1 |
| OJSC Cherepovets Azot | 936,1 | 790,6 |
| ZAO Kuibyshevazot | 506 | 570,4 |
| Gazprom Salavat neftekhim" | 492 | 512,8 |
| „Îngrășăminte minerale” (Perm) | 437 | 474,6 |
| OJSC Dorogobuzh | 444 | 473,9 |
| Îngrășăminte minerale OAO Voskresensk | 175 | 205,3 |
| OJSC Shchekinoazot | 58 | 61,1 |
| OOO MendeleevskAzot | - | - |
| Total | 13 321,1 | 12 952,9 |
Rusia reprezintă aproximativ 9% din producția mondială de amoniac. Rusia este unul dintre cei mai mari exportatori de amoniac din lume. Aproximativ 25% din producția totală de amoniac este exportată, ceea ce reprezintă aproximativ 16% din exporturile mondiale.
Producători de amoniac din Ucraina
- Norii lui Jupiter sunt formați din amoniac.
Vezi si
Note
Legături
- //
- // Dicționar enciclopedic al lui Brockhaus și Efron: În 86 de volume (82 de volume și 4 suplimentare). - St.Petersburg. , 1890-1907.
- // Dicționar enciclopedic al lui Brockhaus și Efron: În 86 de volume (82 de volume și 4 suplimentare). - St.Petersburg. , 1890-1907.
amoniac. Moleculele acestui gaz au forma unei piramide, la unul dintre vârfurile căreia se află un atom de azot. Sunt formate din legături de hidrogen și se caracterizează prin polaritate puternică. Aceasta explică proprietățile fizice neobișnuite ale amoniacului: punctul său de topire este de aproximativ -80 de grade. Este foarte solubil în apă, alcooli și altele solventi organici.
Aplicarea amoniacului
Amoniacul joacă rol importantîn industrie. Cu ajutorul lui, obține îngrășăminte cu azot aplicat in agricultură, acid azotic și chiar explozivi. Amoniacul, utilizat pe scară largă de către medici, este, de asemenea, produs folosind amoniac. Mirosul înțepător al acestui gaz irită mucoasa nazală și stimulează funcțiile respiratorii. Amoniac folosit pentru leșin sau intoxicații cu alcool. Există, de asemenea, o utilizare externă a amoniacului în medicină. Este un excelent antiseptic, pe care chirurgii le tratează mâinile înainte de operații.
Amoniacul, ca produs de descompunere al amoniacului, este folosit la lipirea metalelor. La temperatura ridicata amoniacul se obține din amoniac, care protejează metalul de formarea unei pelicule de oxid.
Intoxicatia cu amoniac
Amoniacul este o substanță toxică. Adesea, la locul de muncă, apare otrăvirea cu acest gaz, care este însoțită de sufocare, delir și excitare puternică. Cum poți ajuta pe cineva care se află în această situație? Mai întâi trebuie să-i clătiți ochii cu apă și să puneți un bandaj de tifon umezit anterior cu o soluție slabă de acid citric. Apoi este necesar să-l îndepărtați din zona în care se observă o concentrație mare de amoniac. Otrăvirea este posibilă la o concentrație de aproximativ 350 mg/m³.
Dacă amoniacul intră în contact cu pielea, spălați imediat zonele afectate cu apă. În funcție de cantitatea de amoniac de pe piele, poate exista roșeață severă sau arsuri chimice cu vezicule.
Au fost introduse măsuri severe la fabricile unde se produce amoniac Siguranța privind incendiile. Faptul este că amestecul de amoniac și aer este foarte inflamabil. Containerele în care este depozitat pot exploda cu ușurință atunci când sunt încălzite.
Proprietățile chimice ale amoniacului
Amoniacul reacționează cu mulți acizi. Ca rezultat al acestei interacțiuni, se obțin diferite săruri de amoniu. La reacția cu acizii polibazici se obțin două tipuri de săruri (în funcție de numărul de moli de amoniac).
