अमोनिया रसायनों के एक समूह से संबंधित है। उद्योग में अमोनिया का उत्पादन। प्रयोगशाला में अमोनिया प्राप्त करना
अमोनिया -राष्ट्रीय राजमार्ग 3
अमोनिया (यूरोपीय भाषाओं में, इसका नाम "अमोनीक" जैसा लगता है) का नाम अम्मोन के नखलिस्तान के नाम पर पड़ा है। उत्तरी अफ्रीकाकारवां मार्गों के चौराहे पर स्थित है। गर्म जलवायु में, पशु अपशिष्ट में निहित यूरिया (एनएच 2) 2 सीओ विशेष रूप से जल्दी से विघटित हो जाता है। गिरावट उत्पादों में से एक अमोनिया है। अन्य स्रोतों के अनुसार, अमोनिया को इसका नाम प्राचीन मिस्र के शब्द . से मिला है अमोनिया. तथाकथित लोग आमोन भगवान की पूजा करते हैं। अपने अनुष्ठान के दौरान, उन्होंने अमोनिया NH 4 Cl को सूंघा, जो गर्म होने पर अमोनिया को वाष्पित कर देता है।
1. अणु की संरचना
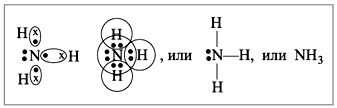
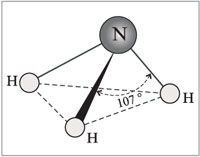
अमोनिया अणु में शीर्ष पर एक नाइट्रोजन परमाणु के साथ एक त्रिकोणीय पिरामिड का आकार होता है। नाइट्रोजन परमाणु के तीन अयुग्मित पी-इलेक्ट्रॉन तीन हाइड्रोजन परमाणुओं (एन-एच बांड) के 1-इलेक्ट्रॉनों के साथ ध्रुवीय सहसंयोजक बंधनों के निर्माण में भाग लेते हैं, बाहरी इलेक्ट्रॉनों की चौथी जोड़ी साझा नहीं की जाती है, यह हाइड्रोजन के साथ एक दाता-स्वीकर्ता बंधन बना सकता है। आयन, एक अमोनियम आयन NH 4 + बनाता है।
देखना रसायनिक बंध: सहसंयोजक ध्रुवीय, तीन एकलσ - एन-एच बांड सिग्मा
2. अमोनिया के भौतिक गुण
पर सामान्य स्थिति- तेज विशिष्ट गंध (अमोनिया की गंध) वाली रंगहीन गैस, हवा से लगभग दोगुनी हल्की, जहरीली।शरीर पर शारीरिक प्रभाव के अनुसार, यह एक एस्फिक्सिएंट और न्यूरोट्रोपिक प्रभाव वाले पदार्थों के समूह से संबंधित है, जो साँस लेने पर विषाक्त फुफ्फुसीय एडिमा और गंभीर क्षति का कारण बन सकता है। तंत्रिका प्रणाली. अमोनिया वाष्प आंखों और श्वसन अंगों के श्लेष्म झिल्ली को बहुत परेशान करती है, साथ ही त्वचा. इसे हम एक तीखी गंध के रूप में देखते हैं। अमोनिया वाष्प के कारण अत्यधिक लैक्रिमेशन, आंखों में दर्द, कंजंक्टिवा और कॉर्निया की रासायनिक जलन, दृष्टि की हानि, खांसी के दौरे, त्वचा की लालिमा और खुजली होती है। पानी में NH 3 की घुलनशीलता बहुत अधिक है - पानी की मात्रा में लगभग 1200 वॉल्यूम (0 डिग्री सेल्सियस पर) या 700 वॉल्यूम (20 डिग्री सेल्सियस पर)।
3.
|
प्रयोगशाला में |
उद्योग में |
|
प्रयोगशाला में अमोनिया प्राप्त करने के लिए, अमोनियम लवण पर प्रबल क्षार की क्रिया का उपयोग किया जाता है: NH 4 Cl + NaOH = NH 3 + NaCl + H 2 O (एनएच 4) 2 एसओ 4 + सीए (ओएच) 2 = 2 एनएच 3 + सीएएसओ 4 + 2 एच 2 ओ ध्यान !अमोनियम हाइड्रॉक्साइड एक अस्थिर आधार है, विघटित होता है:एनएच 4 ओएच ↔ एनएच 3 + एच 2 ओ अमोनिया प्राप्त करते समय, परखनली - रिसीवर को उल्टा रखें, क्योंकि अमोनिया हवा से हल्की होती है: |
अमोनिया के उत्पादन की औद्योगिक विधि हाइड्रोजन और नाइट्रोजन के सीधे संपर्क पर आधारित है: एन 2 (जी) + 3 एच 2 (जी) ↔ 2एनएच 3 (जी) + 45.9kजे स्थितियाँ: उत्प्रेरक - झरझरा लोहा तापमान - 450 - 500 दबाव - 25 - 30 एमपीए यह तथाकथित हैबर प्रक्रिया है (जर्मन भौतिक विज्ञानी, विधि की भौतिक-रासायनिक नींव विकसित की)। |
4. रासायनिक गुणअमोनिया
अमोनिया के लिए, प्रतिक्रियाएं विशेषता हैं:
- नाइट्रोजन परमाणु की ऑक्सीकरण अवस्था में परिवर्तन के साथ (ऑक्सीकरण अभिक्रियाएँ)
- नाइट्रोजन परमाणु की ऑक्सीकरण अवस्था को बदले बिना (अतिरिक्त)
|
नाइट्रोजन परमाणु की ऑक्सीकरण अवस्था में परिवर्तन के साथ अभिक्रियाएँ (ऑक्सीकरण अभिक्रियाएँ) एन-3 → एन 0 → एन +2 NH3-मजबूत कम करने वाला एजेंट। |
|
ऑक्सीजन के साथ 1. अमोनिया का दहन (गर्म होने पर) 4 एनएच 3 + 3 ओ 2 → 2 एन 2 + 6 एच 2 0 2. अमोनिया का उत्प्रेरक ऑक्सीकरण (उत्प्रेरक)पीटी – राहु, तापमान) 4NH 3 + 5O 2 → 4NO + 6H 2 O वीडियो - प्रयोग "क्रोमियम ऑक्साइड की उपस्थिति में अमोनिया का ऑक्सीकरण" |
|
धातु आक्साइड के साथ 2 एनएच 3 + 3क्यूओ \u003d 3सीयू + एन 2 + 3 एच 2 ओ |
|
मजबूत ऑक्सीडेंट के साथ 2 एनएच 3 + 3 सीएल 2 \u003d एन 2 + 6 एचसीएल (गर्म होने पर) |
|
अमोनिया एक नाजुक यौगिक है, गर्म करने पर विघटित हो जाता है 2एनएच 3 एन 2 + 3एच 2 |
|
नाइट्रोजन परमाणु की ऑक्सीकरण अवस्था को बदले बिना अभिक्रियाएँ (अतिरिक्त - अमोनियम आयन का निर्माणएनएच4+दाता-स्वीकर्ता तंत्र के अनुसार) वीडियो - प्रयोग "अमोनिया के लिए गुणात्मक प्रतिक्रिया" वीडियो - प्रयोग "बिना आग के धुआँ" वीडियो - प्रयोग "सांद्र एसिड के साथ अमोनिया की बातचीत" वीडियो - प्रयोग "फव्वारा" वीडियो - प्रयोग "पानी में अमोनिया घोलना" |
5. अमोनिया का अनुप्रयोग
उत्पादन की मात्रा के मामले में, अमोनिया पहले स्थान पर है; दुनिया भर में सालाना इस यौगिक का लगभग 100 मिलियन टन प्राप्त होता है। अमोनिया तरल रूप में या जलीय घोल के रूप में उत्पन्न होता है - अमोनिया पानी, जिसमें आमतौर पर 25% NH 3 होता है। आगे अमोनिया की भारी मात्रा का उपयोग किया जाता है नाइट्रिक एसिड का उत्पादन करने के लिएजो जाता है उर्वरक उत्पादनऔर कई अन्य उत्पाद। अमोनिया के पानी का उपयोग सीधे उर्वरक के रूप में भी किया जाता है, और कभी-कभी खेतों को सीधे तरल अमोनिया के साथ टैंकों से पानी पिलाया जाता है। अमोनिया से विभिन्न अमोनियम लवण, यूरिया, यूरोट्रोपिन प्राप्त करें. उसका एक सस्ते सर्द के रूप में भी इस्तेमाल किया जाता हैऔद्योगिक प्रशीतन प्रणालियों में।
अमोनिया का भी प्रयोग किया जाता है सिंथेटिक फाइबर के उत्पादन के लिए, उदाहरण के लिए, नायलॉन और कैप्रोन। पर प्रकाश उद्योगक्या वो कपास, ऊन और रेशम की सफाई और रंगाई में उपयोग किया जाता है. तेल मेँ रासायनिक उद्योगअमोनिया का उपयोग एसिड अपशिष्ट को बेअसर करने के लिए किया जाता है, और प्राकृतिक रबर के उत्पादन में, अमोनिया बागान से कारखाने तक परिवहन के दौरान लेटेक्स को संरक्षित करने में मदद करता है। सॉल्वे विधि का उपयोग करके सोडा के उत्पादन में अमोनिया का भी उपयोग किया जाता है। स्टील उद्योग में, अमोनिया का उपयोग नाइट्राइडिंग के लिए किया जाता है - नाइट्रोजन के साथ स्टील की सतह परतों की संतृप्ति, जिससे इसकी कठोरता में काफी वृद्धि होती है।
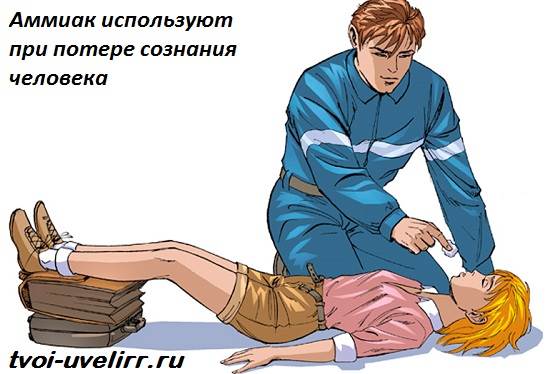
डॉक्टर अमोनिया (अमोनिया) के जलीय घोल का उपयोग करते हैं रोजमर्रा के अभ्यास में: अमोनिया में डूबा हुआ रुई व्यक्ति को बेहोशी से बचा लेता है। मनुष्यों के लिए, ऐसी खुराक में अमोनिया खतरनाक नहीं है।
सिमुलेटर
सिम्युलेटर नंबर 1 "अमोनिया का दहन"
सिम्युलेटर नंबर 2 "अमोनिया के रासायनिक गुण"
सुदृढीकरण के लिए कार्य
№1. योजना के अनुसार परिवर्तन करें:
a) नाइट्रोजन → अमोनिया → नाइट्रिक ऑक्साइड (II)
b) अमोनियम नाइट्रेट → अमोनिया → नाइट्रोजन
c) अमोनिया → अमोनियम क्लोराइड → अमोनिया → अमोनियम सल्फेट
ओवीआर के लिए, ई-बैलेंस तैयार करें, रियो के लिए, पूर्ण, आयनिक समीकरण।नंबर 2. चार समीकरण लिखिए रसायनिक प्रतिक्रियापरिणामस्वरूप अमोनिया का निर्माण होता है।
पंखुड़ियाँ हरी हो जाती हैं, और - काली हो जाती हैं।
फूलवाले, जैसा कि वे कहते हैं, ध्यान दें। हालांकि, अमोनियागतिविधि के अन्य क्षेत्रों में उपयोगी। हम पदार्थ के बाकी गुणों को सीखते हैं, इसके आवेदन के तरीकों से परिचित होते हैं।
अमोनिया के गुण
अमोनिया वाष्प के साथ काम करते समय, आपको सावधान रहना चाहिए। एक निश्चित सांद्रता पर, हवा के साथ अभिकर्मक का मिश्रण विस्फोटक होता है।
साथ ही, गैस जहरीली होती है। उसके साथ "संचार" तंत्रिका संबंधी विकारों, श्रवण हानि, आंशिक स्मृति हानि, लेंस के बादल से भरा होता है। अमोनिया के उत्पादन में काम करने वाले लोगों में ये लक्षण देखे जाते हैं।
अमोनिया वाष्प हमेशा ऊपर की ओर उठती है, क्योंकि गैस हवा से हल्की होती है। एक पदार्थ सामान्य परिस्थितियों में एक गैस है। परिवहन और बिक्री के लिए अमोनिया को तरलीकृत किया जाता है।
इसके लिए आपको चाहिए उच्च रक्त चाप. निर्जल ध्यान प्राप्त करें। उसके लिए 6221-90 GOST है।
तरलीकृत अमोनियाजहाजों में, फिर भी, इसका एक गैसीय चरण होता है। दबाव में, पदार्थ की दोनों अवस्थाएँ संतुलन में होती हैं।
इस मामले में, तापमान महत्वपूर्ण से नीचे होना चाहिए, साथ ही दबाव भी। यदि 132 डिग्री और 11 मेगापास्कल से अधिक हैं, तो संतुलन गड़बड़ा जाएगा।
किसी पदार्थ के आयतन संपीडन का गुणांक उसके विस्तार गुणांक से कई गुना कम होता है।
यदि बर्तन को ऊपर से भर दिया जाता है, तो तापमान में वृद्धि के परिणामस्वरूप 52 मेगापास्कल का दबाव हो सकता है।
यह युक्त बर्तन के धातु के सीम को तोड़ने के लिए पर्याप्त है। तदनुसार, एक विस्फोट होगा।
अमोनिया सांद्रण से आप प्राप्त कर सकते हैं अमोनिया सोल्यूशंसकिसी भी तीव्रता। हालांकि, निर्जल संस्करण भी मानवता के काम आता है।
उदाहरण के लिए, यह उर्वरकों में से एक है। इसके अलावा, पदार्थ में केवल हाइड्रोजन मौजूद है। अंतिम 3 परमाणु अर्थात गैस का सूत्र इस प्रकार है :- NH3
यह हाइड्रोजन सामग्री पानी में अमोनिया की उत्कृष्ट घुलनशीलता का कारण है। अन्य गैसें इसका दावा नहीं कर सकतीं।
अमोनिया और पानी के बीच मजबूत हाइड्रोजन बांड बनते हैं। घोल जितना अधिक संतृप्त होगा, उसके घुलने वाले गुण उतने ही अधिक होंगे।
उनके लिए, पदार्थ के साथ प्रतिस्पर्धा करता है एथिल अल्कोहोल, केवल अंतर यह है कि उत्तरार्द्ध कार्बनिक मूल का है।
इसलिए, जलीय अमोनिया, साथ ही एक सांद्र, क्षार और क्षारीय पृथ्वी समूहों की धातुओं को भंग करने में सक्षम हैं।
प्रतिक्रिया के परिणामस्वरूप गहरे नीले रंग के तरल पदार्थ निकलते हैं। यह संयोजकता इलेक्ट्रॉन आयनीकरण और विलयन का परिणाम है।
बाद की अवधारणा भंग धातुओं और अमोनिया के अणुओं के बीच एक इलेक्ट्रोस्टैटिक संपर्क को दर्शाती है।
अमोनिया से अमोनिया की गंधकहीं से बाहर आता है। एजेंट अमोनियम हाइड्रॉक्साइड का एक जलीय घोल है।
अर्थात, अमोनिया अमोनिया हैशराब। अमोनियम हाइड्रॉक्साइड मूत्र के साथ-साथ कार्बनिक अपघटन उत्पादों में भी पाया जाता है।
इसीलिए, उदाहरण के लिए, दलदल के नीचे से सड़ने वाले द्रव्यमान से अप्रिय गंध आती है। वे पौधों, मछलियों के अवशेषों को विघटित करते हैं।
उन्हीं तालाबों में अमोनिया प्राकृतिक रूप से पानी में मिल जाती है। विलयन में एक OH समूह उपस्थित होता है।
इसका मतलब है कि मिश्रण एक क्षारीय प्रतिक्रिया में सक्षम है, एक कमजोर आधार है। नायक को भंग कर देता है और शराब। अमोनियागलती से इसके साथ अमोनिया में नहीं मिला।
केंद्रित रूप में, हाइड्रोजन नाइट्राइड प्रकाश को दृढ़ता से अपवर्तित करता है, अर्थात इसकी किरणों की दिशा बदल देता है।
लेख के नायक की एक और जिज्ञासु संपत्ति उबल रही है उप-शून्य तापमान. शून्य से लगभग 34 नीचे होना चाहिए।
यदि आप तापमान को 78 डिग्री तक कम करते हैं, तो तरल पूरी तरह से सख्त हो जाएगा। यह बर्फ के समान सफेद रंग के गुच्छे निकलते हैं। पदार्थों का एक नियमित, सममित आकार होता है।
अमोनिया खनन
अमोनिया उत्पादनसालाना 100,000,000 टन तक कम हो गया। क्लोरीन की लगभग इतनी ही मात्रा निकाली जाती है। इसी समय, अमोनिया कम विषैला होता है।
निर्दिष्ट में अमोनिया मात्राइसमें नाइट्रोजन के प्राकृतिक स्रोतों से निकाला गया पदार्थ शामिल है, और परिस्थितियों के तहत संश्लेषित किया जाता है।
औद्योगिक विधि हाइड्रोजन और के संयोजन पर आधारित है नाइट्रोजन. अमोनियाउनमें से कम से कम 500 डिग्री सेल्सियस के तापमान पर प्राप्त किया जाता है।
एक और शर्त :- 350 वायुमंडल का दबाव। आप उत्प्रेरक के बिना नहीं कर सकते। यह स्वयं में प्रवेश किए बिना एक सुस्त प्रतिक्रिया को तेज करता है।
उत्प्रेरक की भूमिका आमतौर पर स्पंजी द्वारा की जाती है। अधिक महंगे सहायकों में से, ऑक्साइड चुना जाता है, या।
सरल पदार्थों की बातचीत के दौरान उत्पाद की अंतिम उपज लगभग 30-35% होती है।
यह न्यूनतम संभव तापमान और उच्चतम दबाव के अधीन अधिकतम है। यह युगल है जो प्रतिक्रिया की प्रभावशीलता सुनिश्चित करता है।
हालांकि, कम तापमान बार पर, प्रक्रिया की गति कम हो जाती है। यदि आप गर्मी चालू करते हैं, तो आप आंशिक रूप से बने रहेंगे के बिना अमोनियालेकिन आप इसे तेजी से प्राप्त करेंगे।
अमोनिया के उत्पादन के लिए सिंथेटिक विधि व्यावहारिक रूप से कार्बनिक पदार्थों के क्षय उत्पादों से प्रकृति में इसके निष्कर्षण का कोई मौका नहीं छोड़ती है। यह प्रक्रिया लंबी है।
अमोनियाबनता है, लेकिन जल्दी से अस्थिर हो जाता है। जाल में भूपर्पटीगैस दुर्लभ है।
आम तौर पर, अमोनिया धीरे-धीरे वाष्पित हो जाता है, जो प्राकृतिक जमा को तरल बना देता है।
अमोनिया का अनुप्रयोग
आवेदन पत्रकृषि क्षेत्र में पदार्थों का उल्लेख पहले ही किया जा चुका है। अब, सौंदर्य उद्योग के बारे में याद करते हुए आगे बढ़ते हैं बालों के लिए अमोनिया.
यहाँ हम याद करते हैं कि किसी पदार्थ का विलयन एक दुर्बल क्षार होता है। इसलिए नियुक्ति :- 10 के क्षेत्र में क्षारीय पीएच पेंट प्रदान करने के लिए।
ऐसा वातावरण बालों की सूजन में योगदान देता है, जो हाइड्रोजन पेरोक्साइड की अपघटन प्रतिक्रिया को ट्रिगर करता है।
उत्तरार्द्ध एक स्पष्टीकरण है, इसलिए, यह आवश्यक रूप से गोरा के रंगों में उपयोग किया जाता है।
अस्तित्व अमोनिया मुक्त पेंट. हालांकि, निर्माता आंशिक रूप से चालाक हैं। के बजाय शुद्ध पदार्थइसके डेरिवेटिव लागू होते हैं।
वे पीएच को क्षारीय स्तर तक भी बढ़ाते हैं, लेकिन अधिक महंगे हैं। तदनुसार, और अमोनिया मुक्त बाल डाईलागत की आवश्यकता है।

हालांकि, उपभोक्ता अपने बालों को बचाने के लिए उनके लिए तैयार हैं। तथ्य यह है कि शुद्ध अमोनिया बालों के छिद्रों को अधिक मजबूती से खोलता है।
वे एक स्पंज जैसा दिखने लगते हैं, जिसकी सतह को केवल महंगे सिलिकॉन सौंदर्य प्रसाधनों से चिकना किया जा सकता है जो कि voids को भरते हैं।
भोजन से व्यक्त क्षार -। इसके निर्माण के लिए भी निर्देशित अमोनिया संश्लेषण.
नाइट्रोजन प्राप्त करने के लिए भी इसका उत्पादन किया जाता है अम्ल अमोनियानाइट्रिक ऑक्साइड में परिवर्तित।
उत्तरार्द्ध को डाइऑक्साइड में ऑक्सीकृत किया जाता है। फिर, ऑक्साइड पानी द्वारा अवशोषित कर लिए जाते हैं। इस तरह वे इसे प्राप्त करते हैं।
अमोनिया सूत्र, जैसा कि पहले ही उल्लेख किया गया है, विस्फोटक पदार्थों के निर्माण का आधार है।
प्रशीतन उपकरण के उत्पादन में भी पदार्थ की आवश्यकता होती है। इसकी क्रिया वाष्पीकरण पर आधारित होती है तरलीकृत गैस. साथ ही, बहुत अधिक गर्मी अवशोषित होती है, जो वास्तव में ठंडक प्रदान करती है।
गहनों में अमोनिया भी शामिल था। इसका उपयोग पेस्ट से पॉलिश करने के बाद उत्पादों को साफ करने के लिए किया जाता है।
अमोनिया के लिए मानव जाति की आवश्यकता इसके उत्पादन की प्रवृत्ति को दर्शाती है। 30 साल पहले भी, प्रति वर्ष 70,000,000 टन अभिकर्मक बनते थे।
अब, जैसा कि "उत्पादन" अध्याय में उल्लेख किया गया है, यह 100,000,000 है। केवल उत्पादन के नेता नहीं बदले हैं। यह अभी भी संयुक्त राज्य अमेरिका है और, अब,।
पिछले वर्षों की संदर्भ पुस्तकों में, स्वाभाविक रूप से, यूएसएसआर दिखाई देता है। कि पदार्थ की कीमत बदल गई है, और अनुमान लगाने की कोई आवश्यकता नहीं है। आइए अमोनिया के वर्तमान मूल्य टैग से परिचित हों।
अमोनिया कीमत
अमोनिया खरीदेंथोक और खुदरा हो सकता है। एक नियम के रूप में, टन में बड़ी डिलीवरी की जाती है।
1000 किलोग्राम के लिए वे 19,000 रूबल से पूछते हैं। छोटे उद्यम लगभग 30 रूबल की मांग करते हुए किलोग्राम में बेचने के लिए तैयार हैं।
खुदरा क्षेत्र में, किलोग्राम की पेशकश शायद ही कभी की जाती है, टन की पेशकश बिल्कुल नहीं की जाती है। आइए अमोनिया पर ध्यान देते हुए फार्मेसियों की मूल्य सूची का अध्ययन करें।
आमतौर पर इसे 40 मिलीलीटर की बोतलों में डाला जाता है। इस तरह की मात्रा की लागत 15 से 31 रूबल तक होती है।
दिलचस्प है, अगर 25 और 100 मिलीलीटर की बोतलें हैं, तो उनकी कीमत लगभग 13 से 55 रूबल तक है।
वहीं, यह ध्यान देने योग्य है कि शराब का घोल 10 प्रतिशत है। थोक वितरण पर तरलीकृत अमोनिया केंद्रित है।
इसलिए उद्योगपतियों को माल के सही परिवहन के बारे में सोचना होगा। टैंकों के साथ विशेष अर्ध-ट्रेलर हैं।
कंटेनरों की आयु 30 वर्ष से अधिक नहीं होनी चाहिए। टैंकों की संरचना भी महत्वपूर्ण है, क्योंकि अमोनिया कई धातुओं को घोलती है।
टैंक में दबाव, तापमान को भी ध्यान में रखना आवश्यक है। इसलिए, अभिकर्मक की बिक्री के विज्ञापनों के बगल में, एक नियम के रूप में, अर्ध-ट्रेलरों की बिक्री और किराये के प्रस्ताव भी हैं। आप उनके बिना नहीं कर सकते।
तरल
अमोनिया- NH 3, हाइड्रोजन नाइट्राइड, सामान्य परिस्थितियों में - एक रंगहीन गैस जिसमें तीखी विशेषता गंध (अमोनिया की गंध) होती है, हवा से लगभग दोगुनी हल्की, जहरीली। पानी में NH 3 की घुलनशीलता बहुत अधिक है - पानी की मात्रा में लगभग 1200 वॉल्यूम (0 डिग्री सेल्सियस पर) या 700 वॉल्यूम (20 डिग्री सेल्सियस पर)। पर प्रशीतन R717 कहा जाता है, जहां R रेफ्रिजरेंट (रेफ्रिजरेंट) है, 7 रेफ्रिजरेंट (अकार्बनिक यौगिक) का प्रकार है, 17 आणविक भार है।
अमोनिया अणु में शीर्ष पर एक नाइट्रोजन परमाणु के साथ एक त्रिकोणीय पिरामिड का आकार होता है। नाइट्रोजन परमाणु के तीन अयुग्मित पी-इलेक्ट्रॉन तीन हाइड्रोजन परमाणुओं (एन-एच बांड) के 1-इलेक्ट्रॉनों के साथ ध्रुवीय सहसंयोजक बंधनों के निर्माण में भाग लेते हैं, बाहरी इलेक्ट्रॉनों की चौथी जोड़ी साझा नहीं की जाती है, यह हाइड्रोजन के साथ एक दाता-स्वीकर्ता बंधन बना सकता है। आयन, एक अमोनियम आयन NH 4 + बनाता है। इस तथ्य के कारण कि गैर-बंधन वाले दो-इलेक्ट्रॉन बादल अंतरिक्ष में सख्ती से उन्मुख होते हैं, अमोनिया अणु में एक उच्च ध्रुवता होती है, जिससे पानी में इसकी अच्छी घुलनशीलता होती है।
तरल अमोनिया में, अणु हाइड्रोजन बांड से जुड़े होते हैं। पानी के साथ तरल अमोनिया के भौतिक गुणों की तुलना से पता चलता है कि अमोनिया में कम क्वथनांक (t bale -33.35 ° C) और गलनांक (t pl -77.70 ° C) और साथ ही अधिक है। कम घनत्व, चिपचिपाहट (तरल अमोनिया की चिपचिपाहट पानी की चिपचिपाहट से 7 गुना कम है), चालकता और ढांकता हुआ स्थिरांक। यह कुछ हद तक इस तथ्य से समझाया गया है कि तरल अमोनिया में इन बंधनों की ताकत पानी की तुलना में काफी कम है, और इस तथ्य से भी कि दो जोड़े के विपरीत, अमोनिया अणु में केवल एक जोड़ी असंबद्ध इलेक्ट्रॉनों की है। पानी के अणु में, जो कई अणुओं के बीच हाइड्रोजन बांडों का एक व्यापक नेटवर्क बनाना संभव नहीं बनाता है। अमोनिया आसानी से 681.4 किग्रा / वर्ग मीटर के घनत्व वाले रंगहीन तरल में बदल जाता है, जो प्रकाश को दृढ़ता से अपवर्तित करता है। पानी की तरह, तरल अमोनिया अत्यधिक जुड़ा हुआ है, मुख्यतः हाइड्रोजन बांड के गठन के माध्यम से। तरल अमोनिया व्यावहारिक रूप से आचरण नहीं करता है बिजली. तरल अमोनिया बहुत के लिए एक अच्छा विलायक है एक लंबी संख्याकार्बनिक, साथ ही कई अकार्बनिक यौगिकों के लिए। ठोस अमोनिया रंगहीन घन क्रिस्टल है।
रासायनिक गुण
- एक अकेला इलेक्ट्रॉन जोड़ी की उपस्थिति के कारण, अमोनिया कई प्रतिक्रियाओं में न्यूक्लियोफाइल या कॉम्प्लेक्सिंग एजेंट के रूप में कार्य करता है। तो, यह एक अमोनियम आयन बनाते हुए एक प्रोटॉन को जोड़ता है:
- अमोनिया ("अमोनिया") के एक जलीय घोल में प्रक्रिया के कारण थोड़ी क्षारीय प्रतिक्रिया होती है:
- एसिड के साथ बातचीत करने से संबंधित अमोनियम लवण मिलते हैं:
- अमोनिया भी बहुत है कमजोर अम्ल(पानी से 10,000,000,000 गुना कमजोर), धातुओं के साथ लवण बनाने में सक्षम - एमाइड। NH 2 - आयनों वाले यौगिकों को एमाइड, NH 2− - इमाइड्स, और N 3− - नाइट्राइड कहा जाता है। क्षार धातु के एमाइड उन पर अमोनिया के साथ क्रिया करके प्राप्त किए जाते हैं:
तरल अमोनिया में कुछ प्रतिक्रियाओं के परिणामस्वरूप कई धातुओं के एमाइड, इमाइड और नाइट्राइड बनते हैं। नाइट्रोजन वातावरण में धातुओं को गर्म करके नाइट्राइड प्राप्त किए जा सकते हैं।
मेटल एमाइड हाइड्रॉक्साइड्स के एनालॉग हैं। इस सादृश्य को इस तथ्य से पुष्ट किया जाता है कि OH - और NH 2 - आयन, साथ ही H 2 O और NH 3 अणु, आइसोइलेक्ट्रोनिक हैं। एमाइड हाइड्रॉक्साइड की तुलना में अधिक मजबूत आधार होते हैं, और इसलिए जलीय घोल में अपरिवर्तनीय हाइड्रोलिसिस से गुजरते हैं:
NaNH 2 + H 2 O → NaOH + NH 3 CaNH + 2H 2 O → Ca (OH) 2 + NH 3 Zn 3 N 2 + 6H 2 O → 3Zn (OH) 2 + 2NH 3
और अल्कोहल में:
केएनएच 2 + सी 2 एच 5 ओएच → सी 2 एच 5 ओके + एनएच 3
क्षार के जलीय घोल की तरह, एमाइड के अमोनिया घोल विद्युत प्रवाह को अच्छी तरह से संचालित करते हैं, जो पृथक्करण के कारण होता है:
एमएनएच 2 → एम + + एनएच 2 -
इन विलयनों में फेनोल्फथेलिन लाल हो जाता है, जब अम्ल मिलाया जाता है, तो वे उदासीन हो जाते हैं। एमाइड की घुलनशीलता उसी क्रम में बदलती है जैसे हाइड्रॉक्साइड की घुलनशीलता: LiNH 2 अघुलनशील है, NaNH 2 थोड़ा घुलनशील है, KNH 2, RbNH 2 और CsNH 2 अत्यधिक घुलनशील हैं।
- गर्म होने पर, अमोनिया कम करने वाले गुणों को प्रदर्शित करता है। तो, यह ऑक्सीजन के वातावरण में जलता है, जिससे पानी और नाइट्रोजन बनता है। प्लैटिनम उत्प्रेरक पर हवा के साथ अमोनिया का ऑक्सीकरण नाइट्रोजन ऑक्साइड देता है, जिसका उपयोग उद्योग में नाइट्रिक एसिड के उत्पादन के लिए किया जाता है:
टांका लगाने के दौरान ऑक्साइड से धातु की सतह की सफाई के लिए अमोनिया NH 4 Cl का उपयोग NH 3 की कम करने की क्षमता पर आधारित है:
3CuO + 2NH 4 Cl → 3Cu + 3H 2 O + 2HCl + N 2
जिलेटिन की उपस्थिति में सोडियम हाइपोक्लोराइट के साथ अमोनिया का ऑक्सीकरण, हाइड्राज़िन प्राप्त होता है:
2NH3 + NaClO → N 2 H 4 + NaCl + H 2 O
- हैलोजन (क्लोरीन, आयोडीन) अमोनिया के साथ खतरनाक विस्फोटक बनाते हैं - नाइट्रोजन हैलाइड (नाइट्रोजन क्लोराइड, नाइट्रोजन आयोडाइड)।
- हेलोऐल्केन के साथ, अमोनिया एक न्यूक्लियोफिलिक जोड़ प्रतिक्रिया में प्रवेश करता है, एक प्रतिस्थापित अमोनियम आयन (एमाइन प्राप्त करने की एक विधि) बनाता है:
- कार्बोक्जिलिक एसिड के साथ, उनके एनहाइड्राइड, हैलाइड, एस्टर और अन्य डेरिवेटिव एमाइड देते हैं। एल्डिहाइड और कीटोन्स के साथ - शिफ बेस, जिसे संबंधित एमाइन (रिडक्टिव एमिनेशन) में कम किया जा सकता है।
- 1000 डिग्री सेल्सियस पर, अमोनिया कोयले के साथ प्रतिक्रिया करता है, एचसीएन बनाता है और आंशिक रूप से नाइट्रोजन और हाइड्रोजन में विघटित होता है। यह मीथेन के साथ भी प्रतिक्रिया कर सकता है, वही हाइड्रोसायनिक एसिड बना सकता है:
नाम इतिहास
अमोनिया (यूरोपीय भाषाओं में, इसका नाम "अमोनीक" जैसा लगता है) कारवां मार्गों के चौराहे पर स्थित उत्तरी अफ्रीका में अम्मोन ओएसिस के नाम पर इसका नाम है। गर्म जलवायु में, पशु अपशिष्ट में निहित यूरिया (एनएच 2) 2 सीओ विशेष रूप से जल्दी से विघटित हो जाता है। गिरावट उत्पादों में से एक अमोनिया है। अन्य स्रोतों के अनुसार, अमोनिया को इसका नाम प्राचीन मिस्र के शब्द . से मिला है अमोनिया. तथाकथित लोग आमोन भगवान की पूजा करते हैं। अपने अनुष्ठान के दौरान, उन्होंने अमोनिया NH 4 Cl को सूंघा, जो गर्म होने पर अमोनिया को वाष्पित कर देता है।
तरल अमोनिया
तरल अमोनिया, हालांकि कुछ हद तक, आयनों में विघटित हो जाता है, जिसमें पानी के साथ इसकी समानता प्रकट होती है:
2NH 3 → NH 4 + + NH 2 -
-50 डिग्री सेल्सियस पर तरल अमोनिया का स्व-आयनीकरण स्थिरांक लगभग 10 -33 (mol/l)² है।
तरल अमोनिया, पानी की तरह, एक मजबूत आयनकारी विलायक है जिसमें कई सक्रिय धातुएं घुल जाती हैं: क्षार, क्षारीय पृथ्वी, Mg, Al, साथ ही Eu और Yb। तरल NH 3 में क्षार धातुओं की घुलनशीलता कई दसियों प्रतिशत है। तरल अमोनिया NH 3 क्षार धातुओं वाले कुछ इंटरमेटेलिक यौगिकों को भी घोलता है, जैसे Na 4 Pb 9।
द्रव अमोनिया में धातुओं के तनु विलयन रंगीन होते हैं नीला रंगसांद्र विलयनों में धात्विक चमक होती है और वे कांसे के समान होते हैं। जब अमोनिया वाष्पित हो जाती है, तो क्षार धातुएँ मुक्त हो जाती हैं शुद्ध फ़ॉर्म, और क्षारीय पृथ्वी - धातु चालकता के साथ अमोनिया [ई (एनएच 3) 6] के साथ परिसरों के रूप में। थोड़ा सा गर्म करने पर, ये परिसर धातु और NH 3 में विघटित हो जाते हैं।
NH3 में घुली धातु धीरे-धीरे अभिक्रिया करके एमाइड बनाती है:
2Na + 2NH 3 → 2NaNH 2 + H 2 -
अमोनिया के साथ अभिक्रिया के परिणामस्वरूप धातु के एमाइड में होते हैं ऋणात्मक आयन NH 2 - , जो अमोनिया के स्व-आयनीकरण के दौरान भी बनता है। इस प्रकार, धातु एमाइड हाइड्रॉक्साइड के अनुरूप हैं। Li से Cs पर जाने पर अभिक्रिया दर बढ़ जाती है। एच 2 ओ की छोटी अशुद्धियों की उपस्थिति में प्रतिक्रिया बहुत तेज हो जाती है।
धातु-अमोनिया विलयनों में धात्विक विद्युत चालकता होती है, उनमें धातु के परमाणु क्षय होकर धनात्मक आयन बनते हैं और NH 3 अणुओं से घिरे विलेय इलेक्ट्रॉन होते हैं। मुक्त इलेक्ट्रॉनों वाले धातु-अमोनिया समाधान सबसे मजबूत कम करने वाले एजेंट हैं।
जटिलता
उनके इलेक्ट्रॉन-दान गुणों के कारण, NH3 अणु जटिल यौगिकों में एक लिगैंड के रूप में प्रवेश कर सकते हैं। इस प्रकार, डी-धातुओं के लवणों के घोल में अतिरिक्त अमोनिया की शुरूआत से उनके अमीनो परिसरों का निर्माण होता है:
CuSO 4 + 4NH 3 → SO 4 Ni(NO 3) 2 + 6NH 3 → (NO 3) 2
कॉम्प्लेक्सेशन आमतौर पर घोल के रंग में बदलाव के साथ होता है, इसलिए पहली प्रतिक्रिया में नीला रंग (CuSO 4) गहरे नीले (कॉम्प्लेक्स का रंग) में बदल जाता है, और दूसरी प्रतिक्रिया में रंग हरे (Ni) से बदल जाता है। सं 3) 2) से नीला-बैंगनी। NH 3 के साथ सबसे मजबूत कॉम्प्लेक्स +3 ऑक्सीकरण अवस्था में क्रोमियम और कोबाल्ट बनाते हैं।
जैविक भूमिका
अमोनिया मनुष्यों और जानवरों में नाइट्रोजन चयापचय का अंतिम उत्पाद है। यह प्रोटीन, अमीनो एसिड और अन्य नाइट्रोजन यौगिकों के चयापचय के दौरान बनता है। यह शरीर के लिए अत्यधिक विषैला होता है, इसलिए ऑर्निथिन चक्र के दौरान अधिकांश अमोनिया यकृत द्वारा अधिक हानिरहित और कम विषैले यौगिक - यूरिया (यूरिया) में परिवर्तित हो जाता है। यूरिया तब गुर्दे द्वारा उत्सर्जित होता है, और कुछ यूरिया को यकृत या गुर्दे द्वारा वापस अमोनिया में परिवर्तित किया जा सकता है।
अमोनिया का उपयोग यकृत द्वारा रिवर्स प्रक्रिया के लिए भी किया जा सकता है, अमोनिया से अमीनो एसिड का पुनर्संश्लेषण और अमीनो एसिड कीटो एनालॉग्स। इस प्रक्रिया को "रिडक्टिव एमिनेशन" कहा जाता है। सोरेल से सिरका अम्लयह α-ketoglutaric - glutamine, आदि से एसपारटिक निकलता है।
शारीरिक क्रिया
शरीर पर शारीरिक प्रभाव के अनुसार, यह एक एस्फिक्सिएंट और न्यूरोट्रोपिक प्रभाव वाले पदार्थों के समूह से संबंधित है, जो साँस लेने पर विषाक्त फुफ्फुसीय एडिमा और तंत्रिका तंत्र को गंभीर नुकसान पहुंचा सकता है। अमोनिया में स्थानीय और पुनरुत्पादक दोनों प्रभाव होते हैं।
अमोनिया वाष्प आंखों और श्वसन अंगों, साथ ही त्वचा के श्लेष्म झिल्ली को बहुत परेशान करता है। इसे हम एक तीखी गंध के रूप में देखते हैं। अमोनिया वाष्प के कारण अत्यधिक लैक्रिमेशन, आंखों में दर्द, कंजंक्टिवा और कॉर्निया की रासायनिक जलन, दृष्टि की हानि, खांसी के दौरे, त्वचा की लालिमा और खुजली होती है। जब तरल अमोनिया और उसके घोल त्वचा के संपर्क में आते हैं, तो जलन होती है, फफोले और अल्सर के साथ एक रासायनिक जलन संभव है। इसके अलावा, तरलीकृत अमोनिया वाष्पीकरण के दौरान गर्मी को अवशोषित करता है, और त्वचा के संपर्क में आने पर अलग-अलग डिग्री का शीतदंश होता है। अमोनिया की गंध 37 मिलीग्राम / वर्ग मीटर की एकाग्रता में महसूस की जाती है।
अंत में स्वीकार्य एकाग्रताहवा में कार्य क्षेत्र उत्पादन परिसर 20 मिलीग्राम / वर्ग मीटर है। इसलिए, यदि अमोनिया की गंध महसूस होती है, तो सुरक्षात्मक उपकरणों के बिना काम करना पहले से ही खतरनाक है। ग्रसनी की जलन तब प्रकट होती है जब हवा में अमोनिया की मात्रा 280 mg / m³, आँख - 490 mg / m³ होती है। बहुत अधिक सांद्रता के संपर्क में आने पर, अमोनिया त्वचा के घावों का कारण बनता है: 7-14 g/m³ - एरिथेमेटस, 21 g/m³ या अधिक - बुलस डर्मेटाइटिस। 1.5 ग्राम / वर्ग मीटर की एकाग्रता के साथ एक घंटे के लिए अमोनिया के संपर्क में आने पर विषाक्त फुफ्फुसीय एडिमा विकसित होती है। 3.5 g/m³ या उससे अधिक की सांद्रता में अमोनिया के अल्पकालिक संपर्क से सामान्य विषाक्त प्रभाव का विकास होता है। में अमोनिया की अधिकतम अनुमेय सांद्रता वायुमंडलीय हवा बस्तियोंके बराबर है: औसत दैनिक 0.04 mg/m³; अधिकतम एकल खुराक 0.2 मिलीग्राम / वर्ग मीटर।
दुनिया में, वायुमंडल में अमोनिया की अधिकतम सांद्रता (1 मिलीग्राम / मी³ से अधिक) भारत-गंगा के मैदान में, संयुक्त राज्य अमेरिका की मध्य घाटी और दक्षिण कजाकिस्तान क्षेत्र में देखी जाती है।
आवेदन पत्र
अमोनिया रासायनिक उद्योग के सबसे महत्वपूर्ण उत्पादों में से एक है, इसका वार्षिक विश्व उत्पादन 150 मिलियन टन तक पहुंचता है। यह मुख्य रूप से नाइट्रोजन उर्वरकों (अमोनियम नाइट्रेट और सल्फेट, यूरिया), विस्फोटक और पॉलिमर, नाइट्रिक एसिड, सोडा (अमोनिया विधि) और अन्य रासायनिक उत्पादों के उत्पादन के लिए उपयोग किया जाता है। तरल अमोनिया का उपयोग विलायक के रूप में किया जाता है।
रेफ्रिजरेशन में इसे रेफ्रिजरेंट (R717) के रूप में प्रयोग किया जाता है
दवा में, अमोनिया का 10% घोल, जिसे अक्सर अमोनिया कहा जाता है, का उपयोग बेहोशी (सांस लेने को प्रोत्साहित करने के लिए), उल्टी को प्रोत्साहित करने के लिए, साथ ही बाहरी रूप से - नसों का दर्द, मायोसिटिस, कीड़े के काटने, सर्जन के हाथों के उपचार के लिए किया जाता है। पर बुरा प्रयोगअन्नप्रणाली और पेट में जलन पैदा कर सकता है (एक पतला घोल लेने के मामले में), प्रतिवर्त श्वसन गिरफ्तारी (जब उच्च सांद्रता में साँस ली जाती है)।
शीर्ष पर, साँस लेना और अंदर लागू करें। श्वास को उत्तेजित करने और रोगी को बेहोशी से दूर करने के लिए, रोगी की नाक (0.5-1 सेकेंड के लिए) में अमोनिया से सिक्त धुंध या रूई का एक छोटा टुकड़ा सावधानी से लाएं। अंदर (केवल प्रजनन में) उल्टी को प्रेरित करने के लिए। कीड़े के काटने पर - लोशन के रूप में; नसों का दर्द और मायोसिटिस के साथ - अमोनिया लिनिमेंट के साथ रगड़ना। सर्जिकल अभ्यास में, उन्हें गर्म उबले हुए पानी में पाला जाता है और हाथ धोते हैं।
चूंकि यह एक कमजोर आधार है, यह बातचीत करते समय एसिड को निष्क्रिय कर देता है।
अमोनिया का शारीरिक प्रभाव अमोनिया की तीखी गंध के कारण होता है, जो नाक के म्यूकोसा के विशिष्ट रिसेप्टर्स को परेशान करता है और मस्तिष्क के श्वसन और वासोमोटर केंद्रों को उत्तेजित करता है, जिससे श्वास में वृद्धि होती है और रक्तचाप में वृद्धि होती है।
रसीद
अमोनिया के उत्पादन की औद्योगिक विधि हाइड्रोजन और नाइट्रोजन के सीधे संपर्क पर आधारित है:
एन 2 (जी) + 3 एच 2 (जी) ↔ 2एनएच 3 (जी) + 45.9 केजे
यह तथाकथित हैबर प्रक्रिया है (जर्मन भौतिक विज्ञानी, विधि की भौतिक-रासायनिक नींव विकसित की)।
प्रतिक्रिया गर्मी की रिहाई और मात्रा में कमी के साथ होती है। इसलिए, ले चेटेलियर सिद्धांत के आधार पर, प्रतिक्रिया को पर किया जाना चाहिए कम तामपानऔर उच्च दबाव पर - तब संतुलन को दाईं ओर स्थानांतरित कर दिया जाएगा। हालांकि, कम तापमान पर प्रतिक्रिया दर नगण्य है, और उच्च तापमान पर रिवर्स प्रतिक्रिया की दर बढ़ जाती है। बहुत उच्च दबाव पर प्रतिक्रिया करने के लिए एक विशेष, समझ के निर्माण की आवश्यकता होती है अधिक दबावउपकरण, और इसलिए एक बड़ा निवेश। इसके अलावा, 700 डिग्री सेल्सियस पर भी प्रतिक्रिया का संतुलन, इसके व्यावहारिक उपयोग के लिए बहुत धीरे-धीरे स्थापित होता है।
एक उत्प्रेरक (अल 2 ओ 3 और के 2 ओ की अशुद्धियों के साथ झरझरा लोहा) के उपयोग ने संतुलन की स्थिति की उपलब्धि में तेजी लाना संभव बना दिया। दिलचस्प बात यह है कि इस भूमिका के लिए उत्प्रेरक की तलाश में 20 हजार से अधिक विभिन्न पदार्थों की कोशिश की गई।
उपरोक्त सभी कारकों को ध्यान में रखते हुए, अमोनिया प्राप्त करने की प्रक्रिया को पूरा किया जाता है निम्नलिखित शर्तें: तापमान 500 डिग्री सेल्सियस, दबाव 350 वायुमंडल, उत्प्रेरक। ऐसी परिस्थितियों में अमोनिया की उपज लगभग 30% है। पर औद्योगिक वातावरणपरिसंचरण के सिद्धांत का उपयोग किया जाता है - अमोनिया को ठंडा करके हटा दिया जाता है, और प्रतिक्रिया न किए गए नाइट्रोजन और हाइड्रोजन को संश्लेषण स्तंभ में वापस कर दिया जाता है। यह दबाव बढ़ाकर उच्च प्रतिक्रिया उपज प्राप्त करने की तुलना में अधिक किफायती साबित होता है।
प्रयोगशाला में अमोनिया प्राप्त करने के लिए, अमोनियम लवण पर प्रबल क्षार की क्रिया का उपयोग किया जाता है:
NH 4 Cl + NaOH = NH 3 + NaCl + H 2 O।
आमतौर पर प्रयोगशाला तरीके से प्राप्त किया जाता है, यह अमोनियम क्लोराइड के मिश्रण के कमजोर हीटिंग द्वारा प्राप्त किया जाता है कास्टिक चूना. 2NH 4 Cl + Ca(OH) 2 = CaCl 2 + 2NH 3 + 2H 2 O
अमोनिया को सुखाने के लिए इसे चूने और कास्टिक सोडा के मिश्रण से गुजारा जाता है।
सोडियम धातु को इसमें घोलकर और बाद में इसे आसवन करके बहुत शुष्क अमोनिया प्राप्त किया जा सकता है। यह वैक्यूम के तहत धातु से बने सिस्टम में सबसे अच्छा किया जाता है। सिस्टम को उच्च दबाव का सामना करने में सक्षम होना चाहिए कमरे का तापमानदबाव संतृप्त वाष्पअमोनिया लगभग 10 वायुमंडल)। उद्योग में, अमोनिया को अवशोषण कॉलम में सुखाया जाता है।
चिकित्सा में अमोनिया
कीड़े के काटने के लिए, अमोनिया को लोशन के रूप में बाहरी रूप से लगाया जाता है। संभव दुष्प्रभाव: लंबे समय तक एक्सपोजर (साँस लेना उपयोग) के साथ, अमोनिया प्रतिवर्त श्वसन गिरफ्तारी का कारण बन सकता है। सामयिक अनुप्रयोग जिल्द की सूजन, एक्जिमा, और अन्य में contraindicated है चर्म रोग, साथ ही त्वचा की खुली दर्दनाक चोटों के साथ। साँस लेना आवेदन के साथ - प्रतिवर्त श्वसन गिरफ्तारी, सामयिक अनुप्रयोग के साथ - आवेदन के स्थल पर जलन, जिल्द की सूजन, एक्जिमा। सामयिक अनुप्रयोग केवल बरकरार त्वचा पर ही संभव है। आंख के श्लेष्म झिल्ली को आकस्मिक क्षति के मामले में, पानी से (हर 10 मिनट में 15 मिनट के लिए) या 5% घोल से कुल्ला करें। बोरिक अम्ल. तेल और मलहम का उपयोग नहीं किया जाता है। नाक और ग्रसनी की हार के साथ - 0.5% समाधान साइट्रिक एसिडया प्राकृतिक रस। अंतर्ग्रहण के मामले में, पानी, फलों का रस, दूध, अधिमानतः 0.5% साइट्रिक एसिड घोल या 1% एसिटिक एसिड घोल तब तक पियें जब तक पेट की सामग्री पूरी तरह से निष्प्रभावी न हो जाए। दूसरों के साथ बातचीत दवाईअनजान। (उपयोग के लिए निर्देश)
पानी में
- हैलोजन (क्लोरीन, आयोडीन) अमोनिया के साथ खतरनाक विस्फोटक बनाते हैं - नाइट्रोजन हैलाइड (नाइट्रोजन क्लोराइड, नाइट्रोजन आयोडाइड)।
- हेलोऐल्केन के साथ, अमोनिया एक न्यूक्लियोफिलिक जोड़ प्रतिक्रिया में प्रवेश करता है, एक प्रतिस्थापित अमोनियम आयन (एमाइन प्राप्त करने की एक विधि) बनाता है:
- कार्बोक्जिलिक एसिड के साथ, उनके एनहाइड्राइड, एसिड हैलाइड, एस्टर और अन्य डेरिवेटिव एमाइड देते हैं। एल्डिहाइड और कीटोन्स के साथ - शिफ बेस, जिसे संबंधित एमाइन (रिडक्टिव एमिनेशन) में कम किया जा सकता है।
- 1000 डिग्री सेल्सियस पर, अमोनिया कोयले के साथ प्रतिक्रिया करता है, हाइड्रोसाइनिक एसिड एचसीएन बनाता है और आंशिक रूप से नाइट्रोजन और हाइड्रोजन में विघटित होता है। यह मीथेन के साथ भी प्रतिक्रिया कर सकता है, वही हाइड्रोसायनिक एसिड बना सकता है:
नाम इतिहास
अमोनिया (यूरोपीय भाषाओं में, इसका नाम "अमोनीक" जैसा लगता है) कारवां मार्गों के चौराहे पर स्थित उत्तरी अफ्रीका में अम्मोन ओएसिस के नाम पर इसका नाम है। गर्म जलवायु में, पशु अपशिष्ट में निहित यूरिया (एनएच 2) 2 सीओ विशेष रूप से जल्दी से विघटित हो जाता है। गिरावट उत्पादों में से एक अमोनिया है। अन्य स्रोतों के अनुसार, अमोनिया को इसका नाम प्राचीन मिस्र के शब्द . से मिला है अमोनिया. तथाकथित लोग भगवान अमुन की पूजा करते हैं। अपने अनुष्ठान के दौरान, उन्होंने अमोनिया NH 4 Cl को सूंघा, जो गर्म होने पर अमोनिया को वाष्पित कर देता है।
तरल अमोनिया
तरल अमोनिया, हालांकि कुछ हद तक, आयनों (ऑटोप्रोटोलिसिस) में अलग हो जाता है, जिसमें पानी के साथ इसकी समानता प्रकट होती है:
-50 डिग्री सेल्सियस पर तरल अमोनिया का स्व-आयनीकरण स्थिरांक लगभग 10 -33 (mol/l)² है।
अमोनिया के साथ प्रतिक्रिया से उत्पन्न धातु एमाइड में ऋणात्मक NH 2 - आयन होता है, जो अमोनिया के स्व-आयनीकरण के दौरान भी बनता है। इस प्रकार, धातु एमाइड हाइड्रॉक्साइड के अनुरूप हैं। Li से Cs पर जाने पर अभिक्रिया दर बढ़ जाती है। एच 2 ओ की छोटी अशुद्धियों की उपस्थिति में प्रतिक्रिया बहुत तेज हो जाती है।
धातु-अमोनिया विलयनों में धात्विक विद्युत चालकता होती है, उनमें धातु के परमाणु क्षय होकर धनात्मक आयन बनते हैं और NH 3 अणुओं से घिरे विलेय इलेक्ट्रॉन होते हैं। मुक्त इलेक्ट्रॉनों वाले धातु-अमोनिया समाधान सबसे मजबूत कम करने वाले एजेंट हैं।
जटिलता
उनके इलेक्ट्रॉन-दान गुणों के कारण, NH3 अणु जटिल यौगिकों में एक लिगैंड के रूप में प्रवेश कर सकते हैं। इस प्रकार, डी-धातुओं के लवणों के घोल में अतिरिक्त अमोनिया की शुरूआत से उनके अमीनो परिसरों का निर्माण होता है:
जटिलता आमतौर पर समाधान के रंग में बदलाव के साथ होती है। तो, पहली प्रतिक्रिया में, नीला रंग (CuSO 4) गहरे नीले (कॉम्प्लेक्स का रंग) में बदल जाता है, और दूसरी प्रतिक्रिया में, रंग हरे (Ni (NO 3) 2) से बदलकर नीला-बैंगनी हो जाता है। NH 3 के साथ सबसे मजबूत कॉम्प्लेक्स +3 ऑक्सीकरण अवस्था में क्रोमियम और कोबाल्ट बनाते हैं।
जैविक भूमिका
अमोनिया मनुष्यों और जानवरों में नाइट्रोजन चयापचय का अंतिम उत्पाद है। यह प्रोटीन, अमीनो एसिड और अन्य नाइट्रोजन यौगिकों के चयापचय के दौरान बनता है। यह शरीर के लिए अत्यधिक विषैला होता है, इसलिए ऑर्निथिन चक्र के दौरान अधिकांश अमोनिया यकृत द्वारा अधिक हानिरहित और कम विषैले यौगिक - यूरिया (यूरिया) में परिवर्तित हो जाता है। यूरिया तब गुर्दे द्वारा उत्सर्जित होता है, और कुछ यूरिया को यकृत या गुर्दे द्वारा वापस अमोनिया में परिवर्तित किया जा सकता है।
अमोनिया का उपयोग यकृत द्वारा रिवर्स प्रक्रिया के लिए भी किया जा सकता है - अमोनिया और अमीनो एसिड कीटो एनालॉग्स से अमीनो एसिड का पुनर्संश्लेषण। इस प्रक्रिया को "रिडक्टिव एमिनेशन" कहा जाता है। इस प्रकार, एसपारटिक एसिड ऑक्सैलोएसेटिक एसिड से प्राप्त होता है, ग्लूटामिक एसिड α-ketoglutaric एसिड, आदि से प्राप्त होता है।
शारीरिक क्रिया
शरीर पर शारीरिक प्रभाव के अनुसार, यह एक एस्फिक्सिएंट और न्यूरोट्रोपिक प्रभाव वाले पदार्थों के समूह से संबंधित है, जो साँस लेने पर विषाक्त फुफ्फुसीय एडिमा और तंत्रिका तंत्र को गंभीर नुकसान पहुंचा सकता है। अमोनिया में स्थानीय और पुनरुत्पादक दोनों प्रभाव होते हैं।
अमोनिया वाष्प आंखों और श्वसन अंगों, साथ ही त्वचा के श्लेष्म झिल्ली को बहुत परेशान करता है। यह एक व्यक्ति है और एक तीखी गंध के रूप में मानता है। अमोनिया वाष्प के कारण अत्यधिक लैक्रिमेशन, आंखों में दर्द, कंजंक्टिवा और कॉर्निया की रासायनिक जलन, दृष्टि की हानि, खांसी के दौरे, त्वचा की लालिमा और खुजली होती है। जब तरल अमोनिया और उसके घोल त्वचा के संपर्क में आते हैं, तो जलन होती है, फफोले और अल्सर के साथ एक रासायनिक जलन संभव है। इसके अलावा, तरलीकृत अमोनिया वाष्पीकरण के दौरान गर्मी को अवशोषित करता है, और त्वचा के संपर्क में आने पर अलग-अलग डिग्री का शीतदंश होता है। अमोनिया की गंध 37 मिलीग्राम / वर्ग मीटर की एकाग्रता में महसूस की जाती है।
आवेदन पत्र
अमोनिया रासायनिक उद्योग के सबसे महत्वपूर्ण उत्पादों में से एक है, इसका वार्षिक विश्व उत्पादन 150 मिलियन टन तक पहुंचता है। यह मुख्य रूप से नाइट्रोजन उर्वरकों (अमोनियम नाइट्रेट और सल्फेट, यूरिया), विस्फोटक और पॉलिमर, नाइट्रिक एसिड, सोडा (अमोनिया विधि) और अन्य रासायनिक उत्पादों के उत्पादन के लिए उपयोग किया जाता है। तरल अमोनिया का उपयोग विलायक के रूप में किया जाता है।
प्रति टन अमोनिया की खपत दर
रूस में एक टन अमोनिया का उत्पादन औसतन 1200 एनएम³ . की खपत करता है प्राकृतिक गैस, यूरोप में - 900 एनएम³।
बेलारूसी "ग्रोडनो एज़ोट" अमोनिया के प्रति टन 1200 एनएम³ प्राकृतिक गैस की खपत करता है, आधुनिकीकरण के बाद खपत 876 एनएम³ तक घटने की उम्मीद है।
यूक्रेनी उत्पादक प्रति टन अमोनिया के 750 एनएम³ से 1170 एनएम³ प्राकृतिक गैस की खपत करते हैं।
यूएचडीई तकनीक अमोनिया के प्रति टन 6.7 - 7.4 Gcal ऊर्जा संसाधनों की खपत का दावा करती है।
चिकित्सा में अमोनिया
कीड़े के काटने के लिए, अमोनिया को लोशन के रूप में बाहरी रूप से लगाया जाता है। 10% जलीय अमोनिया घोल को अमोनिया के रूप में जाना जाता है।
साइड इफेक्ट संभव हैं: लंबे समय तक एक्सपोजर (साँस लेना उपयोग) के साथ, अमोनिया प्रतिवर्त श्वसन गिरफ्तारी का कारण बन सकता है।
सामयिक अनुप्रयोग जिल्द की सूजन, एक्जिमा, अन्य त्वचा रोगों के साथ-साथ त्वचा की खुली दर्दनाक चोटों के लिए contraindicated है।
आंख के श्लेष्म झिल्ली को आकस्मिक क्षति के मामले में, पानी (हर 10 मिनट में 15 मिनट के लिए) या बोरिक एसिड के 5% घोल से कुल्ला करें। तेल और मलहम का उपयोग नहीं किया जाता है। नाक और ग्रसनी की हार के साथ - साइट्रिक एसिड या प्राकृतिक रस का 0.5% समाधान। अंतर्ग्रहण के मामले में, पानी, फलों का रस, दूध, अधिमानतः 0.5% साइट्रिक एसिड घोल या 1% एसिटिक एसिड घोल तब तक पियें जब तक पेट की सामग्री पूरी तरह से निष्प्रभावी न हो जाए।
अन्य दवाओं के साथ बातचीत अज्ञात है।
अमोनिया उत्पादक
रूस में अमोनिया उत्पादक
| सोहबत | 2006, हजार टन | 2007, हजार टन |
|---|---|---|
| जेएससी "टोग्लिअट्टियाज़ोट"]] | 2 635 | 2 403,3 |
| ओएओ एनएके अज़ोटी | 1 526 | 1 514,8 |
| जेएससी "एक्रोन" | 1 526 | 1 114,2 |
| OAO Nevinnomyssky Azot, Nevinnomyssk | 1 065 | 1 087,2 |
| मिनुडोब्रेनिया जेएससी (रॉसोश) | 959 | 986,2 |
| जेएससी "एज़ोट" | 854 | 957,3 |
| ओजेएससी "अज़ोट" | 869 | 920,1 |
| OJSC "किरोवो-चेपेत्स्की खिम। जोड़ना" | 956 | 881,1 |
| OJSC चेरेपोवेट्स एज़ोट | 936,1 | 790,6 |
| ज़ाओ कुइबिशेवाज़ोत | 506 | 570,4 |
| गज़प्रोम सलावत नेफ्तेखिम" | 492 | 512,8 |
| "खनिज उर्वरक" (पर्म) | 437 | 474,6 |
| OJSC डोरोगोबुझ | 444 | 473,9 |
| OAO Voskresensk खनिज उर्वरक | 175 | 205,3 |
| OJSC शेकिनोअज़ोट | 58 | 61,1 |
| ओओओ मेंडेलीव्स्कअज़ोत | - | - |
| कुल | 13 321,1 | 12 952,9 |
रूस में दुनिया के अमोनिया उत्पादन का लगभग 9% हिस्सा है। रूस अमोनिया के दुनिया के सबसे बड़े निर्यातकों में से एक है। अमोनिया के कुल उत्पादन का लगभग 25% निर्यात किया जाता है, जो विश्व निर्यात का लगभग 16% है।
यूक्रेन में अमोनिया उत्पादक
- बृहस्पति के बादल अमोनिया से बने हैं।
यह सभी देखें
टिप्पणियाँ
लिंक
- //
- // ब्रोकहॉस और एफ्रॉन का विश्वकोश शब्दकोश: 86 खंडों में (82 खंड और 4 अतिरिक्त)। - सेंट पीटर्सबर्ग। , 1890-1907।
- // ब्रोकहॉस और एफ्रॉन का विश्वकोश शब्दकोश: 86 खंडों में (82 खंड और 4 अतिरिक्त)। - सेंट पीटर्सबर्ग। , 1890-1907।
अमोनिया। इस गैस के अणुओं में एक पिरामिड का आकार होता है, जिसके एक शीर्ष पर नाइट्रोजन परमाणु होता है। वे हाइड्रोजन बांड द्वारा बनते हैं और मजबूत ध्रुवीयता की विशेषता होती है। यह अमोनिया के असामान्य भौतिक गुणों की व्याख्या करता है: इसका गलनांक लगभग -80 डिग्री है। यह पानी, अल्कोहल और अन्य में अत्यधिक घुलनशील है ऑर्गेनिक सॉल्वेंट.
अमोनिया का अनुप्रयोग
अमोनिया खेलता है महत्वपूर्ण भूमिकाउद्योग में। इसकी सहायता से प्राप्त करें नाइट्रोजन उर्वरकइसमे लागू कृषि, नाइट्रिक एसिड और यहां तक कि विस्फोटक भी। अमोनिया, चिकित्सकों द्वारा व्यापक रूप से उपयोग किया जाता है, अमोनिया का उपयोग करके भी उत्पादित किया जाता है। इस गैस की तीखी गंध नाक के म्यूकोसा को परेशान करती है और श्वसन क्रिया को उत्तेजित करती है। अमोनियाबेहोशी या शराब विषाक्तता के लिए उपयोग किया जाता है। दवा में अमोनिया का बाहरी उपयोग भी होता है। यह एक उत्कृष्ट एंटीसेप्टिक है, जिसे सर्जन ऑपरेशन से पहले अपने हाथों का इलाज करते हैं।
अमोनिया, अमोनिया के अपघटन उत्पाद के रूप में, सोल्डरिंग धातुओं में प्रयोग किया जाता है। पर उच्च तापमानअमोनिया अमोनिया से प्राप्त होता है, जो धातु को ऑक्साइड फिल्म के निर्माण से बचाता है।
अमोनिया विषाक्तता
अमोनिया एक विषैला पदार्थ है। अक्सर काम पर, इस गैस के साथ जहर होता है, जो घुटन, प्रलाप और मजबूत उत्तेजना के साथ होता है। आप किसी ऐसे व्यक्ति की मदद कैसे कर सकते हैं जो इस स्थिति में है? सबसे पहले आपको उसकी आंखों को पानी से कुल्ला करने की जरूरत है और साइट्रिक एसिड के कमजोर घोल से पहले से सिक्त एक धुंध पट्टी पर रख दें। फिर इसे उस क्षेत्र से निकालना आवश्यक है जहां अमोनिया की उच्च सांद्रता देखी जाती है। लगभग 350 mg/m³ की सांद्रता में विषाक्तता संभव है।
अगर अमोनिया त्वचा के संपर्क में आता है, तो प्रभावित क्षेत्रों को तुरंत पानी से धो लें। त्वचा पर अमोनिया की मात्रा के आधार पर, हो सकता है गंभीर लालीया फफोले के साथ रासायनिक जलन।
उन संयंत्रों में जहां अमोनिया का उत्पादन होता है, गंभीर उपाय किए गए हैं अग्नि सुरक्षा. तथ्य यह है कि अमोनिया और वायु का मिश्रण अत्यधिक ज्वलनशील होता है। जिन कंटेनरों में इसे संग्रहीत किया जाता है, वे गर्म होने पर आसानी से फट सकते हैं।
अमोनिया के रासायनिक गुण
अमोनिया अनेक अम्लों के साथ अभिक्रिया करता है। इस बातचीत के परिणामस्वरूप, विभिन्न अमोनियम लवण प्राप्त होते हैं। पॉलीबेसिक एसिड के साथ प्रतिक्रिया करते समय, दो प्रकार के लवण प्राप्त होते हैं (अमोनिया के मोल की संख्या के आधार पर)।
