Az ammónia a vegyi anyagok csoportjába tartozik. Ammónia előállítása az iparban. Ammónia kinyerése a laboratóriumban
Ammónia -NH 3
Az ammónia (az európai nyelveken a neve úgy hangzik, mint "ammónia") a nevét az ammóni oázisnak köszönheti. Észak-Afrika karavánútvonalak kereszteződésében található. Meleg éghajlaton az állati hulladékban található karbamid (NH 2) 2 CO különösen gyorsan lebomlik. Az egyik bomlástermék az ammónia. Más források szerint az ammónia az ókori egyiptomi szóról kapta a nevét ammónia. Az úgynevezett emberek, akik Amun istent imádják. Rituális rítusaik során NH 4 Cl-t szippantottak ammóniából, amely hevítés hatására az ammóniát elpárologtatja.
1. A molekula szerkezete
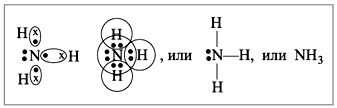
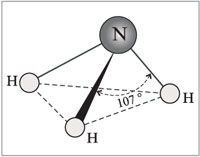
Az ammónia molekula trigonális piramis alakú, tetején nitrogénatommal. A nitrogénatom három párosítatlan p-elektronja részt vesz a poláris kovalens kötések kialakításában három hidrogénatom 1s-elektronjaival (N-H kötés), a negyedik külső elektronpár nem megosztott, hidrogénnel donor-akceptor kötést tud kialakítani. ion, ammóniumiont képezve NH 4 + .
Kilátás kémiai kötés: kovalens poláris, három szimplaσ - N-H kötés szigma
2. Az ammónia fizikai tulajdonságai
Nál nél normál körülmények között- színtelen, éles jellegzetes szagú gáz (ammónia szag), a levegőnél majdnem kétszer könnyebb, mérgező.A szervezetre gyakorolt élettani hatása szerint a fullasztó és neurotróp hatású anyagok csoportjába tartozik, amelyek belélegezve mérgező tüdőödémát és súlyos károsodást okozhatnak. idegrendszer. Az ammónia gőzei erősen irritálják a szem és a légzőszervek nyálkahártyáját, valamint bőr. Ezt szúrós szagként érzékeljük. Az ammóniagőzök erős könnyezést, szemfájdalmat, a kötőhártya és a szaruhártya kémiai égését, látásvesztést, köhögési rohamokat, bőrpírt és viszketést okoznak. Az NH 3 vízoldhatósága rendkívül magas - körülbelül 1200 térfogatrész (0 °C-on) vagy 700 térfogatrész (20 °C-on) egy térfogat vízben.
3.
|
A laboratóriumban |
Az iparban |
|
Az ammónia laboratóriumi előállításához erős lúgokat alkalmaznak az ammóniumsókra: NH 4 Cl + NaOH = NH 3 + NaCl + H 2 O (NH 4) 2 SO 4 + Ca(OH) 2 = 2NH 3 + CaSO 4 + 2H 2 O Figyelem !Az ammónium-hidroxid instabil bázis, lebomlik: NH 4 OH ↔ NH 3 + H 2 O Amikor ammóniát fogad, tartsa a kémcsövet - a vevőt fejjel lefelé, mivel az ammónia könnyebb, mint a levegő: |
Az ammónia előállításának ipari módszere a hidrogén és a nitrogén közvetlen kölcsönhatásán alapul: N 2 (g) + 3H 2 (g) ↔ 2NH 3 (g) + 45,9 k J Feltételek: katalizátor - porózus vas hőmérséklet - 450 - 500 ˚С nyomás - 25 - 30 MPa Ez az úgynevezett Haber-eljárás (német fizikus, kidolgozta a módszer fizikai-kémiai alapjait). |
4. Kémiai tulajdonságok ammónia
Az ammónia esetében a reakciók jellemzőek:
- a nitrogénatom oxidációs állapotának megváltozásával (oxidációs reakciók)
- a nitrogénatom oxidációs állapotának megváltoztatása nélkül (hozzáadás)
|
A nitrogénatom oxidációs állapotának megváltozásával járó reakciók (oxidációs reakciók) N-3 → N 0 → N +2 NH3-erős redukálószer. |
|
oxigénnel 1. Az ammónia égése (fűtött állapotban) 4 NH 3 + 3 O 2 → 2 N 2 + 6 H 2 0 2. Az ammónia katalitikus oxidációja (katalizátorPt – Rh, hőfok) 4NH 3 + 5O 2 → 4NO + 6H 2 O Videó - Kísérlet "Ammónia oxidációja króm-oxid jelenlétében" |
|
fémoxidokkal 2 NH 3 + 3 CuO \u003d 3Cu + N 2 + 3 H 2 O |
|
erős oxidálószerekkel 2 NH 3 + 3 Cl 2 \u003d N 2 + 6 HCl (fűtött állapotban) |
|
Az ammónia törékeny vegyület, hevítés hatására bomlik 2NH 3 ↔ N 2 + 3H 2 |
|
Reakciók a nitrogénatom oxidációs állapotának megváltoztatása nélkül (hozzáadás - Az ammóniumion képződése NH4+a donor-akceptor mechanizmus szerint) Videó – Kísérlet „Minőségi reakció az ammóniára” Videó – „Füst tűz nélkül” kísérlet Videó - Kísérlet "Az ammónia kölcsönhatása koncentrált savakkal" Videó – „Szökőkút” kísérlet Videó - Kísérlet "Az ammónia feloldása vízben" |
5. Ammónia alkalmazása
A termelés mennyiségét tekintve az ammónia az egyik első helyet foglalja el; évente mintegy 100 millió tonnát kapnak ebből a vegyületből világszerte. Az ammóniát folyékony formában vagy vizes oldat formájában állítják elő - ammóniás víz, amely általában 25% NH 3 -ot tartalmaz. A továbbiakban hatalmas mennyiségű ammóniát használnak fel salétromsav előállítására ami arra jár műtrágyagyártásés sok más termék. Az ammóniás vizet közvetlenül műtrágyaként is használják, és néha a földeket tartályokból közvetlenül folyékony ammóniával öntözik. Ammóniából különböző ammóniumsókat, karbamidot, urotropint kapnak. Övé olcsó hűtőközegként is használják ipari hűtőrendszerekben.
Ammóniát is használnak szintetikus szálak előállításához például nylon és capron. NÁL NÉL könnyűiparő pamut, gyapjú és selyem tisztítására és festésére használják. Olajban vegyipar Az ammónia a savas hulladék semlegesítésére szolgál, a természetes gumi gyártásánál pedig az ammónia segít megőrizni a latexet az ültetvényről a gyárba szállítása során. Az ammóniát a szódagyártásban is használják a Solvay-módszerrel. Az acéliparban az ammóniát nitridálására használják - az acél felületi rétegeinek nitrogénnel való telítésére, ami jelentősen növeli a keménységét.
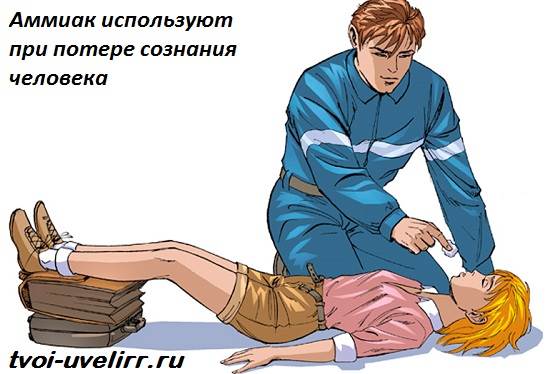
Az orvosok vizes ammóniaoldatokat (ammónia) használnak a mindennapi gyakorlatban: ammóniába mártott vattakorong kihozza az embert az ájulásból. Az emberre az ammónia ilyen dózisban nem veszélyes.
SZIMULÁTOROK
1. számú szimulátor "Az ammónia égése"
Szimulátor №2 "Az ammónia kémiai tulajdonságai"
MEGERŐSÍTÉSI FELADATOK
№1. Hajtsa végre az átalakításokat a séma szerint:
a) Nitrogén → Ammónia → Nitrogén-oxid (II)
b) Ammónium-nitrát → Ammónia → Nitrogén
c) Ammónia → Ammónium-klorid → Ammónia → Ammónium-szulfát
OVR esetén készítsen e-mérleget, RIO esetén teljes, ionos egyenletet.2. sz. Írj fel négy egyenletet! kémiai reakciók ami ammónia képződését eredményezi.
A szirmok zöldre válnak, és - feketévé válnak.
A virágüzletek, mint mondják, tudomásul veszik. Azonban, ammónia más tevékenységi területeken is hasznosak. Megismerjük az anyag többi tulajdonságait, megismerkedünk alkalmazásának módjaival.
Az ammónia tulajdonságai
Amikor ammóniagőzzel dolgozik, legyen óvatos. Egy bizonyos koncentrációnál a reagens levegővel való keveréke robbanásveszélyes.
Ráadásul a gáz mérgező. A vele való "kommunikáció" tele van idegi rendellenességekkel, halláskárosodással, részleges memóriavesztéssel, a lencsék elhomályosodásával. Ezek a tünetek az ammóniagyártásban dolgozó embereknél figyelhetők meg.
Az ammóniagőz mindig felszáll, mert a gáz könnyebb a levegőnél. Az anyag normál körülmények között gáz. Szállítás és értékesítés céljából cseppfolyósított ammónia.
Ehhez kell magas vérnyomás. Szerezzen vízmentes koncentrátumot. Számára 6221-90 GOST van.
Cseppfolyósított ammónia edényekben ennek ellenére gázfázisú. Nyomás alatt mindkét halmazállapot egyensúlyban van.
Ebben az esetben a hőmérsékletnek és a nyomásnak a kritikus alatt kell lennie. Ha több mint 132 fok és 11 megapascal, akkor az egyensúly megbomlik.
Egy anyag térfogati kompressziós együtthatója többszöröse a tágulási együtthatójának.
Ha az edény fel van töltve, a hőmérséklet emelkedése 52 megapascal nyomást eredményezhet.
Ez elegendő a tárolóedény fémvarratainak eltöréséhez. Ennek megfelelően robbanás lesz.
Ammónia koncentrátumból lehet kapni ammónia oldat bármilyen intenzitás. Bár a vízmentes változat is jól jön az emberiségnek.
Például ez az egyik műtrágya. Ezenkívül csak hidrogén van jelen az anyagban. Az utolsó 3 atom, vagyis a gáz képlete a következő: - NH 3.
Ez a hidrogéntartalom az oka az ammónia kiváló vízoldhatóságának. Más gázok nem dicsekedhetnek ezzel.
Erős hidrogénkötések jönnek létre az ammónia és a víz között. Minél telítettebb az oldat, annál nagyobb az oldódási tulajdonságai.
Számukra az anyag versenyez etilalkohol, azzal a különbséggel, hogy az utóbbi szerves eredetű.
Így, vizes ammónia, valamint koncentrátum, alkalmasak az alkáli- és alkáliföldfém-csoportok fémeinek feloldására.
A reakció eredményeként sötétkék folyadékok keletkeznek. Ez a vegyértékelektron ionizáció és szolvatáció eredménye.
Ez utóbbi fogalom elektrosztatikus érintkezést jelöl az oldott fémek molekulái és az ammónia között.
Ammóniából ammónia szaga a semmiből jön elő. A szer ammónium-hidroxid vizes oldata.
vagyis az ammónia az ammónia alkohol. Az ammónium-hidroxid a vizeletben, valamint a szerves bomlástermékekben is megtalálható.
Ezért van például a mocsarak aljáról rothadó tömegek kellemetlen szaga. Lebontják a növények, halak maradványait,.
Ugyanezen tavakban az ammónia természetesen keveredik vízzel. Az oldatban OH csoport van jelen.
Ez azt jelenti, hogy a keverék lúgos reakcióra képes, gyenge bázis. Feloldja a hőst és alkohol. Ammónia nem véletlenül keverve hozzá ammóniába.
Koncentrált formában a hidrogén-nitrid erősen megtöri a fényt, vagyis megváltoztatja sugarainak irányát.
A cikk hősének másik érdekes tulajdonsága a forr nulla alatti hőmérsékletek. 34 körül kell lennie nulla alatt.
Ha a hőmérsékletet 78 fokra csökkenti, a folyadék teljesen megkeményedik. Kiderül, hogy fehéres pelyhek, hasonlóak a hóhoz. az anyagok szabályos, szimmetrikus alakúak.
Ammónia bányászat
Ammónia termelésévi 100 000 000 tonnára csökkentik. Körülbelül ugyanannyi klórt vonnak ki. Ugyanakkor az ammónia kevésbé mérgező.
A megadott ammónia térfogata magában foglalja a természetes nitrogénforrásokból kivont és körülmények között szintetizált anyagot.
Az ipari módszer a hidrogén és a nitrogén. Ammónia közülük 500 Celsius-foknál nem alacsonyabb hőmérsékleten nyerik.
További feltétel: - 350 atmoszféra nyomás. Katalizátor nélkül nem lehet. Felgyorsít egy lassú reakciót anélkül, hogy belemenne.
A katalizátor szerepét általában szivacsos tölti be. A drágább asszisztensek közül az oxidot választják, ill.
A termék végső hozama egyszerű anyagok kölcsönhatása során körülbelül 30-35%.
Ez a maximum, a lehető legalacsonyabb hőmérséklet és legmagasabb nyomás függvényében. Ez a duett biztosítja a reakció hatékonyságát.
Az alacsonyabb hőmérsékleti sávon azonban a folyamat sebessége csökken. Ha felkapcsolod a fűtést, részben maradsz nélkül ammónia de gyorsabban megkapod.
Az ammónia szintetikus előállításának módszere gyakorlatilag nem hagy esélyt a szerves anyagok bomlástermékeiből a természetben történő kinyerésére. Ez a folyamat hosszú.
Ammónia keletkezik, de gyorsan elpárolog. A csapdákba földkéreg gáz ritka.
Általában az ammónia apránként elpárolog, ami a természetes lerakódásokat illikvidé teszi.
Ammónia alkalmazása
Alkalmazás a mezőgazdasági ágazatban használt anyagokról már szó esett. Most pedig térjünk át a szépségiparra, emlékezve kb ammónia a hajhoz.
Itt emlékeztetünk arra, hogy egy anyag oldata gyenge lúg. Ezért a kinevezés: - lúgos Ph-festékek biztosítása, 10 körül.
Az ilyen környezet hozzájárul a haj duzzadásához, ami beindítja a hidrogén-peroxid bomlási reakcióját.
Ez utóbbi egy derítő, ezért szükségszerűen szőke árnyalatokban használják.
Létezik ammóniamentes festék. A gyártók azonban részben ravaszak. Ahelyett tiszta anyag származékait alkalmazzák.
A Ph-t is lúgos szintre emelik, de drágábbak. Ennek megfelelően és ammóniamentes hajfesték költségeket igényel.

A fogyasztók azonban készen állnak rájuk, hogy megmentsék a hajukat. A helyzet az, hogy a tiszta ammónia erősebben nyitja meg a haj pórusait.
Kezdenek hasonlítani egy szivacsra, amelynek felületét csak drága szilikon kozmetikumokkal lehet kisimítani, amelyek kitöltik az üregeket.
Élelmiszerből kifejezett lúg -. Gyártásához is irányított ammónia szintézis.
Nitrogén előállítására is előállítják savak. Ammónia nitrogén-monoxiddá alakul át.
Ez utóbbi oxiddá oxidálódik. Ezután az oxidokat a víz elnyeli. Így kapják meg.
Ammónia formula, mint már említettük, a robbanásveszélyes anyagok létrehozásának hátterében áll.
Az anyagra hűtőberendezések gyártásánál is szükség van. Hatása a párolgáson alapul cseppfolyósított gáz. Ugyanakkor sok hő elnyelődik, ami valójában hűvösséget biztosít.
Az ékszereknél az ammónia is szerepet kapott. A pasztával való polírozás utáni termékek tisztítására szolgál.
Az emberiség ammóniaszükséglete a termelés tendenciáját tükrözi. Még 30 évvel ezelőtt is 70 000 000 tonna reagens keletkezett évente.
Most, ahogy a „Termelés” fejezetben említettük, 100 000 000. Csak a termelés vezetői nem változtak. Ez még mindig az USA, és most is.
Az elmúlt évek kézikönyveiben természetesen megjelenik a Szovjetunió. Hogy az anyag ára megváltozott, és nem kell találgatni. Ismerkedjünk meg az ammónia jelenlegi árcédulájával.
Ammónia ár
vegyél ammóniát lehet nagy- és kiskereskedelmi. A nagy szállításokat általában tonnában hajtják végre.
1000 kilogrammért 19 000 rubelt kérnek. A kisvállalkozások készek kilogrammonkénti eladásra, körülbelül 30 rubelt kérve.
A kiskereskedelemben ritkán kínálnak kilogrammot, tonnát egyáltalán nem. Tanulmányozzuk a gyógyszertárak árlistáját, figyelve az ammóniára.
Általában 40 milliliteres palackokba öntik. Egy ilyen kötet ára 15-31 rubel.
Érdekes módon, ha vannak 25 és 100 milliliteres palackok, akkor körülbelül ugyanannyiba kerülnek, 13 és 55 rubel között.
Ugyanakkor érdemes figyelembe venni, hogy az alkoholos oldat 10 százalékos. A nagykereskedelmi kiszállításoknál a cseppfolyósított ammónia koncentrált.
Ezért az iparosoknak gondolniuk kell az áruk helyes szállítására. Vannak speciális tartányos félpótkocsik.
A tartályok kora nem haladhatja meg a 30 évet. A tartályok összetétele is fontos, mert az ammónia sok fémet felold.
Figyelembe kell venni a tartályban lévő nyomást, a hőmérsékletet is. Ezért a reagens eladási hirdetések mellett rendszerint félpótkocsik eladására és bérlésére vonatkozó ajánlatok is megjelennek. Nem lehet nélkülük.
Folyékony
Ammónia- NH 3, hidrogén-nitrid, normál körülmények között - színtelen gáz, éles jellegzetes szaggal (ammónia szag), majdnem kétszer olyan könnyű, mint a levegő, mérgező. Az NH 3 oldhatósága vízben rendkívül magas - körülbelül 1200 térfogat (0 ° C-on) vagy 700 térfogat (20 ° C-on) egy térfogat vízben. NÁL NÉL hűtés R717-nek hívják, ahol R jelentése hűtőközeg (hűtőközeg), 7 a hűtőközeg típusa (szervetlen vegyület), 17 a molekulatömeg.
Az ammónia molekula trigonális piramis alakú, tetején nitrogénatommal. A nitrogénatom három párosítatlan p-elektronja részt vesz a poláris kovalens kötések kialakításában három hidrogénatom 1s-elektronjaival (N-H kötés), a negyedik külső elektronpár nem megosztott, hidrogénnel donor-akceptor kötést tud kialakítani. ion, ammóniumiont képezve NH 4 + . Tekintettel arra, hogy a nem kötődő kételektronos felhő szigorúan térorientált, az ammónia molekula polaritása nagy, ami jó vízoldhatósághoz vezet.
A folyékony ammóniában a molekulákat hidrogénkötések kötik össze. A folyékony ammónia és a víz fizikai tulajdonságainak összehasonlítása azt mutatja, hogy az ammónia forráspontja alacsonyabb (t bála -33,35 ° C) és olvadáspontja (t pl -77,70 ° C), valamint több. kis sűrűségű, viszkozitás (a folyékony ammónia viszkozitása 7-szer kisebb, mint a víz viszkozitása), vezetőképesség és dielektromos állandó. Ez bizonyos mértékig azzal magyarázható, hogy ezeknek a kötéseknek a szilárdsága a folyékony ammóniában lényegesen kisebb, mint a vízé, és azzal is, hogy az ammónia molekulában csak egy pár megosztatlan elektron van, ellentétben két párral. a vízmolekulában, ami nem teszi lehetővé több molekula között kiterjedt hidrogénkötés-hálózat kialakítását. Az ammónia könnyen átmegy színtelen, 681,4 kg / m³ sűrűségű folyadékká, amely erősen megtöri a fényt. A vízhez hasonlóan a folyékony ammónia is nagymértékben kapcsolódik, főként hidrogénkötések képződésén keresztül. A folyékony ammónia gyakorlatilag nem vezet elektromosság. A folyékony ammónia jó oldószer nagyon egy nagy szám szerves, valamint számos szervetlen vegyület esetében. A szilárd ammónia színtelen köbös kristályok.
Kémiai tulajdonságok
- Egy magányos elektronpár jelenléte miatt az ammónia számos reakcióban nukleofilként vagy komplexképzőként működik. Tehát protont köt, ammóniumiont képezve:
- Az ammónia vizes oldata ("ammónia") enyhén lúgos reakcióba lép az eljárás következtében:
- A savakkal való kölcsönhatás során a megfelelő ammóniumsók keletkeznek:
- Az ammónia is nagyon gyenge sav(10 000 000 000-szer gyengébb, mint a víz), képes sókat képezni fémekkel - amidokkal. Az NH 2 - ionokat tartalmazó vegyületeket amidoknak, NH 2 - imideknek és N 3 - nitrideknek nevezzük. Az alkálifém-amidokat úgy állítják elő, hogy ammóniával hatnak rájuk:
Folyékony ammóniában bizonyos reakciók eredményeként számos fém amidjai, imidjei és nitridjei keletkeznek. A nitrideket fémek nitrogénatmoszférában történő hevítésével lehet előállítani.
A fémamidok a hidroxidok analógjai. Ezt a hasonlatot erősíti az a tény, hogy az OH - és NH 2 - ionok, valamint a H 2 O és NH 3 molekulák izoelektronikusak. Az amidok erősebb bázisok, mint a hidroxidok, ezért vizes oldatokban visszafordíthatatlan hidrolízisen mennek keresztül:
NaNH 2 + H 2 O → NaOH + NH 3 CaNH + 2H 2 O → Ca(OH) 2 + NH 3 Zn 3 N 2 + 6H 2 O → 3Zn(OH) 2 + 2NH 3
és alkoholokban:
KNH 2 + C 2 H 5 OH → C 2 H 5 OK + NH 3
A lúgok vizes oldataihoz hasonlóan az amidok ammóniaoldatai is jól vezetik az elektromos áramot, ami a disszociációnak köszönhető:
MNH 2 → M + + NH 2 -
Ezekben az oldatokban a fenolftalein vörös színűvé válik; savak hozzáadásával semlegesítik. Az amidok oldhatósága a hidroxidok oldhatóságával azonos sorrendben változik: LiNH 2 oldhatatlan, NaNH 2 gyengén oldódik, KNH 2, RbNH 2 és CsNH 2 jól oldódik.
- Melegítéskor az ammónia redukáló tulajdonságokat mutat. Tehát oxigén atmoszférában ég, vizet és nitrogént képezve. Az ammónia levegővel történő oxidációja platina katalizátoron nitrogén-oxidokat eredményez, amelyeket az iparban salétromsav előállítására használnak fel:
Az ammónia NH 4 Cl használata a fémfelület oxidoktól való megtisztítására forrasztásuk során az NH 3 redukáló képességén alapul:
3CuO + 2NH 4 Cl → 3Cu + 3H 2 O + 2HCl + N 2
Az ammóniát nátrium-hipoklorittal zselatin jelenlétében oxidálva hidrazint kapunk:
2NH 3 + NaClO → N 2 H 4 + NaCl + H 2 O
- A halogének (klór, jód) veszélyes robbanóanyagokat képeznek az ammónia - nitrogén-halogenidekkel (nitrogén-klorid, nitrogén-jodid).
- A halogén-alkánokkal az ammónia nukleofil addíciós reakcióba lép, és szubsztituált ammóniumiont képez (egy módszer az aminok előállítására):
- A karbonsavakkal ezek anhidridjei, halogenidjei, észterei és egyéb származékai amidokat adnak. Aldehidekkel és ketonokkal - Schiff-bázisokkal, amelyek a megfelelő aminokká redukálhatók (reduktív aminálás).
- 1000 °C-on az ammónia reakcióba lép a szénnel, HCN képződik, és részben nitrogénre és hidrogénre bomlik. Reagálhat metánnal is, ugyanazt a hidrogén-cianidot képezve:
Névtörténet
Az ammónia (az európai nyelveken a neve úgy hangzik, mint "ammónia") az észak-afrikai Ammon oázisnak köszönheti nevét, amely a karavánutak kereszteződésében található. Meleg éghajlaton az állati hulladékban található karbamid (NH 2) 2 CO különösen gyorsan lebomlik. Az egyik bomlástermék az ammónia. Más források szerint az ammónia az ókori egyiptomi szóról kapta a nevét ammónia. Az úgynevezett emberek, akik Amun istent imádják. Rituális rítusaik során NH 4 Cl-t szippantottak ammóniából, amely hevítés hatására az ammóniát elpárologtatja.
Folyékony ammónia
A folyékony ammónia, bár kis mértékben, de ionokká disszociál, amiben megnyilvánul a vízzel való hasonlósága:
2NH 3 → NH 4 + + NH 2 -
A folyékony ammónia önionizációs állandója -50 °C-on körülbelül 10 -33 (mol/l)².
A folyékony ammónia a vízhez hasonlóan erős ionizáló oldószer, amelyben számos aktív fém oldódik: lúg, alkáliföldfém, Mg, Al, valamint Eu és Yb. Az alkálifémek oldhatósága folyékony NH 3-ban több tíz százalék. A folyékony ammónia NH 3 is old néhány alkálifémet tartalmazó intermetallikus vegyületet, például a Na 4 Pb 9 -et.
A fémek folyékony ammóniában készült híg oldatai beszíneződnek Kék szín, a koncentrált oldatok fémes fényűek és a bronzhoz hasonlóak. Amikor az ammónia elpárolog, alkálifémek szabadulnak fel tiszta forma, és alkáliföldfém - ammóniával alkotott komplexek formájában [E (NH 3) 6] fémes vezetőképességgel. Enyhe melegítés hatására ezek a komplexek fémre és NH 3 -ra bomlanak.
Az NH 3-ban oldott fém fokozatosan amid képződik:
2Na + 2NH3 → 2NaNH2 + H2-
Az ammóniával való reakcióból származó fémamidok tartalmaznak negatív ion NH 2 -, amely szintén az ammónia önionizációja során keletkezik. Így a fémamidok a hidroxidok analógjai. A reakciósebesség növekszik, ha Li-ről Cs-re megyünk. A reakció nagymértékben felgyorsul még kis H 2 O szennyeződések jelenlétében is.
A fém-ammónia oldatok fémes elektromos vezetőképességgel rendelkeznek, bennük a fématomok pozitív ionokká és szolvatált elektronokká bomlanak, amelyeket NH 3 molekulák vesznek körül. A szabad elektronokat tartalmazó fém-ammónia oldatok a legerősebb redukálószerek.
komplexitás
Elektrondonor tulajdonságaik miatt az NH 3 molekulák ligandumként bejuthatnak komplex vegyületekbe. Így a felesleges ammónia bevitele a d-fémek sóinak oldataiba aminokomplexeik képződéséhez vezet:
CuSO 4 + 4NH 3 → SO 4 Ni(NO 3) 2 + 6NH 3 → (NO 3) 2
A komplexáció általában az oldat színének megváltozásával jár együtt, így az első reakcióban a kék szín (CuSO 4) sötétkékké (a komplex színe) változik, a második reakcióban pedig zöldre változik (Ni ( NEM 3) 2) kék-ibolya. Az NH 3-mal alkotott legerősebb komplexek krómot és kobaltot alkotnak +3 oxidációs állapotban.
Biológiai szerep
Az ammónia a nitrogén-anyagcsere végterméke emberekben és állatokban. A fehérjék, aminosavak és egyéb nitrogéntartalmú vegyületek anyagcseréje során keletkezik. Erősen mérgező a szervezetre, ezért az ornitinciklus során az ammónia nagy része a májban ártalmatlanabb és kevésbé mérgező vegyületté - karbamiddá (karbamid) alakul át. A karbamidot ezután a vesék választják ki, és a karbamid egy része a májban vagy a vesékben visszaalakulhat ammóniává.
Az ammóniát a máj a fordított folyamatokhoz, aminosavak ammóniából és aminosav-keto analógokból történő újraszintéziséhez is felhasználhatja. Ezt a folyamatot "reduktív aminálásnak" nevezik. Tehát sóskából ecetsav kiderül, hogy aszparaginsav, α-ketoglutasavból - glutamin stb.
Fiziológiai hatás
A szervezetre gyakorolt élettani hatása szerint a fullasztó és neurotróp hatású anyagok csoportjába tartozik, amelyek belélegezve mérgező tüdőödémát és súlyos idegrendszeri károsodást okozhatnak. Az ammónia helyi és reszorpciós hatással is rendelkezik.
Az ammóniagőz erősen irritálja a szem és a légzőszervek nyálkahártyáját, valamint a bőrt. Ezt szúrós szagként érzékeljük. Az ammóniagőzök erős könnyezést, szemfájdalmat, a kötőhártya és a szaruhártya kémiai égését, látásvesztést, köhögési rohamokat, bőrpírt és viszketést okoznak. Ha a cseppfolyósított ammónia és oldatai érintkeznek a bőrrel, égő érzés lép fel, hólyagokkal és fekélyekkel járó kémiai égés lehetséges. Emellett a cseppfolyósított ammónia a párolgás során hőt vesz fel, és a bőrrel érintkezve különböző mértékű fagyhalál is előfordul. Az ammónia illata 37 mg/m³ koncentrációban érezhető.
Végül megengedett koncentráció levegőben munkaterület termelő helyiségek 20 mg/m³. Ezért ha az ammónia szaga érezhető, akkor már veszélyes védőfelszerelés nélkül dolgozni. A garat irritációja akkor nyilvánul meg, ha a levegő ammóniatartalma 280 mg / m³, a szem - 490 mg / m³. Ha nagyon nagy koncentrációban van kitéve, az ammónia bőrelváltozásokat okoz: 7-14 g/m³ - erythemás, 21 g/m³ vagy több - bullosus dermatitis. Mérgező tüdőödéma alakul ki, ha egy órán át 1,5 g / m³ koncentrációjú ammóniának vannak kitéve. A 3,5 g/m³ vagy annál nagyobb koncentrációjú ammónia rövid távú expozíciója gyorsan általános toxikus hatások kialakulásához vezet. Az ammónia megengedett legnagyobb koncentrációja légköri levegő települések egyenlő: átlagos napi 0,04 mg/m³; maximális egyszeri adag 0,2 mg/m³.
A világon az ammónia maximális koncentrációja a légkörben (több mint 1 mg / m³) az Indo-Gangetikus-síkságon, az USA Közép-völgyében és a Dél-Kazahsztán régióban figyelhető meg.
Alkalmazás
Az ammónia a vegyipar egyik legfontosabb terméke, éves világtermelése eléri a 150 millió tonnát. Főleg nitrogénműtrágyák (ammónium-nitrát és szulfát, karbamid), robbanóanyagok és polimerek, salétromsav, szóda (ammónia módszer) és egyéb vegyi termékek előállítására használják. Oldószerként folyékony ammóniát használnak.
Hűtésben hűtőközegként használják (R717)
Az orvostudományban 10% -os ammóniaoldatot, amelyet gyakran ammóniának neveznek, ájulásra (légzés serkentésére), hányás stimulálására, valamint külsőleg - neuralgia, myositis, rovarcsípés, sebész kezek kezelésére használják. Nál nél helytelen alkalmazás nyelőcső és gyomor égési sérüléseket okozhat (hígítatlan oldat bevétele esetén), reflex légzésleállást (nagy koncentrációban belélegezve).
Alkalmazza helyileg, belélegezve és belül. A légzés serkentése és a beteg ájulástól való megszabadulása érdekében óvatosan vigyen egy kis darab ammóniával megnedvesített gézt vagy vattát a beteg orrához (0,5-1 másodpercig). Belül (csak tenyésztéskor) hánytatásra. Rovarcsípésekkel - krémek formájában; neuralgiával és izomgyulladással - dörzsölés ammónia linimenttel. A sebészeti gyakorlatban meleg forralt vízben tenyésztik, és kezet mosnak.
Mivel ez egy gyenge bázis, kölcsönhatás során semlegesíti a savakat.
Az ammónia élettani hatását az ammónia csípős szagának köszönheti, amely irritálja az orrnyálkahártya specifikus receptorait, és gerjeszti az agy légző- és vazomotoros központjait, ami fokozott légzést és vérnyomás-emelkedést okoz.
Nyugta
Az ammónia előállításának ipari módszere a hidrogén és a nitrogén közvetlen kölcsönhatásán alapul:
N 2 (g) + 3H 2 (g) ↔ 2NH 3 (g) + 45,9 kJ
Ez az úgynevezett Haber-eljárás (német fizikus, kidolgozta a módszer fizikai-kémiai alapjait).
A reakció a hő felszabadulásával és a térfogat csökkenésével megy végbe. Ezért a Le Chatelier-elv alapján a reakciót a alacsony hőmérsékletekés nagy nyomáson - akkor az egyensúly jobbra tolódik el. Alacsony hőmérsékleten azonban a reakciósebesség elhanyagolható, magas hőmérsékleten pedig a fordított reakció sebessége nő. A reakció nagyon magas nyomáson történő végrehajtásához speciális, ellenálló magas nyomású berendezéseket, és ezért nagy beruházást jelent. Ezenkívül a reakció egyensúlya még 700 °C-on is túl lassan jön létre a gyakorlati felhasználáshoz.
Katalizátor (porózus vas Al 2 O 3 és K 2 O szennyeződésekkel) alkalmazása lehetővé tette az egyensúlyi állapot elérésének felgyorsítását. Érdekes módon e szerep katalizátorának keresése során több mint 20 ezer különféle anyagot próbáltak ki.
Az összes fenti tényezőt figyelembe véve az ammónia beszerzésének folyamatát a következő időpontban hajtják végre következő feltételekkel: hőmérséklet 500 °C, nyomás 350 atmoszféra, katalizátor. Az ammónia hozama ilyen körülmények között körülbelül 30%. NÁL NÉL ipari környezet a keringés elvét alkalmazzák - hűtéssel távolítják el az ammóniát, és visszavezetik a reagálatlan nitrogént és hidrogént a szintézis oszlopba. Ez gazdaságosabbnak bizonyul, mint nagyobb reakcióhozam elérése a nyomás növelésével.
Az ammónia laboratóriumi előállításához erős lúgokat alkalmaznak az ammóniumsókra:
NH 4 Cl + NaOH = NH 3 + NaCl + H 2 O.
Általában laboratóriumi úton nyerik, amelyet ammónium-klorid keverékének gyenge hevítésével nyernek oltott mész. 2NH 4 Cl + Ca(OH) 2 = CaCl 2 + 2NH 3 + 2H 2 O
Az ammónia szárításához mész és nátronlúg keverékén engedik át.
Nagyon száraz ammóniát nyerhetünk, ha feloldunk benne fémnátriumot, majd desztilláljuk. Ezt a legjobban egy fémből készült rendszerben lehet megtenni vákuum alatt. A rendszernek képesnek kell lennie ellenállni a nagy nyomásnak szobahőmérséklet nyomás telített gőzök ammónia körülbelül 10 atmoszféra). Az iparban az ammóniát abszorpciós oszlopokon szárítják.
Ammónia az orvostudományban
Rovarcsípés esetén az ammóniát külsőleg kenőcsök formájában alkalmazzák. Lehetséges mellékhatások: Hosszan tartó expozíció (belélegzés) esetén az ammónia reflex légzésleállást okozhat. A helyi alkalmazás ellenjavallt dermatitisz, ekcéma és egyéb esetekben bőrbetegségek, valamint a bőr nyílt traumás sérüléseivel. Inhalációs alkalmazás esetén - reflex légzésleállás, helyi alkalmazás esetén - irritáció, bőrgyulladás, ekcéma az alkalmazás helyén. Helyi alkalmazás csak ép bőrön lehetséges. A szem nyálkahártyájának véletlen sérülése esetén öblítse le vízzel (10 percenként 15 percig) vagy 5%-os oldattal. bórsav. Olajokat és kenőcsöket nem használnak. Az orr és a garat vereségével - 0,5% -os oldat citromsav vagy természetes gyümölcslevek. Lenyelés esetén igyunk vizet, gyümölcslevet, tejet, lehetőleg 0,5%-os citromsavoldatot vagy 1%-os ecetsavoldatot, amíg a gyomor tartalmát teljesen semlegesíti. Interakció másokkal gyógyszerek ismeretlen. (Használati utasítás)
Vízben
- A halogének (klór, jód) veszélyes robbanóanyagokat képeznek az ammónia - nitrogén-halogenidekkel (nitrogén-klorid, nitrogén-jodid).
- A halogén-alkánokkal az ammónia nukleofil addíciós reakcióba lép, és szubsztituált ammóniumiont képez (egy módszer az aminok előállítására):
- Karbonsavakkal ezek anhidridjei, savhalogenidjei, észterei és egyéb származékai amidokat adnak. Aldehidekkel és ketonokkal - Schiff-bázisokkal, amelyek a megfelelő aminokká redukálhatók (reduktív aminálás).
- 1000 °C-on az ammónia reakcióba lép a szénnel, hidrogén-cianid HCN keletkezik, és részben nitrogénre és hidrogénre bomlik. Reagálhat metánnal is, ugyanazt a hidrogén-cianidot képezve:
Névtörténet
Az ammónia (az európai nyelveken a neve úgy hangzik, mint "ammónia") az észak-afrikai Ammon oázisnak köszönheti nevét, amely a karavánutak kereszteződésében található. Meleg éghajlaton az állati hulladékban található karbamid (NH 2) 2 CO különösen gyorsan lebomlik. Az egyik bomlástermék az ammónia. Más források szerint az ammónia az ókori egyiptomi szóról kapta a nevét ammónia. Az úgynevezett emberek, akik Amun istent imádják. Rituális rítusaik során NH 4 Cl-t szippantottak ammóniából, amely hevítés hatására az ammóniát elpárologtatja.
Folyékony ammónia
A folyékony ammónia, bár kis mértékben, de ionokká disszociál (autoprotolízis), amiben megnyilvánul a vízzel való hasonlósága:
A folyékony ammónia önionizációs állandója -50 °C-on körülbelül 10 -33 (mol/l)².
Az ammóniával való reakcióból származó fémamidok tartalmazzák a negatív NH 2 − iont, amely szintén az ammónia önionizációja során keletkezik. Így a fémamidok a hidroxidok analógjai. A reakciósebesség növekszik, ha Li-ről Cs-re megyünk. A reakció nagymértékben felgyorsul még kis H 2 O szennyeződések jelenlétében is.
A fém-ammónia oldatok fémes elektromos vezetőképességgel rendelkeznek, bennük a fématomok pozitív ionokká és szolvatált elektronokká bomlanak, amelyeket NH 3 molekulák vesznek körül. A szabad elektronokat tartalmazó fém-ammónia oldatok a legerősebb redukálószerek.
komplexitás
Elektrondonor tulajdonságaik miatt az NH 3 molekulák ligandumként bejuthatnak komplex vegyületekbe. Így a felesleges ammónia bevitele a d-fémek sóinak oldataiba aminokomplexeik képződéséhez vezet:
A komplexitás általában az oldat színének megváltozásával jár. Tehát az első reakcióban a kék szín (CuSO 4) sötétkékké (a komplex színe) változik, a második reakcióban pedig a szín zöldről (Ni (NO 3) 2) kékeslilára változik. Az NH 3-mal alkotott legerősebb komplexek krómot és kobaltot alkotnak +3 oxidációs állapotban.
Biológiai szerep
Az ammónia a nitrogén-anyagcsere végterméke emberekben és állatokban. A fehérjék, aminosavak és más nitrogéntartalmú vegyületek anyagcseréje során képződik. Erősen mérgező a szervezetre, ezért az ornitinciklus során az ammónia nagy része a májban ártalmatlanabb és kevésbé mérgező vegyületté - karbamiddá (karbamid) alakul át. A karbamidot ezután a vesék választják ki, és a karbamid egy része a májban vagy a vesékben visszaalakulhat ammóniává.
Az ammóniát a máj fordított folyamatban is felhasználhatja - aminosavak ammóniából való újraszintézisére és aminosavak keto-analógjaira. Ezt a folyamatot "reduktív aminálásnak" nevezik. Így az aszparaginsavat az oxálecetsavból, a glutaminsavat az α-ketoglutársavból stb.
Fiziológiai hatás
A szervezetre gyakorolt élettani hatása szerint a fullasztó és neurotróp hatású anyagok csoportjába tartozik, amelyek belélegezve mérgező tüdőödémát és súlyos idegrendszeri károsodást okozhatnak. Az ammónia helyi és reszorpciós hatással is rendelkezik.
Az ammóniagőz erősen irritálja a szem és a légzőszervek nyálkahártyáját, valamint a bőrt. Ez egy személy, és szúrós szagként érzékeli. Az ammóniagőzök erős könnyezést, szemfájdalmat, a kötőhártya és a szaruhártya kémiai égését, látásvesztést, köhögési rohamokat, bőrpírt és viszketést okoznak. Ha a cseppfolyósított ammónia és oldatai érintkeznek a bőrrel, égő érzés lép fel, hólyagokkal és fekélyekkel járó kémiai égés lehetséges. Emellett a cseppfolyósított ammónia a párolgás során hőt vesz fel, és a bőrrel érintkezve különböző mértékű fagyhalál is előfordul. Az ammónia illata 37 mg/m³ koncentrációban érezhető.
Alkalmazás
Az ammónia a vegyipar egyik legfontosabb terméke, éves világtermelése eléri a 150 millió tonnát. Főleg nitrogénműtrágyák (ammónium-nitrát és szulfát, karbamid), robbanóanyagok és polimerek, salétromsav, szóda (ammónia módszer) és egyéb vegyi termékek előállítására használják. Oldószerként folyékony ammóniát használnak.
Felhasználási arányok tonnánként ammóniára
Egy tonna ammónia előállítása Oroszországban átlagosan 1200 nm³-t fogyaszt földgáz, Európában - 900 nm³.
A fehérorosz "Grodno Azot" egy tonna ammóniára 1200 Nm³ földgázt fogyaszt, a modernizációt követően a fogyasztás várhatóan 876 Nm³-re csökken.
Az ukrán termelők 750–1170 Nm³ földgázt fogyasztanak tonnánként ammóniánként.
Az UHDE technológia 6,7-7,4 Gcal energiaforrást fogyaszt egy tonna ammóniára.
Ammónia az orvostudományban
Rovarcsípés esetén az ammóniát külsőleg kenőcsök formájában alkalmazzák. A 10%-os vizes ammóniaoldatot ammóniának nevezik.
Lehetséges mellékhatások: hosszan tartó expozíció (belélegzés) esetén az ammónia reflex légzésleállást okozhat.
A helyi alkalmazás ellenjavallt dermatitisz, ekcéma, egyéb bőrbetegségek, valamint a bőr nyílt traumás sérülései esetén.
A szem nyálkahártyájának véletlen károsodása esetén öblítse le vízzel (10 percenként 15 percig) vagy 5%-os bórsavoldattal. Olajokat és kenőcsöket nem használnak. Az orr és a garat vereségével - 0,5% -os citromsav oldat vagy természetes gyümölcslevek. Lenyelés esetén igyunk vizet, gyümölcslevet, tejet, lehetőleg 0,5%-os citromsavoldatot vagy 1%-os ecetsavoldatot, amíg a gyomor tartalmát teljesen semlegesíti.
Más gyógyszerekkel való kölcsönhatás nem ismert.
Ammóniagyártók
Ammóniagyártók Oroszországban
| Vállalat | 2006, ezer tonna | 2007, ezer tonna |
|---|---|---|
| JSC "Togliattiazot"]] | 2 635 | 2 403,3 |
| OAO NAK Azot | 1 526 | 1 514,8 |
| JSC "Akron" | 1 526 | 1 114,2 |
| OAO Nevinnomyssky Azot, Nevinnomyssk | 1 065 | 1 087,2 |
| Minudobreniya JSC (Rossosh) | 959 | 986,2 |
| JSC "AZOT" | 854 | 957,3 |
| OJSC "Azot" | 869 | 920,1 |
| OJSC "Kirovo-Chepetsky Khim. kombájn" | 956 | 881,1 |
| OJSC Cherepovets Azot | 936,1 | 790,6 |
| ZAO Kuibyshevazot | 506 | 570,4 |
| Gazprom Salavat neftekhim" | 492 | 512,8 |
| "Ásványi műtrágyák" (Perm) | 437 | 474,6 |
| OJSC Dorogobuzh | 444 | 473,9 |
| OAO Voskresensk ásványi műtrágyák | 175 | 205,3 |
| OJSC Shchekinoazot | 58 | 61,1 |
| OOO MendeleevskAzot | - | - |
| Teljes | 13 321,1 | 12 952,9 |
Oroszország a világ ammóniatermelésének körülbelül 9%-át adja. Oroszország a világ egyik legnagyobb ammónia exportőre. A teljes ammóniatermelés mintegy 25%-át exportálják, ami a világ exportjának mintegy 16%-a.
Ammóniagyártók Ukrajnában
- A Jupiter felhői ammóniából állnak.
Lásd még
Megjegyzések
Linkek
- //
- // Brockhaus és Efron enciklopédikus szótára: 86 kötetben (82 kötet és további 4 kötet). - Szentpétervár. , 1890-1907.
- // Brockhaus és Efron enciklopédikus szótára: 86 kötetben (82 kötet és további 4 kötet). - Szentpétervár. , 1890-1907.
ammónia. Ennek a gáznak a molekulái piramis alakúak, amelynek egyik csúcsán egy nitrogénatom található. Hidrogénkötések révén jönnek létre, és erős polaritás jellemzi őket. Ez magyarázza az ammónia szokatlan fizikai tulajdonságait: olvadáspontja körülbelül -80 fok. Vízben, alkoholokban és egyéb anyagokban jól oldódik szerves oldószerek.
Ammónia alkalmazása
Ammónia játszik fontos szerep az iparban. Segítségével kap nitrogén műtrágyák ben jelentkezett mezőgazdaság, salétromsavat és még robbanóanyagokat is. Az orvosok által széles körben használt ammóniát is ammóniából állítják elő. Ennek a gáznak a csípős illata irritálja az orrnyálkahártyát és serkenti a légzésfunkciókat. Ammóniaájulásra vagy alkoholmérgezésre használják. Az ammónia külső felhasználása is létezik az orvostudományban. Kiváló fertőtlenítőszer, mellyel a sebészek műtétek előtt kezelik a kezüket.
Az ammóniát, mint az ammónia bomlástermékét, a fémek forrasztásánál használják. Nál nél magas hőmérsékletű az ammóniát ammóniából nyerik, amely megvédi a fémet az oxidfilm képződésétől.
Ammónia mérgezés
Az ammónia mérgező anyag. A munkahelyen gyakran előfordul ezzel a gázzal való mérgezés, amelyet fulladás, delírium és erős izgalom kísér. Hogyan segíthet valakinek, aki ilyen helyzetben van? Először vízzel kell öblíteni a szemét, és fel kell helyezni egy gyenge citromsavoldattal megnedvesített gézkötést. Ezután el kell távolítani abból a zónából, ahol magas ammóniakoncentráció figyelhető meg. A mérgezés körülbelül 350 mg/m³ koncentrációban lehetséges.
Ha ammónia kerül a bőrre, azonnal mossa le vízzel az érintett területeket. A bőrön lévő ammónia mennyiségétől függően előfordulhat súlyos bőrpír vagy kémiai égési sérülések hólyagokkal.
Súlyos intézkedéseket vezettek be az ammóniát előállító üzemekben tűzbiztonság. Az a tény, hogy az ammónia és a levegő keveréke nagyon gyúlékony. Azok a tárolóedények, ahol tárolják, melegítés hatására könnyen felrobbanhatnak.
Az ammónia kémiai tulajdonságai
Az ammónia sok savval reagál. Ennek a kölcsönhatásnak az eredményeként különböző ammóniumsók keletkeznek. Többbázisú savakkal való reagáltatáskor kétféle sót kapunk (az ammónia móljainak számától függően).
