Ktoré zlúčeniny reagujú s vodou. Úloha vody v chemických procesoch
Goliková Oľga
Prezentácia odráža fyzikálne vlastnosti vody; je uvedená klasifikácia látok podľa ich rozpustnosti vo vode; stanovenie vodných roztokov a elektrolytov. Uvádzajú sa hlavné ustanovenia teórie elektrolytickej disociácie (TED). Sú uvedené definície kyselín, zásad a solí z pozície TED Úloha vody je znázornená ako vozidlo a ako účastník chemických reakcií
Stiahnuť ▼:
Náhľad:
Ak chcete použiť ukážku prezentácií, vytvorte si Google účet (účet) a prihláste sa: https://accounts.google.com
Popisy snímok:
Vyplnila žiačka 11. ročníka Goliková Oľga Prezentácia z chémie na tému: Úloha vody v chemické reakcie
Voda je najbežnejším rozpúšťadlom na Zemi a do značnej miery určuje povahu pozemskej chémie ako vedy. Väčšina chémie sa pri svojom vzniku ako vedy začala presne ako chémia vodných roztokov látok. Systematický názov: oxid vodíka Tradičné názvy: voda Chemický vzorec: H20 Molárna hmota: 18,01528 g/mol
Voda je bezfarebná kvapalina bez zápachu a chuti, t bp = 100 °C, t pl = 0 °C, p = 1 g/cm3 (pri 4 °C). Voda nevedie elektriny zlý vodič tepla, špecifické teplo voda je veľmi vysoká. Voda je jediná látka, ktorá sa pri stuhnutí zmršťuje. Preto je hustota ľadu menšia ako hustota tekutej vody. To je dôvod, prečo ľad pláva na hladine vody. Voda
Voda je jedinečná Chemická látka, ktorého úlohu v chemických reakciách je ťažké preceňovať voda Reakčné médium Disociačný faktor Transport látky činidlo katalyzátor
Prebieha veľké množstvo chemických reakcií vodné prostredie. Rozpustnosťou vo vode sa všetky látky podmienečne delia do troch skupín Rozpustnosť látok vo vode
Ide o homogénne systémy pozostávajúce z molekúl vody, častíc rozpustenej látky a produktov ich vzájomného pôsobenia.Hydratačný proces je výsledkom interakcie vody s molekulami rozpustenej látky Vodné roztoky -
Látky, ktoré sa v roztokoch rozkladajú na ióny, disociujú. Pomer počtu mólov látky rozloženej na ióny k celkovému množstvu rozpustenej látky sa nazýva stupeň elektrolytickej disociácie Všetky elektrolyty sa delia na: - silné (stupeň disociácie má tendenciu k jednote) - slabé (disociujú veľmi mierne v roztokoch) Elektrolyty
Svante August Arrhenius (1859-1927) švédsky chemik a fyzik. V roku 1887 konečne sformuloval teóriu elektrolytickej disociácie, v roku 1887 vysvetlil odchýlku roztokov elektrolytov od Van't Hoffových zákonov a Raoultovho zákona (ukázal fyzický význam korekčný faktor i). Vytvoril teóriu izohydricity, rozvinul teóriu hydrolýzy solí. Stanovil exotermickú povahu väčšiny procesov disociácie elektrolytov a závislosť rýchlosti a úplnosti týchto procesov od teploty. Teória elektrolytickej disociácie
Kyseliny sú elektrolyty, ktoré sa disociujú na vodíkové katióny a anióny zvyšku kyseliny; Zásady sú elektrolyty, ktoré sa disociujú na kovové (amónne alebo organické zásadité) katióny a hydroxidové anióny Soli sú elektrolyty, ktoré sa disociujú na kovové (amónne alebo organické zásadité) katióny a anióny zvyškov kyselín Tri typy elektrolytov
Všetky tekuté médiá sú z viac ako 90-98 % voda; Krv prenáša kyslík po celom tele živiny, hormóny a iné zlúčeniny, pri odstraňovaní oxid uhličitý a produkty rozkladu Úloha vody ako dopravného prostriedku
Hydratačná reakcia (adičná reakcia) hydratačná reakcia acetylénových zlúčenín za vzniku karbonylových zlúčenín. Pri hydratácii acetylénu vzniká acetaldehyd, v prípade substituovaných acetylénov hlavne ketóny Voda ako účastník chemických reakcií
Je zdrojom čistého vodíka a kyslíka. Interakcia vodíka a kyslíka slúži ako reakcia, ktorá vám umožní dostať sa na obežnú dráhu vesmírne lode Voda sa podieľa na procesoch elektrolýzy
Ďakujem za tvoju pozornosť
1. Aká je štruktúra molekuly vody? Aké sú jeho fyzikálne vlastnosti?
2. Rozšíriť integrujúcu úlohu vody v prírodných vedách – medzi chémiu, biológiu, fyziku a geografiu. Dá sa to celkom v plnej miere urobiť bez štruktúrovania a aktualizácie integračných problémov? 
3. Hovorte o úlohe vody v riešení ekonomické problémy spoločnosti. 
4. Otvorte globálny problémľudskosť je problém sladká voda na Zemi a ponúknuť spôsob, ako to vyriešiť. 
5. Povedzte nám o úlohe vody v chemických reakciách. 
6. Dokážte, že disociácia elektrolytu je výsledkom procesu hydratácie. Akú úlohu zohrali ruskí chemici pri štúdiu tejto strany teórie elektrolytickej disociácie? 
7. Aký je stupeň elektrolytickej disociácie? Do akých skupín sa delia elektrolyty podľa stupňa elektrolytickej disociácie? Uveďte príklady zástupcov každej skupiny. 
8. Uveďte chemické vlastnosti vody. Ktoré z týchto vlastností sú praktické? 
9. Čo sú to kryštalické hydráty? Aký proces je základom nanášania sadrových odliatkov alebo výroby alabastrových kusov? 
10. Napíšte reakčné rovnice, pomocou ktorých môžete vykonať nasledujúce transformácie: 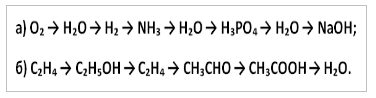
MBOU "Stredná škola Molodkovskaja"
Okres Mglinsky, región Bryansk
Učiteľ chémie: Shtyrhunova Tatyana Alexandrovna
Zhrnutie lekcie chémie v 11. ročníku na tému: "Úloha vody v chemických reakciách."
Účel lekcie: Systematizovať vedomosti o zložení, štruktúre, vlastnostiach vody, význame, bytí príroda, problémy sladkej vody.
Ciele lekcie: 1. Zvážte rôznych oblastiachúloha vody v chemických reakciách.
2. Rozvíjať logické myslenie, schopnosť získavať informácie z rôznych zdrojov.Vštepovať schopnosti sebaorganizácie a sebaúcty.
3. Vzdelávať žiakov vo vzťahu k vode ako k nenahraditeľnej látke v živote všetkých živých organizmov.
Typ lekcie: Kombinovaná lekcia.
Použité vybavenie:počítač, multimediálny projektor, karty, tabuľka rozpustnosti, množstvo aktívnych kovov.
Použité COR:počítačová prezentácia.
Formované chemické vedomosti, schopnosti, zručnosti žiakov: systematizácia vedomostí žiakov o rozšírenosti vody v prírode, fyzikálnych a chemické vlastnosti, oblasti aplikácie vody, rozšírenie vedomostí žiakov o úlohe vody, o otázky životného prostredia sladkej vody.
Formované kompetencie:
vzdelávacie a kognitívne kompetencie: rozvoj schopností porovnávať, analyzovať, dokazovať, vedieť riešiť tieto životne dôležité praktické úlohy: schopnosť hodnotiť stav životné prostredie prezentujúc svoje nápady na ochranu vodných zdrojov ich rodnej krajiny;informačná kompetencia: rozvoj schopnosti analyzovať a vyberať potrebné informácie, schopnosť pripravovať a vytvárať správy, schopnosť používať internet na vyhľadávanie vzdelávacích informácií.
Počas vyučovania.
1. Organizačný moment.
Kontrola d.z.
Odpovedajú na množstvo otázok na tému: Reverzibilné a nevratné reakcie Chemická rovnováha.
2. Úvodný prejav učiteľa.
učiteľ. Chlapci, v dnešnej lekcii sa zoznámime s úžasnou látkou, jej fyzikálne vlastnosti, anomálie, bytie v prírode, hodnoty a prírodné rezervácie. Pozývam vás na výlet do Krajiny zázračných premien a našu lekciu viesť pod mottom „Radosť vidieť a porozumieť je najväčším darom prírody.“ (A. Einstein) S akým obyvateľom tejto krajiny sa dnes stretneme?
Snímka 1. Čítal som báseň o vode.
O akej látke sa teda bude diskutovať v lekcii?
Formulujem tému hodiny, uvádzam účel hodiny.
„Voda... Nemáš chuť, farbu, vôňu, nedá sa opísať – bavíš sa bez toho, aby si vedel, čo si.
Nie si len potrebný pre život, si život sám. Si boh, si dokonalosť, sinajväčšie bohatstvo na svete"
Tieto slová o vode napísal francúzsky spisovateľAntoine de Saint-Exupéry.
A naša lekcia je venovanánajznámejší a zároveň najzáhadnejšílátka je voda.
Tému hodiny si zapisujeme do zošitov: « Úloha vody v chemických reakciách.
Úvodné slovo učiteľa o vode:
Voda je známa a nepochopiteľná, úžasná, paradoxná, tajomná, nepredvídateľná. Neexistuje množstvo epitet, ktoré by mohli plne charakterizovať túto jedinečnú látku. Bola a zostáva múzou, zdrojom inšpirácie pre básnikov, umelcov, skladateľov, vedcov, ktorí dlhé roky odhaľujú tajomstvá tohto veľkého výtvoru prírody a neprestávajú žasnúť nad tým, čo sa dozvedia.
Zoznámenie sa so snímkami“ 2-6.
učiteľ. Z kurzu geografie viete, že voda je najbežnejšou látkou na Zemi.
Správa 1. "Voda na Zemi"
Voda je najdôležitejšia, najdôležitejšia látka vo svete okolo nás. Je to známe aj neznáme, známe a tajomné ... Prírodná voda! Pozrite sa na oblohu a uvidíte mraky alebo mraky, ktoré sa tiahnu na míle ďaleko. Ako ľahko plávajú! Ale nepredstavujte si, že sú bez tiaže. Hmotnosť 1 km3 oblakov je asi 2000 ton a vodnej pary v zemskej atmosfére je asi 12300 km3, a to je tiež prírodná voda. Každý pozná prúdpozemné toky: potoky, riečky, rieky. Niekedy sa rozprestierajú široko a voľne po rovine, niekedy tvoria mohutné pereje, padajú z výšky desiatok a stoviek metrov vo vodopádoch a odnášajú svoje vody do oceánov a morí. Asi 71 % povrchu našej Zeme pokrýva Svetový oceán, čo predstavuje asi 97 % zo všetkého povrchová voda a polovica litosféry.
Toľko alebo málo vody na Zemi? Veľmi malý! Voda tvorí asi 2,5 miliardy km3 z celkového objemu Zeme.
Vodný obal Zeme má 1,5 miliardy km3 a zvyšok je v hlbokých vrstvách zemská kôra. Väčšina vody je slaná, a obývateľná, sladká, len asi 5 miliónov km3. Každý rok človek potrebuje viac a viac sladkej vody, čistá voda. Ľudstvo ohrozuje kríza v dôsledku znečistenia vôd. Niektoré krajiny už teraz pociťujú nedostatok čistej sladkej vody a sú nútené dovážať ju zo zahraničia. Voda musí byť chránená.
učiteľ. Z vášho kurzu biológie viete, že voda je neoddeliteľne spojená s existenciou života na Zemi.
Koľko vody je v ľudskom tele?(65%- 75%)
Vedeli ste, že mozog obsahuje80% vody.6 snímka.
Posolstvo 3. "Voda v živom organizme"
Všetko živé na našej planéte tvoria 2/3 vody. Z hľadiska obsahu vody v živom organizme sú na prvom mieste podľa hmotnosti mikroorganizmy, na druhom rastliny, na treťom živočíchy a na poslednom sú ľudia.
Baktérie tvoria 81% vody, 50% spóry, živočíšne tkanivo priemerne 70%, lymfa 90%. Na vodu najbohatšie tkanivo je sklovec oka, ktorý obsahuje až 99 % vlhkosti.
Voda v tele plní niekoľko funkcií: látky v nej rozpustené navzájom reagujú, voda pomáha odstraňovať metabolické splodiny, slúži ako regulátor teploty, je dobrým nosičom tepla a tiež ako lubrikant.
V živých organizmoch môže byť voda syntetizovaná v tkanivách. Takže napríklad u ťavy sa tuk v hrbe, zoxidovaný, môže vzdať až40 litrov vody. Človek, ktorý vypije 2,5 litra vody denne, prepláchne žalúdok 10 litrami tekutiny a odparí 0,7 litra vody.
2 .Štruktúra molekuly vody afyzikálne vlastnosti (7 snímok a 8).
(predná anketa)
Snímka 9. Nájdite chemické chyby v texte (prácu robíme frontálne).
Učiteľ: Vaše odpovede ukázali, že ste pripravený na ďalšiu cestu.
Áno, úloha vody v chemických reakciách je mnohostranná. Snímka 11.
12. Voda je reakčné médium.
Voda je najlepšie rozpúšťadlo na svete, rozpúšťa veľa pevných, tekutých a plynné látky. Voda morí a oceánov obsahuje takmer všetky prvky periodický systém, miliardy ton kovových rúd. oceánska voda Preto ju nazývajú „tekutá ruda“, získava sa z nej sodík, chlór, zlato, urán a rôzne soli.Táto vlastnosť vody má pre prírodu veľký význam, takmer všetky chemické premeny na Zemi, vrátane tých v živých organizmoch, prebiehajú vo vode, v jej prítomnosti alebo za jej účasti.
Vďaka vysokej polarite molekúl je voda schopná rozpúšťať mnohé látky s iónovými a kovalentnými polárnymi väzbami.
Vo vzťahu k vode sa látky delia na:
1) rozpustný2) nerozpustný3) ťažko rozpustné sklíčko 13.
Zvážte tabuľku rozpustnosti látok.
Pomocou tabuľky rozpustnostinapíš príklady na tabuľu.
Ba(OH)2,KCl,BaSO4, CaSO4,NaNO3, CuSO4, HNO3, AgCl,FeS, Ca(OH)2
Snímka 14. Voda je disociačný faktor.
Sklíčko 15. Vodný katalyzátor.
Pamätajte, čo je katalyzátor?
Snímka 16. Voda je prenášačom látok.
Správa.
Doslova každý proces v tele prebieha pomocou vody. Každá bunka je nasýtená vodou, každá chemická reakcia prebieha pomocou vody. To zahŕňa chemické reakcie, ktoré prebiehajú vo vašom tele a ktoré produkujú energiu, čo vám pomáha zostať aktívny a mať efektívny metabolizmus. Keďže voda je zložkou krvi, ktorá zásobuje vaše telo živinami, v krvi musí byť dostatok vody na dodanie živín do každej bunky. Nedostatok vody spomaľuje metabolizmus.
Snímka 17. Voda je činidlo Spomeňme si, s čím voda reaguje?
Voda je jednou z najreaktívnejších látok.
Študent: Z preberaného materiálu vieme, že oxidy, hydridy, alkalické kovy interagujú s vodou... a inými látkami (nazývanými ich)
Odpovedajú na množstvo otázok.
Čo vzniká, keď zásaditý oxid reaguje s vodou? kyslý oxid?.....
Zapíšte si reakčné rovnice do zošita.
Kontrola nad asimiláciou učebného materiálu.
Učiteľ: Tak sme sa plavili na konečnú stanicu Urobme si niekoľko úloh.
Snímka 19. S akými látkami reaguje voda? Zapíšte si reakčné rovnice.(Pracujte vo dvojiciach) Potom skontrolujeme zadanie.
Snímka 18. Uveďte úlohu vody v uvedených procesoch.
Napíšte do zošita a potom skontrolujte.
Snímka 20. O čom v otázke v tejto pasáži? Akú úlohu hrá voda?
Zhrnutie lekcie Snímka 21. Christina číta verš o vode.
Záver: Čo je voda?
Snímka 22. Šetrite vodou.
učiteľ : Pamätajte, že zásoby čistej vody sa neustále vyčerpávajú amusíme šetriť vodou.
10. Reflexia.
Na stoloch žiakov sú tri farebné kartičky, pomocou ktorých vyhodnotíme hodinu.
Modrá karta - "3", žltá karta - "4", červená karta - "5".
Ako by ste zhodnotili svoje vedomosti získané v dnešnej lekcii?
Ako hodnotíte prácu svojich spolužiakov na hodine?
Ako hodnotíte lekciu ako celok?
Hodnotenie lekcie.
11. Domáca úloha: odsek 17, č.3,4,5.
