Milyen szervetlen anyagokat tartalmaz a készítmény. szervetlen anyagok
Miután megismertük az élő szervezetekben található kémiai elemeket, térjünk át azon anyagok tanulmányozására, amelyekben ezek az elemek szerepelnek. Köztük szervetlen (víz, ásványi sók és savak) ill szerves vegyületek(1. ábra). Az élő szervezetek tömegének nagy része vizet tartalmaz.
Víz. Az élő szervezetek víztartalma tömegük 60-75%-a, egyeseknél, mint például a medúza, akár 98%-a is. levelekben és lédús gyümölcsök a növények víztartalma a 98%-ot is elérheti.
A víz mennyisége nem azonos különböző szövetekés szervek. Tehát egy emberben az agy szürkeállományában annak tartalma 85%, a csontszövetben pedig 22%. A szervezet legmagasabb víztartalma az embrionális időszakban figyelhető meg (95%), és az életkorral fokozatosan csökken. Víz használata nélkül egy személy legfeljebb 5-7 napig élhet.
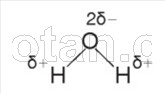
Amint azt egy kémiatanfolyamból már tudja, a vízmolekula (H 2 0) két hidrogénatomból áll, amelyeket kovalens poláris kötések kötnek össze egy oxigénatommal.
A H–O–H kötések 104,5°-os szöget zárnak be egymással. Az oxigén elektronegativitása nagyobb, mint a hidrogéné, ezért az oxigénatom vonzza a közös elektronpárokat, és részlegesen negatív töltést kap. A hidrogénatomok részben pozitív töltést kapnak, azaz a vízmolekula az poláris.
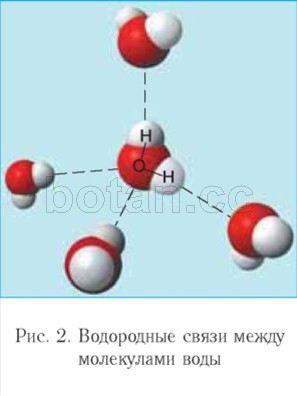
Elektrosztatikus vonzás jön létre az egyik vízmolekula oxigénatomja és egy másik molekula hidrogénatomja között. Egy ilyen interakció
ionos kötésnél gyengébb ún hidrogén kötés. Minden vízmolekula, mint egy kis mágnes, a hidrogénkötések kialakulása miatt további négy molekulát vonz magához (2. ábra). A hidrogénkötések kialakulásának köszönhetően a vízmolekulák egymáshoz kapcsolódnak. Ezért a 0 ° C és 100 ° C közötti hőmérsékletű víz visszatarthatja a folyadékot az összesítés állapota, míg a hasonló hidrogénvegyületek (például H 2 S, NH 3, HF) gázok.
A víz biológiai szerepe az élő szervezetekben annak tulajdonságaival, elsősorban a molekulák kis méretével, polaritásával, valamint egymással és más vegyületekkel hidrogénkötések kialakítására való képességével függ össze.
Ez a víz határozza meg a sejtek térfogatát és az intracelluláris (turgor) nyomás. A vízmolekulák polaritásuk miatt úgynevezett hidratációs héjakat képesek kialakítani az ionok és a poláris molekulák körül. Ez hozzájárul a részecskék szétválásához, és megakadályozza azok összetapadását, ami különösen fontos például a fehérjemolekulák esetében.
A molekulák polaritása és a hidrogénkötések kialakításának képessége vizet képez univerzális oldószer poláris anyagokhoz, jobb, mint a legtöbb ismert folyadék. A vízben való oldhatóságtól függően a vegyületeket hagyományosan oldható, ill hidrofil(görögből. kalauz- víz, fshsha- szerelem), és oldhatatlan, ill hidrofób(görögből. phobos- félelem). Hidrofil anyagok a mono- és diszacharidok, sok ásványi só és sav, rövid szénláncú alkoholok, rövid szénláncú karbonsavak stb.. A magasabb karbonsavak, zsírok és néhány más anyag hidrofób.
A víz sokak áramlásának közege anyagcsere folyamatok. Többség kémiai reakciók a szervezetben pontosan vizes oldatokban fordul elő. Az anyagok be- és kilépése a sejtből általában oldott formában történik. A víz közvetlenül részt vesz a sejtekben végbemenő számos kémiai reakcióban, beleértve a szerves vegyületek felhasadási folyamatait is. A fotoszintézis reakcióinak egyik kiindulási anyaga. A fotoszintézis során keletkező oxigén a vízmolekulák lebomlásakor szabadul fel.
A víz, mint oldószer részt vesz az ozmózis jelenségeiben, a játékban fontos szerep a testsejtek aktivitásában. Ozmózis- ez a vízmolekulák mozgása egy féligáteresztő membránon keresztül (például egy sejt citoplazmatikus membránján) egy alacsonyabb koncentrációjú oldott anyag (például sók, cukrok vagy karbamid) területről egy nagyobb koncentrációjú területre. ezekből az anyagokból (3. ábra). Az ozmózis hatására a sejtben és az extracelluláris közegben az oldott anyagok koncentrációja kiegyenlítődik.
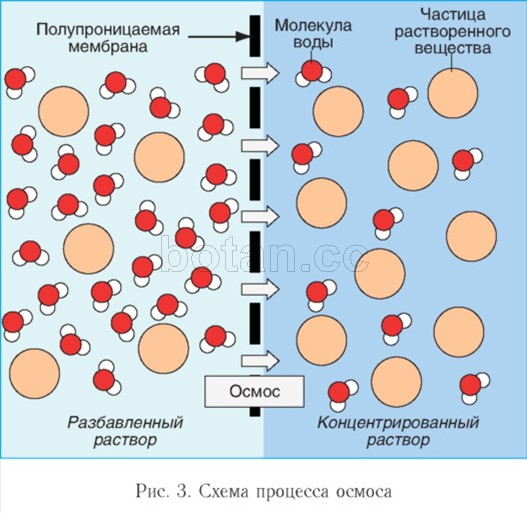
Ha az oldatot és az oldószert (például vizet) szelektíven áteresztő membrán választja el, akkor az oldószermolekulák a membránon keresztül az oldatba jutnak. Az oldószer bejutásának megakadályozása érdekében az oldatra bizonyos nyomást kell alkalmazni, amit ozmotikus nyomásnak nevezünk. Minél töményebb az oldat, annál nagyobb az ozmotikus nyomása.
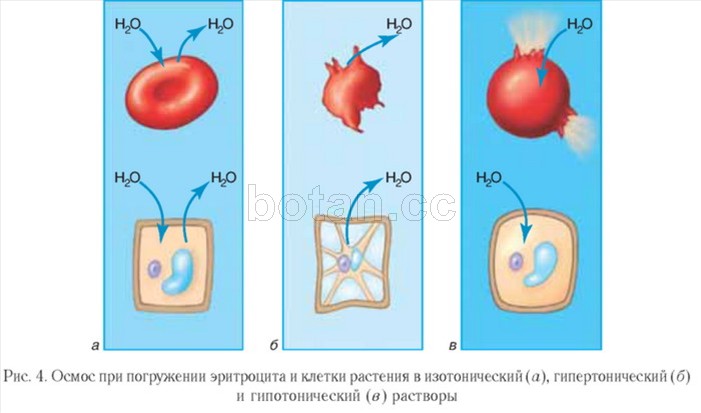
Azokat az oldatokat, amelyek ozmotikus nyomása megegyezik a sejtekben lévővel, izotóniásnak nevezzük. Az izotóniás oldatokba mártott sejtek térfogata változatlan marad (4. ábra, a) Az izotóniás oldatokat, különösen a fiziológiás sóoldatot (0,9%-os tömeghányados NaCl vizes oldatát) használják az orvostudományban. Súlyos kiszáradásra és vérveszteségre használják a betegek, oldásra gyógyszerek injekcióval adják be.
Az olyan oldatot, amelynek ozmotikus nyomása magasabb, mint a sejtekben, hipertóniásnak nevezzük. A hipertóniás oldatba mártott sejtek vizet veszítenek és térfogatuk csökken, azaz összezsugorodnak (4. ábra, b). A hipertóniás sóoldatot sebek kezelésére használják. Az ilyen oldattal megnedvesített gézkötés jól felszívja a gennyet, ami segít a seb megtisztításában és gyógyulásában.
Ellenkező kép figyelhető meg, ha a sejteket hipotóniás oldatba merítjük, amelyben az oldott anyagok koncentrációja alacsonyabb, mint a sejtekben. Ilyenkor a víz beáramlik a sejtbe, a sejt megduzzad és lizálhat, azaz szétrobban (4. ábra, ban ben).
A vízzel is összefüggésbe hozható szabályozás termikus rezsim organizmusok. A víznek nagy a hőkapacitása - felszívódása nagyszámú hő kis hőmérséklet-változásokhoz. Ennek köszönhetően a víz megakadályozza a hirtelen hőmérséklet-változásokat a sejtekben és a test egészében, még akkor is, ha a hőmérséklet ingadoz környezet elég nagyok.
A vízmolekulák közötti hidrogénkötések teljes száma a hőmérséklet függvényében változik. Amikor a jég megolvad, a hidrogénkötések körülbelül 15% -a, 40 ° C-on pedig a fele elpusztul. A gőz állapotba való átmenet során minden hidrogénkötés megsemmisül. Amikor a hőmérséklet változik külső környezet a víz elnyeli (vagy leadja) a hőt számos hidrogénkötés felszakadása (vagy kialakulása) következtében. Ez magyarázza a magas fajlagos hő víz.
Az élőlények vízpárolgása során (növényekben párologtatás, emlősökben izzadás) sok hő költ el, ami megvédi őket a túlmelegedéstől.
Magas hővezető képességének köszönhetően a víz biztosítja egyenletes eloszlás hő a test szövetei között (például a keringési rendszeren keresztül). Így a víz részt vesz a test termikus rezsimjének szabályozásában.
ásványi sók és savak.Ásványi sók szükségesek a sejtek és a szervezet egészének létfontosságú tevékenységének fenntartásához. Az élő szervezetekben vagy oldott formában (ionokká disszociálva), vagy szilárd állapotban vannak. Biológiai szempontból az ionok közül a K +, Na +, Ca 2+, Mgr + kationok és az SG, HCO3, HPO ^, H0PO4 anionok a legfontosabbak.
A teljes ásványi sók tartalma a különféle sejtek egytől több százalékig változik. Szerepük a sejtben változatos. Így a K + és Na + ionok különböző koncentrációja a sejteken belül és kívül a citoplazma membránján elektromos potenciálkülönbség megjelenéséhez vezet, ami nagyon fontos az idegimpulzusok átviteléhez, valamint az anyagok szállításához. a membrán. Ennek a különbségnek a csökkenésével a sejtek ingerlékenysége csökken.
Egyes ionok nélkülözhetetlenek a szerves anyagok szintéziséhez. Például a foszforsavmaradékok a nukleotidok és az ATP részei, a Fe 2+ ion a hemoglobin része, az Mg 2+ a klorofill stb. Az NO3, NHJ ionok a nitrogénatomok, az ion SO 2- - kénatomok forrásai, amelyek az autotróf szervezetek számára szükségesek az aminosavak szintéziséhez. Számos enzim szabályozó funkcióját és aktiválását a Ca 2+ és Mg 2+ ionok látják el. Ezenkívül a Mg 2 * ionok aktiválják az energiaanyagcserét és az ATP szintézist.
A kalciumvegyületek (például CaCO 3) a puhatestűek, rákfélék és más állatok héjának részét képezik. Egyes tiltakozások szerint az intracelluláris váz Si0 2 szilícium-oxidból (IV) vagy stroncium-szulfát SrS0 4-ből épül fel.
Szervetlen savak is teljesítenek fontos jellemzői a testben. Tehát a gerincesek gyomrában a sósav savas környezetet hoz létre, hozzájárulva a kórokozók elpusztításához és a gyomornedv enzimek aktiválásához, és serkenti a gyomor falainak összehúzódását. A szénsav és anionjai hidrogén-karbonát pufferrendszert, a foszforsav anionok pedig foszfát pufferrendszert alkotnak.
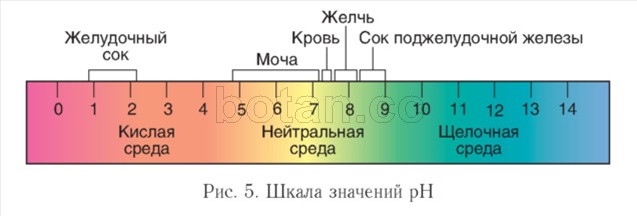
A környezet savassága. Az élő szervezetekben zajló biokémiai reakciók lefolyását jelentősen befolyásolja a hidrogénionok koncentrációja (H +) - a környezet savassága. NÁL NÉL semleges oldatokban ez a koncentráció az 1 (G 7 mol/l. A közeg savasságának jellemzésére kényelmesen használható PH érték ( pH) és shkskarlát pH(5. ábra).
Vizes oldatokban a pH-érték általában 0 és 14 közötti értékeket vesz fel. A semleges környezetet \u003d 7 pH-érték jellemzi, lúgos környezetben 7-nél nagyobb, savasban pedig kevesebb, mint 7. Minél jobban eltér a pH-érték 7-től, annál savasabb vagy lúgosabb az oldat.
A sejtek belsejében a tápközeg semleges vagy enyhén lúgos (pH = 7,0-7,3), a vérben a pH valamivel magasabb, mint a sejtekben, és általában 7,35-7,45 között mozog. Az emésztőrendszerben a pH nagyon változó. Az extrém pH értékek a gyomorra (1-2) és a vékonybélre (több mint 8) jellemzőek. A vizeletben jelentős pH-ingadozások figyelhetők meg (4,8-7,4).
A pufferoldatok fogalma. Az élő szervezetek egésze és egyes sejtjeik képesek a környezet savasságát egy bizonyos szinten fenntartani. Az extracelluláris környezet enyhén lúgos reakciójának fenntartásában
szénsav H 2 CO 3 és hidrokarbonát ion HCO3 vesznek részt. A szénsav gyenge elektrolit, oldatban molekuláinak egy része disszociál, és egyensúly figyelhető meg:
H 2 C0 3 ^ H + + HCOd.
Ha az oldatban valamilyen okból megnő a H + ionok koncentrációja (a környezet savasabbá válik), a HCO anionok megkötik őket:
H + + HCO3 ->. H 2 C0 3.
Ha a közeg savassága csökken, a szénsavmolekulák disszociálnak, és további hidrogénionok szabadulnak fel:
H 2 C0 3 H + + HCO3.
Így a H + -ionok viszonylag állandó koncentrációja megmarad az oldatban. Hasonlóképpen, a HoPO^ és HPO^ foszforsav anionok semleges vagy enyhén lúgos környezetet tartanak fenn a sejtekben. Azokat az oldatokat, amelyekben a közeg összetételének megváltozásakor a hidrogénionok koncentrációjának (H +) relatív állandósága biztosított, ún. puffer.
1. Milyen szervetlen anyagok tartoznak az élő szervezetekhez?
2. Milyen anyagokat nevezünk hidrofilnek? Hidrofób? Adj rá példákat.
3. Ismertesse biológiai szerepeásványi sók és savak.
4. Mennyi vizet tartalmaznak az élő szervezetek? Mitől függ? Miért hervadnak el a növények vízhiányban?
5. Két glükózoldatot egy membrán választ el egymástól, amely nem engedi át a glükózmolekulákat, de átengedi a vizet. A glükóz koncentrációja az első oldatban 1%, a másodikban - 0,1%. Mi történik a vízmolekulákkal? Mi ennek a jelenségnek a neve?
6. Melyek a víz fő funkciói az élő szervezetekben? Mind a fizikai, mind a Kémiai tulajdonságok a víz biológiai funkcióihoz kapcsolódik?
7. Szerinted a legtöbb poláris anyag miért oldódik jól vízben, míg a nem poláris anyagok általában nem oldódnak benne?
8. Az extracelluláris környezet puffer tulajdonságait szénsav és bikarbonát ion, a sejten belül pedig foszforsav anionok látják el. Miért teszik lehetővé ezek a vegyületek az oldatokban a hidrogénionok bizonyos koncentrációjának fenntartását, míg a nitrogén és sósav, valamint anionjaik nem rendelkeznek ilyen tulajdonságokkal?
- 1. § A kémiai elemek tartalma a szervezetben. Makro- és mikroelemek
- § 2. Kémiai vegyületek élő szervezetekben. szervetlen anyagok
- 10. § A sejt felfedezésének története. A sejtelmélet megalkotása
- 15. § Endoplazmás retikulum. Golgi komplexus. Lizoszómák
1. fejezet Élő szervezetek kémiai összetevői
2. fejezet Sejt - élő szervezetek szerkezeti és funkcionális egysége
3. fejezet
1. Milyen szervetlen anyagok tartoznak az élő szervezetekhez?
Az élő szervezetek összetétele olyan szervetlen anyagokat tartalmaz, mint a víz, ásványi sók, szervetlen (ásványi) savak és néhány más.
2. Milyen anyagokat nevezünk hidrofilnek? Hidrofób? Adj rá példákat.
A hidrofil anyagok olyan anyagok, amelyek aktívan kölcsönhatásba lépnek a vízmolekulákkal hidrogénkötések kialakításával. A hidrofil anyagok általában jól oldódnak vízben. A hidrofób anyagok gyengén kölcsönhatásba lépnek a vízmolekulákkal, "igyekszenek" elkerülni a velük való érintkezést. Az ilyen anyagok nem oldódnak vízben. A biológia alapfokú tanulmányaihoz elegendő, ha a hallgatók a hidrofil anyagokat vízben oldódónak, a hidrofób anyagokat pedig vízben oldhatatlannak minősítik.
Hidrofil anyagok például a mono- és diszacharidok, rövid szénláncú alkoholok, rövid szénláncú karbonsavak, sok szervetlen sav és só. A hidrofóbok közé tartoznak a zsírok, magasabb szénatomszámú karbonsavak és néhány más anyag.
3. Ismertesse az ásványi sók és savak biológiai szerepét!
Az oldhatatlan ásványi sók az élő szervezetek különféle tartószerkezeteinek részét képezik, például a kalcium-karbonát (CaCO 3) a puhatestűek és rákhéjak része. Egyes protisták intracelluláris váza stroncium-szulfátból (SrSO 4) épül fel.
Az élő szervezetekben oldható ásványi sók ionok formájában vannak. ban ben vízi környezet disszociációjuk megtörténik. Biológiai szempontból az ionok közül a K +, Na +, Ca 2+, Mg 2+ kationok és a Cl -, HCO 3 -, HPO 4 2-, H 2 RO 4 - anionok a legfontosabbak. Különböző koncentráció A sejteken belüli és kívüli K + és Na + ionok elektromos potenciálkülönbségek megjelenéséhez vezetnek a citoplazma membránján, ami fontos az idegimpulzusok átviteléhez és az anyagok membránon történő szállításához. Ennek a különbségnek a csökkenésével a sejtek ingerlékenysége csökken. A foszforsavmaradékok a nukleotidok és az ATP részét képezik. A Fe 2+ a hemoglobin, a Mg 2+ a klorofill része. Az NO 3 - és az NH 4 + ionok nitrogénatomok, az ion SO 4 2 - - kénatomok forrásai, amelyek az autotróf szervezetek számára szükségesek az aminosavak szintéziséhez. A Ca 2+ és Mg 2+ ionok szabályozó funkciót látnak el, számos enzimet aktiválnak. Például a Mg 2+ -ionok aktiválják az energiaanyagcserét és az ATP szintézist.
Az ásványi (szervetlen) savak fontos biológiai funkciókat is ellátnak. A sósav savas környezetet hoz létre a gerincesek és az emberek gyomrában, hozzájárulva a kórokozók elpusztításához és a gyomornedv enzimek aktiválásához, valamint serkenti a gyomor falainak összehúzódását. A foszforsav anionok foszfát pufferrendszert alkotnak, amely semleges vagy enyhén lúgos környezetet tart fenn a sejtekben. A szénsav és anionjai egy bikarbonát pufferrendszert alkotnak, amely fenntartja az extracelluláris közeg enyhén lúgos reakcióját.
4. Mennyi vizet tartalmaznak az élő szervezetek? Mitől függ? Miért hervadnak el a növények vízhiányban?
A víztartalom a szervezet típusától, életkorától, a sejtek (szövetek) típusától és fiziológiai állapotától függ. Például az emberekben az agy szürkeállománya körülbelül 85% vizet, a csontszövet pedig 22% -ot tartalmaz. A szervezetben a legmagasabb víztartalom az embrionális időszakban figyelhető meg (körülbelül 95%), és az életkorral fokozatosan csökken, ami a sejtek, szövetek és a szervezet egészének funkcionális aktivitásának csökkenéséhez vezet.
A víz meghatározza a sejt térfogatát és az intracelluláris (turgor) nyomást, ami a sejtmembrán stresszállapotát okozza. A sejtekben lévő víz hiányával a turgornyomás csökken, így a növények elsorvadnak.
5. Két glükózoldatot egy membrán választ el egymástól, amely nem engedi át a glükózmolekulákat, de átengedi a vizet. A glükóz koncentrációja az első oldatban 1%, a másodikban - 0,1%. Mi történik a vízmolekulákkal? Mi ennek a jelenségnek a neve?
A vízmolekulák egy félig áteresztő membránon keresztül kevésbé tömény oldatból (0,1%-os glükóz tömeghányaddal) töményebb oldatba (1%-os glükóz tömeghányaddal) mozognak. Ezt a jelenséget ozmózisnak nevezik. Az ozmózis kiegyenlíti a glükózkoncentrációt egy féligáteresztő membránnal elválasztott oldatokban.
6. Melyek a víz fő funkciói az élő szervezetekben? Hogyan függenek össze a víz fizikai és kémiai tulajdonságai a biológiai funkcióival?
A víz a sejtek és az intercelluláris anyag része, a vér, a nyirok, a szövetfolyadék, a mirigyek váladékának alapja. Meghatározza a sejtek térfogatát és biztosítja a turgornyomás fenntartását. A víz a poláris vegyületek univerzális oldószere, és az élő szervezetek anyagcsere-folyamatainak fő közege. A szervezetben a legtöbb kémiai reakció vizes oldatokban megy végbe. Az anyagok sejtekből való bejutása és kilépése általában oldott formában történik. A víz, mint oldószer részt vesz az ozmózis jelenségeiben, aminek következtében a sejtekben és az extracelluláris közegben az oldott anyagok koncentrációja kiegyenlítődik.
A víz közvetlen résztvevője számos biokémiai reakciónak, például a szerves vegyületek hidrolitikus hasításának (hidrolízisének) reakcióiban. A fotoszintézis reakcióinak egyik kiindulási anyaga. A fotoszintézis során felszabaduló oxigén a vízmolekulák lebontásából származik.
A víz részt vesz az élőlények termikus rezsimjének szabályozásában. Biztosítja a hő egyenletes eloszlását a szövetek és szervek között, megakadályozza a hirtelen hőmérsékletváltozásokat a sejtekben és a szervezet egészében, még akkor is, ha a környezet hőmérséklet-ingadozása elég nagy. Az élőlények vízpárolgása során (növényekben párologtatás, emlősökben izzadás) sok hő költ el, ami megvédi őket a túlmelegedéstől.
A víz az anyagcsere-folyamatok univerzális oldószere és közege a molekulák polaritása és más vegyületekkel intermolekuláris hidrogénkötések kialakítására való képessége miatt. A vízmolekulák kis mérete fontos szerepet játszik az ozmotikus jelenségekben. A víz részvétele az élőlények termikus rezsimjének szabályozásában nagy hőkapacitásával, jó hővezető képességével és magas párolgási hőjével függ össze. Ez pedig annak köszönhető, hogy a vízmolekulák képesek számos hidrogénkötést kialakítani egymással.
7. Szerinted a legtöbb poláris anyag miért oldódik jól vízben, míg a nem poláris anyagok általában nem oldódnak benne?
A vízmolekulák polárisak, ami lehetővé teszi számukra, hogy intenzív kölcsönhatásba léphessenek más poláris anyagokkal. A víz hozzájárul a poláris vegyületek szerkezeti részecskéinek (ionok, molekulák) elválasztásához, azok oldatba való átalakulásához, hidratáló héjakat képez az ionok és poláris molekulák körül.
A vízmolekulák nagyon gyengén lépnek kölcsönhatásba a nem poláris vegyületekkel. Az ilyen anyagok vízben gyakorlatilag nem oldódnak, de nem poláris oldószerekben (például benzinben) jól oldódnak. Itt illik felidézni az alkimisták ősi szabályát: "A hasonló a hasonlóban feloldódik."
nyolc*. Az extracelluláris környezet puffertulajdonságait a szénsav és bikarbonát ion biztosítja, a sejten belül ezt a funkciót a foszforsav anionok látják el. Miért teszik lehetővé ezek a vegyületek a hidrogénionok bizonyos koncentrációjának fenntartását az oldatokban, míg a salétromsav és a sósav, valamint anionjaik nem rendelkeznek ilyen tulajdonságokkal?
A szénsav gyenge elektrolit. Vizes oldatokban molekuláinak csak kis része disszociál ionokká, ezért az intercelluláris közegben a bikarbonát ionokkal (HCO 3 -) együtt nem disszociált szénsavmolekulák (H 2 CO 3) is találhatók. A sejtek belsejében bizonyos egyensúly (egyensúly) van a foszforsav H 2 PO 4 - és HPO 4 2- anionjai között:
H 2 CO 3 ↔ H + + HCO 3 -
H 2 RO 4 – ↔ H + + HRO 4 2–
A közeg savasságának csökkenésével az egyensúly jobbra tolódik - további hidrogénionok (H +) szabadulnak fel. A savasság növekedésével az egyensúly balra tolódik el - "extra" H + ionok kötődnek. Emiatt az extracelluláris környezet (illetve az intracelluláris tartalom) reakciója gyakorlatilag nem változik.
A salétromsav és a sósav erős elektrolitok. Vízben oldva szinte teljesen ionokká disszociálnak:
HNO 3 → H + + NO 3 -
HCl → H + + Cl -
Az erős elektrolitok disszociációja gyakorlatilag irreverzibilis, így oldataik nem rendelkeznek puffertulajdonságokkal.
* A csillaggal jelölt feladatok különböző hipotézisek felállítását igénylik a tanulókkal. Ezért az osztályzat felállításakor a tanárnak nem csak az itt adott válaszra kell összpontosítania, hanem figyelembe kell vennie az egyes hipotéziseket, értékelve a tanulók biológiai gondolkodását, érvelésük logikáját, az ötletek eredetiségét stb. célszerű a tanulókat megismertetni a kapott válasszal.
Mint már tudjuk, a sejt áll vegyi anyagok szerves és szervetlen típusok. A sejtet alkotó fő szervetlen anyagok a sók és a víz.
A víz, mint az élet alkotóeleme
A víz minden élőlény domináns alkotóeleme. A víz fontos biológiai funkcióit a egyedi tulajdonságok molekulái, különösen a dipólusok jelenléte, amelyek lehetővé teszik a sejtek közötti hidrogénkötések létrejöttét.
Az élőlények testében lévő vízmolekuláknak köszönhetően a hőstabilizációs és hőszabályozási folyamatok végbemennek. A hőszabályozás folyamata a vízmolekulák nagy hőkapacitása miatt következik be: a külső hőmérséklet-változások nem befolyásolják a testen belüli hőmérsékletváltozásokat.
Hála a víznek, a szerveknek emberi test megtartják rugalmasságukat. A víz a gerincesek ízületeihez vagy a szívburok zsákjához szükséges kenőfolyadékok egyik fő összetevője.
A nyálka része, amely megkönnyíti az anyagok mozgását a belekben. A víz az epe, a könny és a nyál összetevője.
Sók és egyéb szervetlen anyagok
Az élő szervezet sejtjei a vízen kívül olyan szervetlen anyagokat is tartalmaznak, mint savak, bázisok és sók. A legtöbb fontosságát a szervezet életében van Mg2+, H2PO4, K, CA2, Na, C1-. Gyenge savak garantáltan stabil belső környezet sejtek (enyhén lúgosak).
Az intercelluláris anyagban és a sejten belül az ionok koncentrációja eltérő lehet. Így például a Na + ionok csak az intercelluláris folyadékban koncentrálódnak, míg a K + kizárólag a sejtben található.
Egyes ionok számának éles csökkenése vagy növekedése a sejt összetételében nem csak a működési zavarokhoz, hanem a halálhoz is vezet. Például a Ca + mennyiségének csökkenése a sejtben görcsöket okoz a sejten belül és annak további halálát.
Egyes szervetlen anyagok gyakran kölcsönhatásba lépnek zsírokkal, fehérjékkel és szénhidrátokkal. Így kiváló példa foszfort és ként tartalmazó szerves vegyületek.
A kén, amely a fehérjemolekulák része, felelős a szervezetben a molekuláris kötések kialakulásáért. A foszfor és a szerves anyagok szintézisének köszönhetően a fehérjemolekulákból energia szabadul fel.
Kalcium sók
A kalciumsók hozzájárulnak a csontszövet normál fejlődéséhez, valamint az agy és a gerincvelő működéséhez. A szervezetben a kalcium-anyagcsere a D-vitamin miatt megy végbe. A kalcium-sók túlzott mennyisége vagy hiánya a szervezet működési zavarához vezet.
