ما هي المواد غير العضوية المدرجة في التكوين. مواد غير عضوية
بعد التعرف على العناصر الكيميائية الموجودة في الكائنات الحية ، دعونا ننتقل إلى دراسة المواد التي يتم تضمين هذه العناصر فيها. من بينها مواد غير عضوية (الماء والأملاح المعدنية والأحماض) و مركبات العضوية(رسم بياني 1). تحتوي معظم الكتلة في الكائنات الحية على الماء.
ماء.يبلغ محتوى الماء في الكائنات الحية 60-75٪ من كتلتها ، وفي بعض الكائنات ، مثل قنديل البحر ، يصل إلى 98٪. في الأوراق و الفواكه العصيريمكن أن يصل المحتوى المائي للنباتات أيضًا إلى 98٪.
كمية الماء ليست هي نفسها أقمشة مختلفةوالأعضاء. لذلك ، في الشخص المصاب بالمادة الرمادية للدماغ ، يكون محتواها 85٪ ، وفي أنسجة العظام - 22٪. لوحظ أعلى محتوى مائي في الجسم في فترة الجنين (95٪) وينخفض تدريجيًا مع تقدم العمر. بدون استخدام الماء ، لا يمكن لأي شخص أن يعيش أكثر من 5-7 أيام.
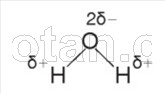
كما تعلم بالفعل من دورة الكيمياء ، يتكون جزيء الماء (H 2 0) من ذرتين من الهيدروجين متصلتين بواسطة روابط تساهمية قطبية بذرة أكسجين.
توجد روابط H – O – H بزاوية 104.5 درجة مع بعضها البعض. للأكسجين كهرسلبية أكبر من الهيدروجين ، لذلك تجذب ذرة الأكسجين أزواج الإلكترونات المشتركة وتكتسب شحنة سالبة جزئيًا. تكتسب ذرات الهيدروجين شحنة موجبة جزئيًا ، أي جزيء الماء قطبي.
ينشأ التجاذب الكهروستاتيكي بين ذرة الأكسجين لجزيء ماء وذرة الهيدروجين لجزيء آخر. مثل هذا التفاعل
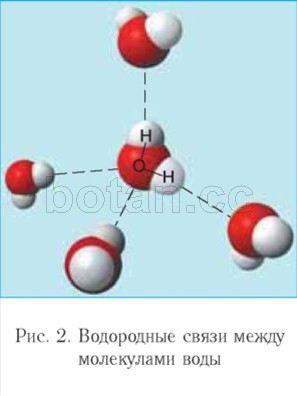
أضعف من الرابطة الأيونية يسمى رابطة الهيدروجين.كل جزيء ماء ، مثل المغناطيس الصغير ، يجذب أربعة جزيئات أخرى لنفسه بسبب تكوين روابط الهيدروجين (الشكل 2). بسبب تكوين روابط هيدروجينية ، ترتبط جزيئات الماء ببعضها البعض. لذلك ، يمكن للماء عند درجات حرارة من 0 درجة مئوية إلى 100 درجة مئوية الاحتفاظ بالسائل حالة التجميع، في حين أن مركبات الهيدروجين المماثلة (على سبيل المثال ، H 2 S ، NH 3 ، HF) هي غازات.
يرتبط الدور البيولوجي للمياه في الكائنات الحية بخصائصها ، في المقام الأول مع صغر حجم الجزيئات ، وقطبيتها والقدرة على تكوين روابط هيدروجينية مع بعضها البعض ومع المركبات الأخرى.
الماء هو الذي يحدد حجم الخلايا وداخلها (تورغور)الضغط. نظرًا لقطبيتها ، فإن جزيئات الماء قادرة على تكوين ما يسمى بقذائف الترطيب حول الأيونات والجزيئات القطبية. يساهم هذا في فصل الجزيئات ويمنعها من الالتصاق ببعضها ، وهو أمر مهم بشكل خاص ، على سبيل المثال ، لجزيئات البروتين.
إن قطبية الجزيئات والقدرة على تكوين روابط هيدروجينية تصنع الماء مذيب عالمي للمواد القطبية ،أفضل من معظم السوائل المعروفة. اعتمادًا على قابلية الذوبان في الماء ، يتم تقسيم المركبات تقليديًا إلى قابل للذوبان ، أو محبة للماء(من اليونانية. مرشد- ماء، فششا- الحب) ، وغير قابل للذوبان ، أو نافرة من الماء(من اليونانية. فوبوس- يخاف). المواد المحبة للماء هي أحادي وثنائي السكريات ، والعديد من الأملاح والأحماض المعدنية ، والكحول المنخفض ، والأحماض الكربوكسيلية المنخفضة ، وما إلى ذلك. الأحماض الكربوكسيلية العالية ، والدهون ، وبعض المواد الأخرى كارهة للماء.
الماء هو الوسيط لتدفق الكثيرين عمليات التمثيل الغذائي. أغلبية تفاعلات كيميائيةفي الجسم يحدث على وجه التحديد في المحاليل المائية. يتم دخول وخروج المواد من الخلية ، كقاعدة عامة ، في شكل مذاب. يشارك الماء بشكل مباشر في العديد من التفاعلات الكيميائية التي تحدث في الخلايا ، بما في ذلك عمليات تقسيم المركبات العضوية. إنها إحدى المواد الأولية في تفاعلات التمثيل الضوئي. يتم إطلاق الأكسجين الناتج أثناء عملية التمثيل الضوئي عندما تتحلل جزيئات الماء.
يشارك الماء كمذيب في ظاهرة التناضح واللعب دورا هامافي نشاط خلايا الجسم. التنافذ- هي حركة جزيئات الماء عبر غشاء شبه نافذ (على سبيل المثال ، من خلال الغشاء السيتوبلازمي للخلية) من منطقة ذات تركيز منخفض من المواد المذابة (على سبيل المثال ، الأملاح أو السكريات أو اليوريا) إلى منطقة ذات تركيز أعلى من هذه المواد (الشكل 3). بسبب التناضح ، يتم معادلة تركيزات المواد المذابة في الخلية والوسط خارج الخلية.
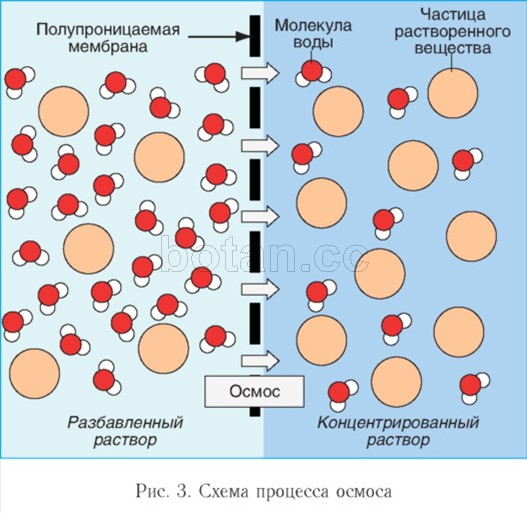
إذا تم فصل محلول ومذيب (على سبيل المثال ، الماء) بواسطة غشاء قابل للنفاذ بشكل انتقائي ، يتم ملاحظة حركة جزيئات المذيب عبر الغشاء إلى المحلول. من أجل منع دخول المذيب ، يجب تطبيق ضغط معين على المحلول ، وهو ما يسمى بالضغط الاسموزي. كلما زاد تركيز المحلول ، زاد ضغطه الأسموزي.
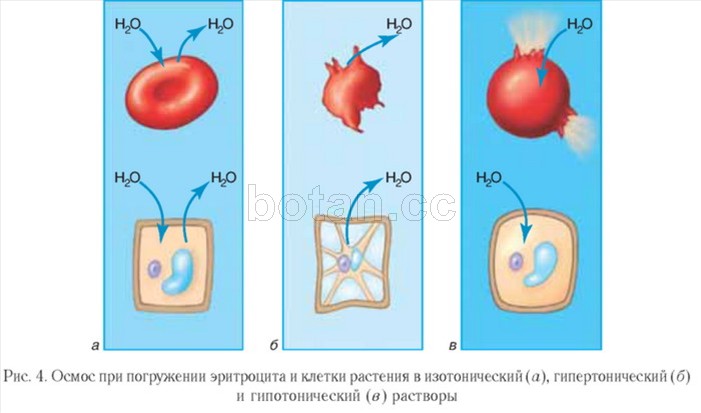
تسمى الحلول التي يكون ضغطها الأسموزي هو نفسه الموجود في الخلايا متساوي التوتر. يظل حجم الخلايا المغمورة في المحاليل متساوية التوتر دون تغيير (الشكل 4 ، أ).تستخدم المحاليل متساوية التوتر ، ولا سيما المحلول الملحي الفسيولوجي (محلول مائي من كلوريد الصوديوم بكسر كتلة 0.9٪) ، في الطب. يتم استخدامها للجفاف الشديد وفقدان الدم من قبل المرضى لتذوب الأدويةتدار عن طريق الحقن.
يسمى المحلول الذي يكون ضغطه التناضحي أعلى منه في الخلايا مفرط التوتر. تفقد الخلايا المغمورة في محلول مفرط التوتر الماء وتنخفض في الحجم ، أي تتقلص (الشكل 4 ، ب).يستخدم المحلول الملحي مفرط التوتر في علاج الجروح. ضمادة شاش مبللة بمثل هذا المحلول تمتص القيح جيدًا ، مما يساعد على تنظيف الجرح وتضميده.
يتم ملاحظة الصورة المعاكسة عندما تكون الخلايا مغمورة في محلول منخفض التوتر ، حيث يكون تركيز المواد المذابة أقل من الخلايا. في هذه الحالة ، يندفع الماء إلى الخلية ، وتتضخم الخلية ويمكن أن تنفجر ، أي تنفجر (الشكل 4 ، في).
يرتبط أيضًا بالماء اللائحة النظام الحراري الكائنات الحية. يتمتع الماء بسعة حرارية عالية - القدرة على الامتصاص عدد كبير منالحرارة للتغيرات الطفيفة في درجة الحرارة. بفضل هذا ، يمنع الماء التغيرات المفاجئة في درجة الحرارة في الخلايا والجسم ككل ، حتى عند تقلبات درجات الحرارة بيئةكبيرة بما يكفي.
يختلف العدد الإجمالي للروابط الهيدروجينية بين جزيئات الماء باختلاف درجة الحرارة. عندما يذوب الجليد ، يتم تدمير حوالي 15٪ من الروابط الهيدروجينية ، وعند 40 درجة مئوية - النصف. عند الانتقال إلى حالة البخار ، يتم تدمير جميع الروابط الهيدروجينية. عندما تتغير درجة الحرارة بيئة خارجيةيمتص الماء (أو يطلق) الحرارة بسبب تكسر (أو تكوين) العديد من الروابط الهيدروجينية. هذا ما يفسر ارتفاع حرارة نوعيةماء.
أثناء تبخر الماء عن طريق الكائنات الحية (النتح في النباتات ، والتعرق في الثدييات) ، يتم إنفاق الكثير من الحرارة ، مما يحميها من ارتفاع درجة الحرارة.
بسبب الموصلية الحرارية العالية ، يوفر الماء توزيع موحدالحرارة بين أنسجة الجسم (على سبيل المثال ، من خلال الدورة الدموية). وهكذا ، يشارك الماء في تنظيم النظام الحراري للجسم.
الأملاح المعدنية والأحماض.الأملاح المعدنية ضرورية للحفاظ على النشاط الحيوي للخلايا والجسم ككل. في الكائنات الحية ، تكون إما في شكل مذاب (مفككة إلى أيونات) أو في حالة صلبة. من وجهة نظر بيولوجية ، أهم الأيونات هي الكاتيونات K + ، Na + ، Ca 2+ ، Mgr + والأنيونات SG ، HCO3 ، HPO ^ ، H0PO4.
المحتوى الكلي للأملاح المعدنية في خلايا مختلفةيختلف من واحد إلى عدة بالمائة. دورهم في الخلية متنوع. وبالتالي ، فإن تراكيز مختلفة من أيونات K + و Na + داخل الخلايا وخارجها تؤدي إلى ظهور اختلاف في الجهد الكهربائي على الغشاء السيتوبلازمي ، وهو أمر مهم جدًا لنقل النبضات العصبية ، وكذلك لنقل المواد عبر الغشاء. مع انخفاض هذا الاختلاف ، تقل استثارة الخلايا.
بعض الأيونات ضرورية لتخليق المواد العضوية. على سبيل المثال ، بقايا حمض الفوسفوريك هي جزء من النيوكليوتيدات و ATP ، والأيون Fe 2+ جزء من الهيموجلوبين ، والمغنيسيوم 2+ جزء من الكلوروفيل ، إلخ. الأيونات NO3 ، NHJ هي مصادر ذرات النيتروجين ، أيون SO 2- - ذرات الكبريت ، وهي ضرورية للكائنات ذاتية التغذية لتخليق الأحماض الأمينية. يتم تنفيذ الوظيفة التنظيمية وتفعيل العديد من الإنزيمات بواسطة أيونات Ca 2+ و Mg 2+. بالإضافة إلى ذلك ، تعمل أيونات Mg 2 * على تنشيط استقلاب الطاقة وتخليق ATP.
مركبات الكالسيوم (على سبيل المثال ، كربونات الكالسيوم 3) هي جزء من أصداف الرخويات وقشريات القشريات والحيوانات الأخرى. في بعض الاحتجاجات ، يتكون الهيكل العظمي داخل الخلايا من أكسيد السيليكون (IV) Si0 2 أو كبريتات السترونشيوم SrS0 4.
تعمل الأحماض غير العضوية أيضًا الميزات الهامةداخل الجسم. لذلك ، في معدة الفقاريات ، يخلق حمض الهيدروكلوريك بيئة حمضية ، مما يساهم في تدمير مسببات الأمراض وتنشيط إنزيمات العصارة المعدية ، ويحفز تقلصات جدران المعدة. يشكل حمض الكربونيك وأنيوناته نظامًا عازلًا للبيكربونات ، وتشكل أنيونات حمض الفوسفوريك نظامًا عازلًا للفوسفات.
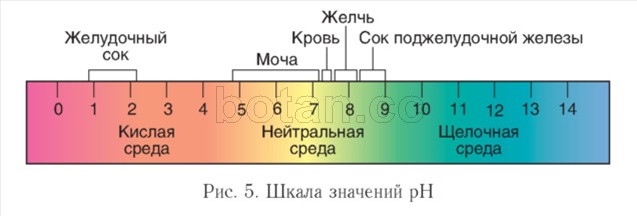
حموضة البيئة.يتأثر مسار التفاعلات الكيميائية الحيوية في الكائنات الحية بشكل كبير بتركيز أيونات الهيدروجين (H +) - حموضة البيئة. فيفي المحاليل المحايدة ، يكون هذا التركيز 1 (خ 7مول / لتر. لوصف حموضة الوسط ، فإنه مناسب للاستخدام قيمه الحامضيه (الرقم الهيدروجيني) و shkدرجة الحموضة القرمزية(الشكل 5).
في المحاليل المائية ، عادةً ما تأخذ قيمة الرقم الهيدروجيني قيمًا من 0 إلى 14. تتميز البيئة المحايدة بقيمة pH = 7 ، في بيئة قلوية يكون الرقم الهيدروجيني أكبر من 7 ، وفي بيئة حمضية يكون أقل من 7. كلما زادت قيمة الأس الهيدروجيني عن 7 ، كلما كان الحل أكثر حمضية أو قلوية.
داخل الخلايا ، يكون الوسط محايدًا أو قلويًا قليلاً (الرقم الهيدروجيني = 7.0-7.3) ، في الدم يكون الرقم الهيدروجيني أعلى قليلاً منه في الخلايا ويتراوح عادةً بين 7.35-7.45. في الجهاز الهضمي ، يختلف الأس الهيدروجيني بشكل كبير. قيم الأس الهيدروجيني القصوى هي خصائص المعدة (1-2) والأمعاء الدقيقة (أكثر من 8). لوحظت تقلبات كبيرة في درجة الحموضة (4.8-7.4) في البول.
مفهوم الحلول العازلة.الكائنات الحية ككل وخلاياها الفردية لديها القدرة على الحفاظ على حموضة البيئة عند مستوى معين. في الحفاظ على تفاعل قلوي طفيف للبيئة خارج الخلية
يشارك حمض الكربونيك H 2 CO 3 وأيون الهيدروكربونات HCO3. حمض الكربونيك هو إلكتروليت ضعيف ، في المحلول يتم فصل جزء معين من جزيئاته ويلاحظ وجود توازن:
H 2 C0 3 ^ H + + HCOd.
إذا زاد تركيز أيونات H + في المحلول لأي سبب من الأسباب (تصبح البيئة أكثر حمضية) ، فإن أنيون HCO تربطهم:
H + + HCO3 ->. H 2 C03.
إذا انخفضت حموضة الوسط ، تنفصل جزيئات حمض الكربونيك ، وتطلق أيونات الهيدروجين الإضافية:
H 2 C0 3 H + HCO3.
وبالتالي ، يتم الحفاظ على تركيز ثابت نسبيًا لأيونات H + في المحلول. وبالمثل ، فإن أنيون حامض الفوسفوريك HoPO ^ و HPO تحافظ على بيئة محايدة أو قلوية قليلاً داخل الخلايا. تسمى الحلول التي ، عندما يتغير تكوين الوسط ، يتم ضمان ثبات نسبي لتركيز أيونات الهيدروجين (H +) متعادل.
1. ما هي المواد غير العضوية التي هي جزء من الكائنات الحية؟
2. ما هي المواد التي تسمى ماء؟ نافرة من الماء؟ أعط أمثلة.
3. وصف دور بيولوجيالأملاح المعدنية والأحماض.
4. ما هي كمية الماء الموجودة في الكائنات الحية؟ على ماذا تعتمد؟ لماذا تذبل النباتات عند نقص الماء؟
5. يتم فصل محلولين من الجلوكوز بواسطة غشاء لا يسمح بمرور جزيئات الجلوكوز ، ولكنه يسمح بمرور الماء. تركيز الجلوكوز في المحلول الأول هو 1٪ ، في الثاني - 0.1٪. ماذا يحدث لجزيئات الماء؟ ما اسم هذه الظاهرة؟
6. ما هي الوظائف الرئيسية للمياه في الكائنات الحية؟ على حد سواء المادية و الخواص الكيميائيةالمياه المرتبطة بوظائفها البيولوجية؟
7. لماذا تعتقد أن معظم المواد القطبية تذوب جيدًا في الماء ، بينما المواد غير القطبية ، كقاعدة عامة ، غير قابلة للذوبان فيها؟
8. يتم توفير خصائص المخزن المؤقت للبيئة خارج الخلية بواسطة حمض الكربونيك وأيون البيكربونات ، ويتم تنفيذ هذه الوظيفة داخل الخلايا بواسطة أنيونات حمض الفوسفوريك. لماذا تجعل هذه المركبات من الممكن الحفاظ على تركيز معين من أيونات الهيدروجين في المحاليل ، بينما النيتروجين و حامض الهيدروكلوريك، وكذلك الأنيونات الخاصة بهم ، لا تملك مثل هذه الخصائص؟
- § 1. محتوى العناصر الكيميائية في الجسم. الكلي والعناصر الدقيقة
- § 2. المركبات الكيميائية في الكائنات الحية. مواد غير عضوية
- § 10. تاريخ اكتشاف الخلية. إنشاء نظرية الخلية
- § 15. الشبكة الإندوبلازمية. مجمع جولجي. الجسيمات المحللة
الفصل 1. المكونات الكيميائية للكائنات الحية
الفصل 2. الخلية - الوحدة الهيكلية والوظيفية للكائنات الحية
الفصل 3
1. ما هي المواد غير العضوية التي هي جزء من الكائنات الحية؟
يشمل تكوين الكائنات الحية مواد غير عضوية مثل الماء والأملاح المعدنية والأحماض غير العضوية (المعدنية) وبعض المواد الأخرى.
2. ما هي المواد التي تسمى ماء؟ نافرة من الماء؟ أعط أمثلة.
المواد المحبة للماء هي مواد تتفاعل بنشاط مع جزيئات الماء مع تكوين روابط هيدروجينية. كقاعدة عامة ، المواد المحبة للماء شديدة الذوبان في الماء. تتفاعل المواد الكارهة للماء بشكل ضعيف مع جزيئات الماء ، "جاهد" لتجنب ملامستها لها. هذه المواد لا تذوب في الماء. للحصول على مستوى أساسي من دراسة علم الأحياء ، يكفي للطلاب أن يصفوا المواد المحبة للماء بأنها قابلة للذوبان في الماء ، والمواد الكارهة للماء على أنها غير قابلة للذوبان فيها.
المواد المحبة للماء ، على سبيل المثال ، السكريات الأحادية والثنائية ، والكحوليات المنخفضة ، والأحماض الكربوكسيلية المنخفضة ، والعديد من الأحماض والأملاح غير العضوية. تشمل المواد الكارهة للماء الدهون والأحماض الكربوكسيلية العالية وبعض المواد الأخرى.
3. وصف الدور البيولوجي للأملاح المعدنية والأحماض.
الأملاح المعدنية غير القابلة للذوبان هي جزء من الهياكل الداعمة المختلفة للكائنات الحية ، على سبيل المثال ، كربونات الكالسيوم (CaCO 3) هي جزء من أصداف الرخويات وقشريات القشريات. يتكون الهيكل العظمي داخل الخلايا لبعض الطلائعيات من كبريتات السترونشيوم (SrSO 4).
الأملاح المعدنية القابلة للذوبان في الكائنات الحية على شكل أيونات. في البيئة المائيةتفككهم يحدث. من وجهة نظر بيولوجية ، أهم الأيونات هي الكاتيونات K + ، Na + ، Ca 2+ ، Mg 2+ والأنيونات Cl - ، HCO 3 - ، HPO 4 2- ، H 2 RO 4 -. تركيز مختلفتؤدي أيونات K + و Na + داخل الخلايا وخارجها إلى ظهور اختلاف في الجهود الكهربائية على الغشاء السيتوبلازمي ، وهو أمر مهم لنقل النبضات العصبية ونقل المواد عبر الغشاء. مع انخفاض هذا الاختلاف ، تقل استثارة الخلايا. بقايا حمض الفوسفوريك هي جزء من النيوكليوتيدات و ATP. Fe 2+ جزء من الهيموجلوبين ، Mg 2+ جزء من الكلوروفيل. الأيونات NO 3 - NH 4 + هي مصادر لذرات النيتروجين ، والأيون SO4 2 - - ذرات الكبريت ، وهي ضرورية للكائنات ذاتية التغذية لتخليق الأحماض الأمينية. تؤدي أيونات Ca 2+ و Mg 2+ وظيفة تنظيمية وتنشط العديد من الإنزيمات. على سبيل المثال ، تنشط أيونات Mg 2+ استقلاب الطاقة وتخليق ATP.
تؤدي الأحماض المعدنية (غير العضوية) أيضًا وظائف بيولوجية مهمة. يخلق حمض الهيدروكلوريك بيئة حمضية في معدة الفقاريات والبشر ، مما يساهم في تدمير مسببات الأمراض وتنشيط إنزيمات العصارة المعدية ، ويحفز تقلصات جدران المعدة. تشكل أنيونات حمض الفوسفوريك نظامًا عازلًا للفوسفات يحافظ على بيئة محايدة أو قلوية قليلاً داخل الخلايا. يشكل حمض الكربونيك وأنيوناته نظامًا عازلًا للبيكربونات يحافظ على تفاعل قلوي قليلاً للوسط خارج الخلية.
4. ما هي كمية الماء الموجودة في الكائنات الحية؟ على ماذا تعتمد؟ لماذا تذبل النباتات عند نقص الماء؟
يعتمد محتوى الماء على نوع الكائن الحي وعمره ونوع الخلايا (الأنسجة) وحالتها الفسيولوجية. على سبيل المثال ، في البشر ، تحتوي المادة الرمادية في الدماغ على حوالي 85٪ ماء ، وأنسجة العظام - 22٪. يُلاحظ أعلى محتوى مائي في الجسم في الفترة الجنينية (حوالي 95٪) وينخفض تدريجيًا مع تقدم العمر ، مما يؤدي إلى انخفاض في النشاط الوظيفي للخلايا والأنسجة والجسم ككل.
يحدد الماء حجم الخلية والضغط داخل الخلايا (تورغور) ، مما يسبب حالة إجهاد غشاء الخلية. مع نقص الماء في الخلايا ، ينخفض ضغط التمور ، وبالتالي تذبل النباتات.
5. يتم فصل محلولين من الجلوكوز بواسطة غشاء لا يسمح بمرور جزيئات الجلوكوز ، ولكنه يسمح بمرور الماء. تركيز الجلوكوز في المحلول الأول هو 1٪ ، في الثاني - 0.1٪. ماذا يحدث لجزيئات الماء؟ ما اسم هذه الظاهرة؟
تنتقل جزيئات الماء عبر غشاء شبه منفذ من محلول أقل تركيزًا (مع جزء كتلي من الجلوكوز 0.1٪) إلى محلول أكثر تركيزًا (مع جزء كتلي من الجلوكوز 1٪). هذه الظاهرة تسمى التناضح. يعمل التناضح على معادلة تركيزات الجلوكوز في المحاليل المفصولة بغشاء شبه نافذ.
6. ما هي الوظائف الرئيسية للمياه في الكائنات الحية؟ كيف ترتبط الخواص الفيزيائية والكيميائية للماء بوظائفه البيولوجية؟
الماء هو جزء من الخلايا والمادة بين الخلايا ، وهو أساس الدم ، والليمفاوية ، وسوائل الأنسجة ، وإفرازات الغدد. يحدد حجم الخلايا ويضمن الحفاظ على ضغط التورجر. الماء مذيب عالمي للمركبات القطبية والوسيط الرئيسي الذي تحدث فيه عمليات التمثيل الغذائي للكائنات الحية. تحدث معظم التفاعلات الكيميائية في الجسم في المحاليل المائية. يتم دخول وخروج المواد من الخلايا ، كقاعدة عامة ، في شكل مذاب. يشارك الماء كمذيب في ظاهرة التناضح ، والتي بسببها تتساوى تركيزات المواد المذابة في الخلايا والوسط خارج الخلية.
يعتبر الماء مشاركًا مباشرًا في العديد من التفاعلات الكيميائية الحيوية ، على سبيل المثال ، تفاعلات الانقسام المائي (التحلل المائي) للمركبات العضوية. إنها إحدى المواد الأولية في تفاعلات التمثيل الضوئي. يأتي الأكسجين المنطلق أثناء عملية التمثيل الضوئي من انهيار جزيئات الماء.
يشارك الماء في تنظيم النظام الحراري للكائنات الحية. يضمن توزيعًا موحدًا للحرارة بين الأنسجة والأعضاء ، ويمنع التغيرات المفاجئة في درجات الحرارة في الخلايا والجسم ككل ، حتى عندما تكون تقلبات درجة الحرارة في البيئة كبيرة بدرجة كافية. أثناء تبخر الماء عن طريق الكائنات الحية (النتح في النباتات ، والتعرق في الثدييات) ، يتم إنفاق الكثير من الحرارة ، مما يحميها من ارتفاع درجة الحرارة.
الماء مذيب عالمي ووسيط لعمليات التمثيل الغذائي بسبب قطبية الجزيئات وقدرتها على تكوين روابط هيدروجينية بين الجزيئات مع مركبات أخرى. يلعب الحجم الصغير لجزيئات الماء دورًا مهمًا في الظواهر التناضحية. ترتبط مشاركة الماء في تنظيم النظام الحراري للكائنات بقدرتها الحرارية العالية ، والتوصيل الحراري الجيد والحرارة العالية للتبخر. هذا ، بدوره ، يرجع إلى قدرة جزيئات الماء على تكوين العديد من الروابط الهيدروجينية مع بعضها البعض.
7. لماذا تعتقد أن معظم المواد القطبية تذوب جيدًا في الماء ، بينما المواد غير القطبية ، كقاعدة عامة ، غير قابلة للذوبان فيها؟
جزيئات الماء قطبية ، مما يسمح لها بالتفاعل بشكل مكثف مع المواد القطبية الأخرى. يساهم الماء في فصل الجسيمات الهيكلية للمركبات القطبية (الأيونات والجزيئات) ، وانتقالها إلى محلول ، وتشكيل قذائف ترطيب حول الأيونات والجزيئات القطبية.
تتفاعل جزيئات الماء بشكل ضعيف جدًا مع المركبات غير القطبية. هذه المواد غير قابلة للذوبان عمليًا في الماء ، ولكنها قابلة للذوبان بسهولة في المذيبات غير القطبية (على سبيل المثال ، في البنزين). هنا من المناسب أن نتذكر القاعدة القديمة للكيميائيين: "مثل يذوب في مثل".
ثمانية*. يتم توفير خصائص المخزن المؤقت للبيئة خارج الخلية بواسطة حمض الكربونيك وأيون البيكربونات ؛ داخل الخلايا ، يتم تنفيذ هذه الوظيفة بواسطة أنيونات حمض الفوسفوريك. لماذا تجعل هذه المركبات من الممكن الحفاظ على تركيز معين من أيونات الهيدروجين في المحاليل ، في حين أن أحماض النيتريك والهيدروكلوريك ، وكذلك الأنيونات ، ليس لها مثل هذه الخصائص؟
حمض الكربونيك هو إلكتروليت ضعيف. في المحاليل المائية ، يتم فصل جزء صغير فقط من جزيئاته إلى أيونات ، وبالتالي ، في الوسط بين الخلايا ، جنبًا إلى جنب مع أيونات البيكربونات (HCO3 -) ، يتم أيضًا احتواء الجزيئات غير المرتبطة من حمض الكربونيك (H 2 CO 3). يوجد داخل الخلايا توازن معين (توازن) بين أنيونات حمض الفوسفوريك H 2 PO 4 - و HPO 4 2-:
H 2 CO 3 H + HCO 3 -
H 2 RO 4 - H + + HRO 4 2–
مع انخفاض حموضة الوسط ، يتحول التوازن إلى اليمين - يتم إطلاق أيونات الهيدروجين الإضافية (H +). مع زيادة الحموضة ، يتحول التوازن إلى اليسار - هناك ارتباط بأيونات H + "إضافية". نتيجة لهذا ، فإن تفاعل البيئة خارج الخلية (أو محتويات الخلايا) عمليا لا يتغير.
أحماض النيتريك والهيدروكلوريك هي إلكتروليتات قوية. عندما تذوب في الماء ، فإنها تنفصل تمامًا تقريبًا إلى أيونات:
HNO 3 → H + + NO 3 -
حمض الهيدروكلوريك → H + + Cl -
إن تفكك الإلكتروليتات القوية أمر لا رجوع فيه عمليًا ، لذا فإن محاليلها لا تحتوي على خصائص عازلة.
* تتطلب المهام المميزة بعلامة النجمة من الطلاب طرح فرضيات مختلفة. لذلك ، عند وضع علامة ، يجب على المعلم ليس فقط التركيز على الإجابة المقدمة هنا ، ولكن يجب أن يأخذ في الاعتبار كل فرضية ، وتقييم التفكير البيولوجي للطلاب ، ومنطق تفكيرهم ، وأصالة الأفكار ، وما إلى ذلك. يُنصح بتعريف الطلاب بالإجابة المقدمة.
كما نعلم بالفعل ، تتكون الخلية من مواد كيميائيةالعضوية وغير العضوية. المواد غير العضوية الرئيسية التي تتكون منها الخلية هي الأملاح والماء.
الماء كعنصر من مكونات الحياة
الماء هو المكون السائد لجميع الكائنات الحية. يتم تنفيذ الوظائف البيولوجية الهامة للمياه خصائص فريدة من نوعهاجزيئاته ، ولا سيما وجود ثنائيات القطب ، مما يجعل من الممكن حدوث الروابط الهيدروجينية بين الخلايا.
بفضل جزيئات الماء في جسم الكائنات الحية ، تحدث عمليات التثبيت الحراري والتنظيم الحراري. تحدث عملية التنظيم الحراري بسبب السعة الحرارية العالية لجزيئات الماء: تغيرات درجة الحرارة الخارجية لا تؤثر على تغيرات درجة الحرارة داخل الجسم.
بفضل الماء ، الأعضاء جسم الانسانتحتفظ بمرونتها. الماء هو أحد المكونات الرئيسية لسوائل التشحيم اللازمة لمفاصل الفقاريات أو كيس التامور.
يتم تضمينه في المخاط مما يسهل حركة المواد عبر الأمعاء. الماء هو أحد مكونات الصفراء والدموع واللعاب.
الأملاح والمواد غير العضوية الأخرى
تحتوي خلايا الكائن الحي ، بالإضافة إلى الماء ، على مواد غير عضوية مثل الأحماض والقواعد والأملاح. معظم أهميةفي حياة الجسم ، Mg2 + ، H2PO4 ، K ، CA2 ، Na ، C1-. أحماض ضعيفةضمان مستقر البيئة الداخليةخلايا (قلوية قليلاً).
يمكن أن يكون تركيز الأيونات في المادة بين الخلايا وداخل الخلية مختلفًا. لذلك ، على سبيل المثال ، تتركز أيونات Na + فقط في السائل بين الخلايا ، بينما يوجد K + حصريًا في الخلية.
لا يؤدي الانخفاض الحاد أو الزيادة في عدد أيونات معينة في تكوين الخلية إلى اختلال وظيفتها فحسب ، بل يؤدي أيضًا إلى الوفاة. على سبيل المثال ، يؤدي انخفاض كمية الكالسيوم في الخلية إلى حدوث تشنجات داخل الخلية وموتها الإضافي.
غالبًا ما تتفاعل بعض المواد غير العضوية مع الدهون والبروتينات والكربوهيدرات. لذا مثال رئيسيهي مركبات عضوية تحتوي على الفوسفور والكبريت.
الكبريت ، وهو جزء من جزيئات البروتين ، مسؤول عن تكوين الروابط الجزيئية في الجسم. بفضل تركيب الفوسفور والمواد العضوية ، يتم إطلاق الطاقة من جزيئات البروتين.
أملاح الكالسيوم
تساهم أملاح الكالسيوم في التطور الطبيعي لأنسجة العظام ، فضلاً عن عمل الدماغ والحبل الشوكي. يتم استقلاب الكالسيوم في الجسم بسبب فيتامين د. زيادة أو نقص أملاح الكالسيوم يؤدي إلى خلل وظيفي في الجسم.
