Амонякът принадлежи към група химикали. Производство на амоняк в промишлеността. Получаване на амоняк в лаборатория
амоняк -NH 3
Амонякът (на европейските езици името му звучи като "амоняк") дължи името си на оазиса Амон в Северна Африкаразположен на кръстопътя на керванските пътища. В горещ климат уреята (NH 2) 2 CO, съдържаща се в животинските отпадъци, се разлага особено бързо. Един от продуктите на разграждане е амонякът. Според други източници амонякът е получил името си от древноегипетската дума амоняк. Така се наричат хората, почитащи бог Амон. По време на своите ритуални обреди те смъркали амоняк NH 4 Cl, който при нагряване изпарява амоняка.
1. Структурата на молекулата
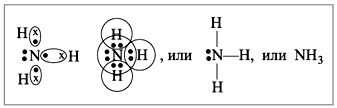
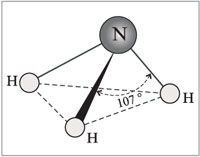
Молекулата на амоняка има формата на триъгълна пирамида с азотен атом на върха. Три несдвоени р-електрона на азотния атом участват в образуването на полярни ковалентни връзки с 1s-електрони на три водородни атома (N-H връзки), четвъртата двойка външни електрони е несподелена, може да образува донорно-акцепторна връзка с водород йон, образувайки амониев йон NH 4 + .
Преглед химическа връзка: ковалентен полярен, три единичниσ - N-H връзка сигма
2. Физични свойства на амоняка
При нормални условия- безцветен газ с остър характерен мирис (мирис на амоняк), почти два пъти по-лек от въздуха, отровен.Според физиологичния ефект върху организма принадлежи към групата на веществата със задушаващо и невротропно действие, които при вдишване могат да причинят токсичен белодробен оток и тежки увреждания. нервна система. Амонячните пари силно дразнят лигавиците на очите и дихателните органи, както и кожата. Това е, което възприемаме като остра миризма. Амонячните пари причиняват обилно сълзене, болка в очите, химически изгаряния на конюнктивата и роговицата, загуба на зрение, пристъпи на кашлица, зачервяване и сърбеж на кожата. Разтворимостта на NH3 във вода е изключително висока – около 1200 обема (при 0 °C) или 700 обема (при 20 °C) в обем вода.
3.
|
В лабораторията |
В индустрията |
|
За получаване на амоняк в лабораторията се използва действието на силни основи върху амониеви соли: NH 4 Cl + NaOH = NH 3 + NaCl + H 2 O (NH 4) 2 SO 4 + Ca(OH) 2 = 2NH 3 + CaSO 4 + 2H 2 O Внимание!Амониевият хидроксид е нестабилна основа, разлага се: NH 4 OH ↔ NH 3 + H 2 O Когато получавате амоняк, дръжте епруветката - приемника с главата надолу, тъй като амонякът е по-лек от въздуха: |
Промишленият метод за производство на амоняк се основава на директното взаимодействие на водород и азот: N 2 (g) + 3H 2 (g) ↔ 2NH 3 (g) + 45.9kДж Условия: катализатор - поресто желязо температура - 450 - 500 ˚С налягане - 25 - 30 MPa Това е така нареченият процес на Хабер (немски физик, разработил физико-химичните основи на метода). |
4. Химични свойстваамоняк
За амоняка реакциите са характерни:
- с промяна в степента на окисление на азотния атом (окислителни реакции)
- без промяна на степента на окисление на азотния атом (добавяне)
|
Реакции с промяна в степента на окисление на азотния атом (окислителни реакции) N-3 → N 0 → N +2 NH3-силен редуциращ агент. |
|
с кислород 1. Изгаряне на амоняк (при нагряване) 4 NH 3 + 3 O 2 → 2 N 2 + 6 H 2 0 2. Каталитично окисление на амоняк (катализаторПт – Rh, температура) 4NH3 + 5O2 → 4NO + 6H2O Видео - Експеримент "Окисляване на амоняк в присъствието на хромен оксид" |
|
с метални оксиди 2 NH 3 + 3CuO \u003d 3Cu + N 2 + 3 H 2 O |
|
със силни оксиданти 2 NH 3 + 3 Cl 2 \u003d N 2 + 6 HCl (при нагряване) |
|
амонякът е крехко съединение, разлага се при нагряване 2NH3 ↔ N2 + 3H2 |
|
Реакции без промяна на степента на окисление на азотния атом (добавяне - Образуване на амониевия йон NH4+според донорно-акцепторния механизъм) Видео - Експеримент "Качествена реакция на амоняк" Видео - Експеримент "Дим без огън" Видео - Експеримент "Взаимодействие на амоняк с концентрирани киселини" Видео - Експеримент "Фонтан" Видео - Експеримент "Разтваряне на амоняк във вода" |
5. Приложение на амоняк
По обем на производство амонякът заема едно от първите места; годишно по света получават около 100 милиона тона от това съединение. Амонякът се произвежда в течна форма или под формата на воден разтвор - амонячна вода, който обикновено съдържа 25% NH 3 . Освен това се използват огромни количества амоняк за производство на азотна киселинакойто отива към производство на торовеи много други продукти. Амонячната вода се използва и директно като тор, а понякога нивите се поливат от резервоари директно с течен амоняк. От амоняк получават различни амониеви соли, урея, уротропин. Неговата също се използва като евтин хладилен агентв индустриални хладилни системи.
Използва се и амоняк за производство на синтетични влакна, например, найлон и капрон. AT лека промишленосттой използва се при почистване и боядисване на памук, вълна и коприна. В масло химическа индустрияамонякът се използва за неутрализиране на киселинните отпадъци, а при производството на естествен каучук амонякът помага да се запази латексът по време на транспортирането му от плантацията до фабриката. Амонякът се използва и при производството на сода по метода на Солвей. В стоманодобивната промишленост амонякът се използва за азотиране - насищане на повърхностните слоеве на стоманата с азот, което значително повишава нейната твърдост.
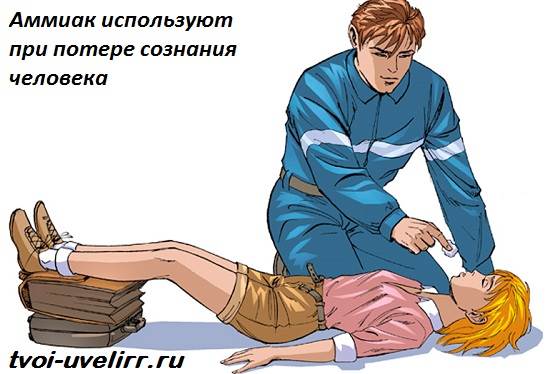
Лекарите използват водни разтвори на амоняк (амоняк) в ежедневната практика: памучен тампон, потопен в амоняк, вади човек от припадък. За хората амонякът в такава доза не е опасен.
СИМУЛАТОРИ
Симулатор №1 "Изгаряне на амоняк"
Симулатор №2 "Химични свойства на амоняка"
ЗАДАЧИ ЗА ЗАТКРОЙВАНЕ
№1. Извършете трансформации по схемата:
а) Азот → Амоняк → Азотен оксид (II)
б) Амониев нитрат → Амоняк → Азот
в) Амоняк → Амониев хлорид → Амоняк → Амониев сулфат
За OVR съставете електронен баланс, за RIO пълни йонни уравнения.номер 2. Напишете четири уравнения химична реакцияв резултат на което се образува амоняк.
Венчелистчетата стават зелени и - стават черни.
Цветарите, както се казва, вземат бележка. Въпреки това, амонякполезни в други области на дейност. Научаваме останалите свойства на веществото, запознаваме се с начините на неговото приложение.
Свойства на амоняка
Когато работите с амонячни пари, трябва да внимавате. При определена концентрация сместа на реагента с въздуха е експлозивна.
Освен това газът е токсичен. "Общуването" с него е изпълнено с нервни разстройства, загуба на слуха, частична загуба на паметта, помътняване на лещите. Тези симптоми се наблюдават при хора, работещи в производството на амоняк.
Амонячните пари винаги се втурват нагоре, защото газът е по-лек от въздуха. Веществото е газ при нормални условия. Амонякът се втечнява за транспортиране и продажба.
За това трябва високо кръвно налягане. Вземете безводен концентрат. За него има 6221-90 GOST.
Втечнен амонякв съдовете обаче има газообразна фаза. Под налягане и двете състояния на материята са в равновесие.
В този случай температурата трябва да е под критичната, както и налягането. Ако има повече от 132 градуса и 11 мегапаскала, балансът ще бъде нарушен.
Коефициентът на обемна компресия на веществото е няколко пъти по-малък от коефициента на разширение.
Ако съдът се напълни догоре, повишаването на температурата може да доведе до налягане от 52 мегапаскала.
Това е достатъчно, за да се счупят металните шевове на съдържащия съд. Съответно ще има експлозия.
От амонячен концентрат можете да получите разтвор на амоняквсякаква интензивност. Въпреки това, безводната версия също е полезна за човечеството.
Например, това е един от торовете. Освен това в веществото присъства само водород. Последните 3 атома, тоест газовата формула е следната: - NH3.
Това съдържание на водород е причината за отличната разтворимост на амоняка във вода. Други газове не могат да се похвалят с това.
Между амоняка и водата се образуват силни водородни връзки. Колкото по-наситен е разтворът, толкова по-големи са неговите свойства на разтваряне.
За тях веществото се конкурира с етилов алкохол, с единствената разлика, че последният е от органичен произход.
Така, воден разтвор на амоняк, както и концентрат, са способни да разтварят метали от алкални и алкалоземни групи.
Реакцията води до тъмносини течности. Това е резултат от йонизация и солватация на валентни електрони.
Последното понятие означава електростатичен контакт между молекулите на разтворените метали и амоняка.
От амоняк миризма на амонякидва от нищото. Агентът е воден разтвор на амониев хидроксид.
Това е, амонякът си е амонякалкохол. Амониевият хидроксид се открива и в урината, както и в продуктите на органично разлагане.
Ето защо, например, гниещите маси от дъното на блатата миришат неприятно. Те разлагат остатъците от растения, риби,.
В същите езера амонякът естествено се смесва с вода. В разтвора присъства ОН група.
Това означава, че сместа е способна на алкална реакция, е слаба основа. Разтваря героя и алкохол. Амонякнеслучайно смесен с него в амоняк.
В концентрирана форма водородният нитрид силно пречупва светлината, тоест променя посоката на нейните лъчи.
Друго любопитно свойство на героя на статията кипи минусови температури. Трябва да е около 34 под нулата.
Ако намалите температурата до 78 градуса, течността ще се втвърди напълно. Получават се белезникави люспи, подобни на сняг. веществата имат правилна, симетрична форма.
Добив на амоняк
Производство на амонякнамалени до 100 000 000 тона годишно. Извлича се приблизително същото количество хлор. В същото време амонякът е по-малко токсичен.
В посочения обем амоняквключва вещество, извлечено от естествени източници на азот и синтезирано при условия.
Индустриалният метод се основава на комбинацията от водород и азот. Амонякот тях се получава при температура не по-ниска от 500 градуса по Целзий.
Друго условие: - налягане от 350 атмосфери. Без катализатор не може. Той ускорява бавната реакция, без да навлиза в нея.
Ролята на катализатор обикновено се изпълнява от гъба. От по-скъпите асистенти се избира оксид или.
Крайният добив на продукта по време на взаимодействието на прости вещества е приблизително 30-35%.
Това е максимумът, при възможно най-ниската температура и най-високото налягане. Именно този дует осигурява ефективността на реакцията.
При по-ниската температурна лента обаче скоростта на процеса намалява. Ако включите топлината, частично ще останете без амонякно ще го получите по-бързо.
Синтетичният метод за производство на амоняк практически не оставя шанс за извличането му в природата от разпадните продукти на органичните вещества. Този процес е дълъг.
Амоняксе образува, но бързо се изпарява. В капаните земната корагазът е рядък.
Обикновено амонякът се изпарява малко по малко, което прави естествените находища неликвидни.
Приложение на амоняк
Приложениевещества в селскостопанския сектор вече бяха споменати. Сега нека да преминем към индустрията за красота, като си припомним за амоняк за коса.
Тук припомняме, че разтворът на дадено вещество е слаба основа. Оттук и назначението: - да се осигурят алкални Ph бои, в района на 10.
Такава среда допринася за набъбването на косата, което предизвиква реакцията на разлагане на водороден прекис.
Последният е избистрител, следователно задължително се използва в нюанси на русо.
Съществува боя без амоняк. Въпреки това, производителите са частично хитри. Вместо чисто веществосе прилагат неговите производни.
Те също повишават Ph до алкално ниво, но са по-скъпи. Съответно и безамонячна боя за косаизисква разходи.

Потребителите обаче са готови за тях, за да спасят косата си. Факт е, че чистият амоняк отваря порите на косата по-силно.
Те започват да приличат на гъба, чиято повърхност може да се изглади само със скъпа силиконова козметика, която запълва празнините.
От храна изразени алкални -. За производството му, също насочен синтез на амоняк.
Произвежда се и за получаване на азот киселини. Амонякпревърнат в азотен оксид.
Последният се окислява до диоксид. След това оксидите се абсорбират от водата. Така го получават.
Амонячна формула, както вече беше споменато, е в основата на създаването на експлозивни вещества.
Веществото е необходимо и при производството на хладилно оборудване. Действието му се основава на изпарение втечнен газ. В същото време се абсорбира много топлина, която всъщност осигурява прохлада.
В бижутата амонякът също е включен. Използва се за почистване на продукти от след полиране с паста.
Нуждата на човечеството от амоняк отразява тенденцията в производството му. Още преди 30 години са се образували 70 000 000 тона реагент годишно.
Сега, както е споменато в главата „Производство“, те са 100 000 000. Само лидерите на производството не са се променили. Това все още са САЩ и сега,.
В справочниците от минали години естествено се появява СССР. Че цената на веществото се е променила и няма нужда да гадаете. Нека се запознаем с текущата цена на амоняка.
Цена на амоняк
купете амонякможе да бъде на едро и дребно. Големите доставки се извършват, като правило, в тонове.
За 1000 килограма искат от 19 000 рубли. Малките предприятия са готови да продават на килограм, като искат около 30 рубли.
На дребно рядко се предлагат килограми, тонове изобщо не се предлагат. Нека проучим ценовата листа на аптеките, като обърнем внимание на амоняка.
Обикновено се налива в бутилки от 40 милилитра. Такъв обем струва от 15 до 31 рубли.
Интересното е, че ако има бутилки от 25 и 100 милилитра, те струват приблизително еднакви, от 13 до 55 рубли.
В същото време си струва да се има предвид, че алкохолният разтвор е 10 процента. Втечненият амоняк при доставки на едро е концентриран.
Следователно индустриалците трябва да помислят за правилното транспортиране на стоки. Има специални полуремаркета с цистерни.
Възрастта на контейнерите не трябва да надвишава 30 години. Съставът за резервоари също е важен, тъй като амонякът разтваря много метали.
Също така е необходимо да се вземе предвид налягането в резервоара, температурата. Ето защо, до рекламите за продажба на реагента, като правило, има и предложения за продажба и наем на полуремаркета. Без тях не може.
Течност
Амоняк- NH3, водороден нитрид, при нормални условия - безцветен газ с остър характерен мирис (мирис на амоняк), почти два пъти по-лек от въздуха, отровен. Разтворимостта на NH3 във вода е изключително висока - около 1200 обема (при 0°C) или 700 обема (при 20°C) в обем вода. AT охлажданесе нарича R717, където R е хладилен агент (хладилен агент), 7 е типът хладилен агент (неорганично съединение), 17 е молекулното тегло.
Молекулата на амоняка има формата на триъгълна пирамида с азотен атом на върха. Три несдвоени р-електрона на азотния атом участват в образуването на полярни ковалентни връзки с 1s-електрони на три водородни атома (N-H връзки), четвъртата двойка външни електрони е несподелена, може да образува донорно-акцепторна връзка с водород йон, образувайки амониев йон NH 4 + . Поради факта, че несвързващият двуелектронен облак е строго ориентиран в пространството, молекулата на амоняка има висока полярност, което води до добрата й разтворимост във вода.
В течния амоняк молекулите са свързани чрез водородни връзки. Сравнението на физичните свойства на течния амоняк с вода показва, че амонякът има по-ниски точки на кипене (t bale -33,35 ° C) и точки на топене (t pl -77,70 ° C), както и повече ниска плътност, вискозитет (вискозитетът на течния амоняк е 7 пъти по-малък от вискозитета на водата), проводимост и диелектрична константа. Това до известна степен се обяснява с факта, че силата на тези връзки в течния амоняк е значително по-ниска от тази на водата, както и с факта, че в молекулата на амоняка има само една двойка несподелени електрони, за разлика от две двойки във водната молекула, което не позволява образуването на широка мрежа от водородни връзки между няколко молекули. Амонякът лесно преминава в безцветна течност с плътност 681,4 kg / m³, която силно пречупва светлината. Подобно на водата, течният амоняк е силно свързан, главно чрез образуването на водородни връзки. Течният амоняк практически не провежда електричество. Течният амоняк е добър разтворител за много Голям бройорганични, както и за много неорганични съединения. Твърдият амоняк е безцветни кубични кристали.
Химични свойства
- Поради наличието на несподелена електронна двойка, амонякът действа като нуклеофил или комплексообразуващ агент в много реакции. И така, той свързва протон, образувайки амониев йон:
- Воден разтвор на амоняк ("амоняк") има леко алкална реакция поради процеса:
- При взаимодействие с киселини се получават съответните амониеви соли:
- Амонякът също е много слаба киселина(10 000 000 000 пъти по-слаба от водата), способна да образува соли с метали - амиди. Съединенията, съдържащи NH 2 − йони, се наричат амиди, NH 2− - имиди и N 3− - нитриди. Амидите на алкални метали се получават чрез въздействие върху тях с амоняк:
В резултат на определени реакции в течен амоняк се образуват амиди, имиди и нитриди на редица метали. Нитридите могат да бъдат получени чрез нагряване на метали в азотна атмосфера.
Металните амиди са аналози на хидроксидите. Тази аналогия се подсилва от факта, че йоните OH - и NH 2 -, както и молекулите на H 2 O и NH 3 са изоелектронни. Амидите са по-силни основи от хидроксидите и следователно претърпяват необратима хидролиза във водни разтвори:
NaNH 2 + H 2 O → NaOH + NH 3 CaNH + 2H 2 O → Ca(OH) 2 + NH 3 Zn 3 N 2 + 6H 2 O → 3Zn(OH) 2 + 2NH 3
и в алкохоли:
KNH 2 + C 2 H 5 OH → C 2 H 5 OK + NH 3
Подобно на водните разтвори на алкали, амонячните разтвори на амидите провеждат добре електрически ток, което се дължи на дисоциация:
MNH 2 → M + + NH 2 -
Фенолфталеинът в тези разтвори става червен; когато се добавят киселини, те се неутрализират. Разтворимостта на амидите се променя в същата последователност като разтворимостта на хидроксидите: LiNH2 е неразтворим, NaNH2 е слабо разтворим, KNH2, RbNH2 и CsNH2 са силно разтворими.
- При нагряване амонякът проявява редуциращи свойства. И така, той изгаря в кислородна атмосфера, образувайки вода и азот. Окисляването на амоняк с въздух върху платинен катализатор дава азотни оксиди, които се използват в промишлеността за производство на азотна киселина:
Използването на амоняк NH 4 Cl за почистване на металната повърхност от оксиди по време на тяхното запояване се основава на редуциращата способност на NH 3:
3CuO + 2NH 4 Cl → 3Cu + 3H 2 O + 2HCl + N 2
При окисляване на амоняк с натриев хипохлорит в присъствието на желатин се получава хидразин:
2NH3 + NaClO → N2H4 + NaCl + H2O
- Халогените (хлор, йод) образуват опасни експлозиви с амоняка - азотни халиди (азотен хлорид, азотен йодид).
- С халоалкани амонякът влиза в реакция на нуклеофилно присъединяване, образувайки заместен амониев йон (метод за получаване на амини):
- С карбоксилните киселини, техните анхидриди, халогениди, естери и други производни дава амиди. С алдехиди и кетони - Шифови бази, които могат да се редуцират до съответните амини (редукционно аминиране).
- При 1000 °C амонякът реагира с въглища, образувайки HCN и частично се разлага на азот и водород. Той може също да реагира с метан, образувайки същата циановодородна киселина:
История на имената
Амонякът (на европейските езици името му звучи като "амоняк") дължи името си на оазиса Амон в Северна Африка, разположен на кръстопътя на пътищата на караваните. В горещ климат уреята (NH 2) 2 CO, съдържаща се в животинските отпадъци, се разлага особено бързо. Един от продуктите на разграждане е амонякът. Според други източници амонякът е получил името си от древноегипетската дума амоняк. Така се наричат хората, почитащи бог Амон. По време на своите ритуални обреди те смъркали амоняк NH 4 Cl, който при нагряване изпарява амоняка.
Течен амоняк
Течният амоняк, макар и в малка степен, се разпада на йони, в които се проявява неговата прилика с водата:
2NH 3 → NH 4 + + NH 2 -
Константата на самойонизация на течния амоняк при −50 °C е приблизително 10 −33 (mol/l)².
Течният амоняк, подобно на водата, е силен йонизиращ разтворител, в който се разтварят редица активни метали: алкални, алкалоземни, Mg, Al, както и Eu и Yb. Разтворимостта на алкалните метали в течен NH3 е няколко десетки процента. Течният амоняк NH3 също разтваря някои интерметални съединения, съдържащи алкални метали, като Na 4 Pb 9 .
Разредените разтвори на метали в течен амоняк са оцветени Син цвят, концентрираните разтвори имат метален блясък и са подобни на бронза. Когато амонякът се изпари, се отделят алкални метали чиста форма, и алкалоземни - под формата на комплекси с амоняк [E (NH 3) 6] с метална проводимост. При леко нагряване тези комплекси се разлагат на метал и NH3.
Металът, разтворен в NH3, постепенно реагира, за да образува амид:
2Na + 2NH 3 → 2NaNH 2 + H 2 -
Металните амиди, получени при реакцията с амоняк, съдържат отрицателен йон NH 2 - , който също се образува при самойонизацията на амоняка. По този начин металните амиди са аналози на хидроксидите. Скоростта на реакцията се увеличава при преминаване от Li към Cs. Реакцията се ускорява значително в присъствието дори на малки примеси от Н2О.
Метално-амонячните разтвори имат метална електрическа проводимост; в тях металните атоми се разпадат на положителни йони и солватирани електрони, заобиколени от молекули NH3. Метално-амонячните разтвори, съдържащи свободни електрони, са най-силните редуциращи агенти.
сложно образуване
Благодарение на техните електронодонорни свойства, молекулите на NH3 могат да влизат в комплексни съединения като лиганд. По този начин въвеждането на излишък от амоняк в разтвори на соли на d-метали води до образуването на техните аминокомплекси:
CuSO 4 + 4NH 3 → SO 4 Ni(NO 3) 2 + 6NH 3 → (NO 3) 2
Комплексообразуването обикновено е придружено от промяна в цвета на разтвора, така че при първата реакция синият цвят (CuSO 4) се превръща в тъмно син (цвят на комплекса), а при втората реакция цветът се променя от зелен ( Ni (NO 3) 2) до синьо-виолетово. Най-силните комплекси с NH3 образуват хром и кобалт в степен на окисление +3.
Биологична роля
Амонякът е крайният продукт на метаболизма на азота при хора и животни. Образува се по време на метаболизма на протеини, аминокиселини и други азотни съединения. Той е силно токсичен за тялото, така че по-голямата част от амоняка по време на цикъла на орнитин се превръща от черния дроб в по-безвредно и по-малко токсично съединение - урея (карбамид). След това уреята се отделя от бъбреците и част от уреята може да се преобразува от черния дроб или бъбреците обратно в амоняк.
Амонякът може също да се използва от черния дроб за обратния процес, ресинтеза на аминокиселини от амоняк и аминокиселинни кето аналози. Този процес се нарича "редуктивно аминиране". Значи от киселец оцетна киселинаполучава се аспарагин, от α-кетоглутарин - глутамин и др.
Физиологично действие
Според физиологичния ефект върху организма принадлежи към групата на веществата със задушаващо и невротропно действие, които при вдишване могат да причинят токсичен белодробен оток и тежки увреждания на нервната система. Амонякът има както локален, така и резорбтивен ефект.
Амонячните пари силно дразнят лигавиците на очите и дихателните органи, както и кожата. Това е, което възприемаме като остра миризма. Амонячните пари причиняват обилно сълзене, болка в очите, химически изгаряния на конюнктивата и роговицата, загуба на зрение, пристъпи на кашлица, зачервяване и сърбеж на кожата. Когато втечненият амоняк и неговите разтвори влязат в контакт с кожата, възниква усещане за парене, възможно е химическо изгаряне с мехури и язви. Освен това втечненият амоняк абсорбира топлината по време на изпарението и при контакт с кожата се получават различни степени на измръзване. Миризмата на амоняк се усеща при концентрация от 37 mg/m³.
В крайна сметка допустима концентрациявъв въздуха работна зона производствени помещенияе 20 mg/m³. Ето защо, ако се усети миризмата на амоняк, тогава вече е опасно да работите без защитно оборудване. Дразненето на фаринкса се проявява, когато съдържанието на амоняк във въздуха е 280 mg / m³, окото - 490 mg / m³. Когато е изложен на много високи концентрации, амонякът причинява кожни лезии: 7-14 g/m³ - еритематозен, 21 g/m³ или повече - булозен дерматит. Токсичен белодробен оток се развива при излагане на амоняк за един час с концентрация 1,5 g / m³. Краткосрочната експозиция на амоняк в концентрация от 3,5 g/m³ или по-бързо води до развитие на общи токсични ефекти. Максимално допустимата концентрация на амоняк в атмосферен въздух селищае равно на: среднодневна 0,04 mg/m³; максимална единична доза 0,2 mg/m³.
В света максималната концентрация на амоняк в атмосферата (повече от 1 mg / m³) се наблюдава в Индо-Гангската равнина, в Централната долина на САЩ и в района на Южен Казахстан.
Приложение
Амонякът е един от най-важните продукти на химическата промишленост, годишното му световно производство достига 150 милиона тона. Използва се главно за производство на азотни торове (амониев нитрат и сулфат, урея), експлозиви и полимери, азотна киселина, сода (амонячен метод) и други химически продукти. Като разтворител се използва течен амоняк.
В хладилната техника се използва като хладилен агент (R717)
В медицината 10% разтвор на амоняк, често наричан амоняк, се използва при припадъци (за стимулиране на дишането), за стимулиране на повръщане, както и външно - невралгия, миозит, ухапвания от насекоми, лечение на ръцете на хирурга. При неправилно приложениеможе да причини изгаряния на хранопровода и стомаха (в случай на приемане на неразреден разтвор), рефлекторно спиране на дишането (при вдишване във високи концентрации).
Прилага се локално, инхалация и вътре. За да възбудите дишането и да извадите пациента от припадък, внимателно донесете малко парче марля или памучна вата, навлажнена с амоняк, към носа на пациента (за 0,5-1 s). Вътре (само в разплод) за предизвикване на повръщане. При ухапвания от насекоми - под формата на лосиони; с невралгия и миозит - триене с амонячен линимент. В хирургическата практика те се отглеждат в топла преварена вода и измиват ръцете си.
Тъй като е слаба основа, тя неутрализира киселините при взаимодействие.
Физиологичният ефект на амоняка се дължи на острата миризма на амоняк, която дразни специфични рецептори на носната лигавица и възбужда дихателните и вазомоторните центрове на мозъка, причинявайки учестено дишане и повишаване на кръвното налягане.
Касова бележка
Промишленият метод за производство на амоняк се основава на директното взаимодействие на водород и азот:
N 2 (g) + 3H 2 (g) ↔ 2NH 3 (g) + 45,9 kJ
Това е така нареченият процес на Хабер (немски физик, разработил физико-химичните основи на метода).
Реакцията протича с отделяне на топлина и намаляване на обема. Следователно, въз основа на принципа на Le Chatelier, реакцията трябва да се проведе при ниски температуриа при високи налягания - тогава равновесието ще се измести надясно. Скоростта на реакцията при ниски температури обаче е незначителна, а при високи температури скоростта на обратната реакция се увеличава. Провеждането на реакцията при много високо налягане изисква създаването на специална, издържаща високо наляганеоборудване и следователно голяма инвестиция. В допълнение, равновесието на реакцията, дори при 700 °C, се установява твърде бавно за практическото му използване.
Използването на катализатор (поресто желязо с примеси от Al 2 O 3 и K 2 O) направи възможно ускоряването на постигането на равновесно състояние. Интересното е, че в търсенето на катализатор за тази роля са изпробвани повече от 20 хиляди различни вещества.
Като се вземат предвид всички горепосочени фактори, процесът на получаване на амоняк се извършва при следните условия: температура 500 °C, налягане 350 атмосфери, катализатор. Добивът на амоняк при такива условия е около 30%. AT индустриална средаизползва се принципът на циркулация - амонякът се отстранява чрез охлаждане, а нереагиралите азот и водород се връщат в колоната за синтез. Това се оказва по-икономично от постигането на по-висок добив на реакция чрез увеличаване на налягането.
За получаване на амоняк в лабораторията се използва действието на силни основи върху амониеви соли:
NH 4 Cl + NaOH = NH 3 + NaCl + H 2 O.
Обикновено се получава по лабораторен път, получава се чрез слабо нагряване на смес от амониев хлорид с гасена вар. 2NH 4 Cl + Ca(OH) 2 = CaCl 2 + 2NH 3 + 2H 2 O
За да се изсуши амоняк, той се прекарва през смес от вар и сода каустик.
Много сух амоняк може да се получи чрез разтваряне на метален натрий в него и последваща дестилация. Това се прави най-добре в система, изработена от метал под вакуум. Системата трябва да може да издържа на високо налягане стайна температураналягане наситени париамоняк около 10 атмосфери). В промишлеността амонякът се изсушава в абсорбционни колони.
Амоняк в медицината
При ухапвания от насекоми амонякът се прилага външно под формата на лосиони. Възможен странични ефекти: При продължителна експозиция (вдишване), амонякът може да причини рефлекторно спиране на дишането. Локалното приложение е противопоказано при дерматити, екземи и др кожни заболявания, както и при открити травматични увреждания на кожата. При инхалационно приложение - рефлексно спиране на дишането, при локално приложение - дразнене, дерматит, екзема на мястото на приложение. Локално приложение е възможно само върху непокътната кожа. В случай на случайно увреждане на лигавицата на окото, изплакнете с вода (за 15 минути на всеки 10 минути) или с 5% разтвор борна киселина. Масла и мехлеми не се използват. При увреждане на носа и фаринкса - 0,5% разтвор лимонена киселинаили натурални сокове. В случай на поглъщане, пийте вода, плодов сок, мляко, за предпочитане 0,5% разтвор на лимонена киселина или 1% разтвор на оцетна киселина, докато съдържанието на стомаха се неутрализира напълно. Взаимодействие с другите лекарстванеизвестен. (Инструкция за употреба)
Във вода
- Халогените (хлор, йод) образуват опасни експлозиви с амоняка - азотни халиди (азотен хлорид, азотен йодид).
- С халоалкани амонякът влиза в реакция на нуклеофилно присъединяване, образувайки заместен амониев йон (метод за получаване на амини):
- С карбоксилни киселини, техните анхидриди, киселинни халиди, естери и други производни дава амиди. С алдехиди и кетони - Шифови бази, които могат да се редуцират до съответните амини (редукционно аминиране).
- При 1000 °C амонякът реагира с въглища, образувайки циановодородна киселина HCN и частично се разлага на азот и водород. Той може също да реагира с метан, образувайки същата циановодородна киселина:
История на имената
Амонякът (на европейските езици името му звучи като "амоняк") дължи името си на оазиса Амон в Северна Африка, разположен на кръстопътя на пътищата на караваните. В горещ климат уреята (NH 2) 2 CO, съдържаща се в животинските отпадъци, се разлага особено бързо. Един от продуктите на разграждане е амонякът. Според други източници амонякът е получил името си от древноегипетската дума амоняк. Така се наричат хората, почитащи бог Амон. По време на своите ритуални обреди те смъркали амоняк NH 4 Cl, който при нагряване изпарява амоняка.
Течен амоняк
Течният амоняк, макар и в малка степен, се разпада на йони (автопротолиза), в което се проявява неговото сходство с водата:
Константата на самойонизация на течния амоняк при −50 °C е приблизително 10 −33 (mol/l)².
Металните амиди, получени при реакцията с амоняка, съдържат отрицателния NH 2 − йон, който също се образува при самойонизацията на амоняка. По този начин металните амиди са аналози на хидроксидите. Скоростта на реакцията се увеличава при преминаване от Li към Cs. Реакцията се ускорява значително в присъствието дори на малки примеси от Н2О.
Метално-амонячните разтвори имат метална електрическа проводимост; в тях металните атоми се разпадат на положителни йони и солватирани електрони, заобиколени от молекули NH3. Метално-амонячните разтвори, съдържащи свободни електрони, са най-силните редуциращи агенти.
сложно образуване
Благодарение на техните електронодонорни свойства, молекулите на NH3 могат да влизат в комплексни съединения като лиганд. По този начин въвеждането на излишък от амоняк в разтвори на соли на d-метали води до образуването на техните аминокомплекси:
Образуването на комплекс обикновено е придружено от промяна в цвета на разтвора. И така, при първата реакция синият цвят (CuSO 4) се превръща в тъмно син (цвят на комплекса), а при втората реакция цветът се променя от зелен (Ni (NO 3) 2) до синьо-виолетов. Най-силните комплекси с NH3 образуват хром и кобалт в степен на окисление +3.
Биологична роля
Амонякът е крайният продукт на метаболизма на азота при хора и животни. Образува се по време на метаболизма на протеини, аминокиселини и други азотни съединения. Той е силно токсичен за тялото, така че по-голямата част от амоняка по време на цикъла на орнитин се превръща от черния дроб в по-безвредно и по-малко токсично съединение - урея (карбамид). След това уреята се отделя от бъбреците и част от уреята може да се преобразува от черния дроб или бъбреците обратно в амоняк.
Амонякът може да се използва и от черния дроб за обратния процес - ресинтеза на аминокиселини от амоняк и кето аналози на аминокиселини. Този процес се нарича "редуктивно аминиране". Така аспарагиновата киселина се получава от оксалооцетна киселина, глутаминовата киселина се получава от α-кетоглутарова киселина и т.н.
Физиологично действие
Според физиологичния ефект върху организма принадлежи към групата на веществата със задушаващо и невротропно действие, които при вдишване могат да причинят токсичен белодробен оток и тежки увреждания на нервната система. Амонякът има както локален, така и резорбтивен ефект.
Амонячните пари силно дразнят лигавиците на очите и дихателните органи, както и кожата. Това е човек и възприема като остра миризма. Амонячните пари причиняват обилно сълзене, болка в очите, химически изгаряния на конюнктивата и роговицата, загуба на зрение, пристъпи на кашлица, зачервяване и сърбеж на кожата. Когато втечненият амоняк и неговите разтвори влязат в контакт с кожата, възниква усещане за парене, възможно е химическо изгаряне с мехури и язви. Освен това втечненият амоняк абсорбира топлината по време на изпарението и при контакт с кожата се получават различни степени на измръзване. Миризмата на амоняк се усеща при концентрация от 37 mg/m³.
Приложение
Амонякът е един от най-важните продукти на химическата промишленост, годишното му световно производство достига 150 милиона тона. Използва се главно за производство на азотни торове (амониев нитрат и сулфат, урея), експлозиви и полимери, азотна киселина, сода (амонячен метод) и други химически продукти. Като разтворител се използва течен амоняк.
Разходни норми на тон амоняк
Производството на един тон амоняк в Русия изразходва средно 1200 nm³ природен газ, в Европа - 900 nm³.
Беларуският "Гродно Азот" консумира 1200 Nm³ природен газ на тон амоняк, след модернизацията се очаква консумацията да намалее до 876 Nm³.
Украинските производители консумират от 750 Nm³ до 1170 Nm³ природен газ на тон амоняк.
Технологията UHDE твърди потребление от 6,7 - 7,4 Gcal енергийни ресурси на тон амоняк.
Амоняк в медицината
При ухапвания от насекоми амонякът се прилага външно под формата на лосиони. 10% воден разтвор на амоняк е известен като амоняк.
Възможни са нежелани реакции: при продължителна експозиция (вдишване) амонякът може да причини рефлекторно спиране на дишането.
Локалното приложение е противопоказано при дерматит, екзема, други кожни заболявания, както и открити травматични увреждания на кожата.
В случай на случайно увреждане на лигавицата на окото, изплакнете с вода (за 15 минути на всеки 10 минути) или 5% разтвор на борна киселина. Масла и мехлеми не се използват. При поражение на носа и фаринкса - 0,5% разтвор на лимонена киселина или натурални сокове. В случай на поглъщане, пийте вода, плодов сок, мляко, за предпочитане 0,5% разтвор на лимонена киселина или 1% разтвор на оцетна киселина, докато съдържанието на стомаха се неутрализира напълно.
Взаимодействие с други лекарства не е известно.
Производители на амоняк
Производители на амоняк в Русия
| Търговско дружество | 2006 г., хиляди тона | 2007 г., хиляди тона |
|---|---|---|
| АД "Толиатиазот"]] | 2 635 | 2 403,3 |
| ОАО НАК Азот | 1 526 | 1 514,8 |
| АД "Акрон" | 1 526 | 1 114,2 |
| OAO Nevinnomyssky Azot, Nevinnomyssk | 1 065 | 1 087,2 |
| Минудобрения АД (Россош) | 959 | 986,2 |
| АД "АЗОТ" | 854 | 957,3 |
| ОАО "Азот" | 869 | 920,1 |
| ОАО „Кирово-Чепецки хим. комбинирам" | 956 | 881,1 |
| ОАО Череповец Азот | 936,1 | 790,6 |
| ЗАО Куйбишевазот | 506 | 570,4 |
| Газпром Салават нефтехим" | 492 | 512,8 |
| "Минерални торове" (Перм) | 437 | 474,6 |
| OJSC Дорогобуж | 444 | 473,9 |
| ОАО Воскресенски минерални торове | 175 | 205,3 |
| OJSC Щекиноазот | 58 | 61,1 |
| ООО Менделеевск Азот | - | - |
| Обща сума | 13 321,1 | 12 952,9 |
Русия произвежда около 9% от световното производство на амоняк. Русия е един от най-големите износители на амоняк в света. Около 25% от общото производство на амоняк се изнася, което е около 16% от световния износ.
Производители на амоняк в Украйна
- Облаците на Юпитер са съставени от амоняк.
Вижте също
Бележки
Връзки
- //
- // Енциклопедичен речник на Брокхаус и Ефрон: В 86 тома (82 тома и 4 допълнителни). - Санкт Петербург. , 1890-1907.
- // Енциклопедичен речник на Брокхаус и Ефрон: В 86 тома (82 тома и 4 допълнителни). - Санкт Петербург. , 1890-1907.
амоняк. Молекулите на този газ имат формата на пирамида, в един от върховете на която има азотен атом. Те се образуват от водородни връзки и се характеризират със силна полярност. Това обяснява необичайните физични свойства на амоняка: точката му на топене е около -80 градуса. Той е силно разтворим във вода, алкохоли и др органични разтворители.
Приложение на амоняк
Амонякът играе важна роляв индустрията. С негова помощ се азотни торовеприложен в селско стопанство, азотна киселина и дори експлозиви. Амонякът, широко използван от лекарите, също се произвежда с помощта на амоняк. Острата миризма на този газ дразни носната лигавица и стимулира дихателните функции. Амонякизползвани при припадък или алкохолно отравяне. Има и външна употреба на амоняк в медицината. Това е отличен антисептик, с който хирурзите третират ръцете си преди операция.
Амонякът, като продукт от разлагането на амоняка, се използва при запояване на метали. При висока температураамонякът се получава от амоняк, който предпазва метала от образуването на оксиден филм.
Отравяне с амоняк
Амонякът е токсично вещество. Често на работа се случва отравяне с този газ, което е придружено от задушаване, делириум и силно вълнение. Как можете да помогнете на някой, който е в тази ситуация? Първо трябва да изплакнете очите му с вода и да поставите марля, предварително навлажнена със слаб разтвор на лимонена киселина. След това е необходимо да се отстрани от зоната, където се наблюдава висока концентрация на амоняк. Отравяне е възможно при концентрация около 350 mg/m³.
Ако амонякът влезе в контакт с кожата, незабавно измийте засегнатите области с вода. В зависимост от количеството амоняк върху кожата може да има силно зачервяванеили химически изгаряния с мехури.
В заводите, където се произвежда амоняк, са въведени строги мерки Пожарна безопасност. Факт е, че сместа от амоняк и въздух е силно запалима. Контейнерите, в които се съхранява, могат лесно да експлодират при нагряване.
Химични свойства на амоняка
Амонякът реагира с много киселини. В резултат на това взаимодействие се получават различни амониеви соли. При взаимодействие с многоосновни киселини се получават два вида соли (в зависимост от броя молове амоняк).
