Ce substanțe anorganice sunt incluse în compoziție. substante anorganice
După ce ne-am familiarizat cu elementele chimice conținute în organismele vii, să ne întoarcem la studiul substanțelor în care sunt incluse aceste elemente. Printre acestea se numără anorganice (apă, săruri minerale și acizi) și compusi organici(Fig. 1). Cea mai mare parte a masei organismelor vii conține apă.
Apă. Conținutul de apă din organismele vii este de 60-75% din masa lor, iar în unele, cum ar fi meduze, până la 98%. în frunze şi fructe suculente conținutul de apă al plantelor poate ajunge și la 98%.
Cantitatea de apă nu este aceeași țesături diferite si organe. Deci, la o persoană în substanța cenușie a creierului, conținutul său este de 85%, iar în țesutul osos - 22%. Cel mai mare conținut de apă din organism se observă în perioada embrionară (95%) și scade treptat odată cu vârsta. Fără utilizarea apei, o persoană nu poate trăi mai mult de 5-7 zile.
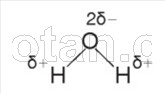
După cum știți deja dintr-un curs de chimie, o moleculă de apă (H 2 0) este formată din doi atomi de hidrogen legați prin legături polare covalente la un atom de oxigen.
Legăturile H–O–H sunt situate la un unghi de 104,5° una față de cealaltă. Oxigenul are o electronegativitate mai mare decât hidrogenul, astfel încât atomul de oxigen atrage perechile de electroni partajate și capătă o sarcină parțial negativă. Atomii de hidrogen capătă o sarcină parțial pozitivă, adică molecula de apă este polar.
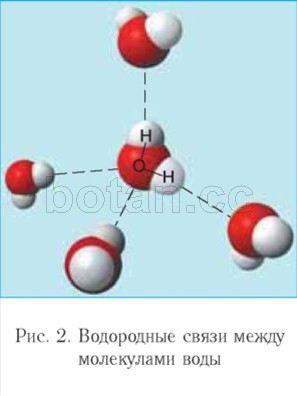
O atracție electrostatică apare între atomul de oxigen al unei molecule de apă și atomul de hidrogen al altei molecule. O astfel de interacțiune
mai slab decât o legătură ionică se numește legătură de hidrogen. Fiecare moleculă de apă, ca un mic magnet, atrage încă patru molecule către sine datorită formării legăturilor de hidrogen (Fig. 2). Datorită formării legăturilor de hidrogen, moleculele de apă sunt conectate între ele. Prin urmare, apa la temperaturi de la 0 ° C la 100 ° C poate reține lichid starea de agregare, în timp ce compușii hidrogen similari (de exemplu, H2S, NH3, HF) sunt gaze.
Rolul biologic al apei în organismele vii este asociat cu proprietățile sale, în primul rând cu dimensiunea mică a moleculelor, polaritatea acestora și capacitatea de a forma legături de hidrogen între ele și cu alți compuși.
Apa este cea care determină volumul celulelor și intracelular (turgul) presiune. Datorită polarității lor, moleculele de apă sunt capabile să formeze așa-numitele învelișuri de hidratare în jurul ionilor și al moleculelor polare. Acest lucru contribuie la separarea particulelor și le împiedică să se lipească, ceea ce este deosebit de important, de exemplu, pentru moleculele de proteine.
Polaritatea moleculelor și capacitatea de a forma legături de hidrogen formează apa solvent universal pentru substanțe polare, mai bun decât majoritatea lichidelor cunoscute. În funcție de solubilitatea în apă, compușii sunt împărțiți în mod convențional în solubili sau hidrofil(din greaca. guidor- apa, fshsha- dragoste), și insolubil, sau hidrofob(din greaca. phobos- frica). Mono- și dizaharidele, multe săruri și acizi minerali, alcoolii inferiori, acizii carboxilici inferiori etc. sunt substanțe hidrofile. Acizii carboxilici superiori, grăsimile și alte substanțe sunt hidrofobe.
Apa este mijlocul de curgere a multora procesele metabolice. Majoritate reacții chimiceîn organism apare tocmai în soluţii apoase. Intrarea și ieșirea substanțelor din celulă se efectuează, de regulă, într-o formă dizolvată. Apa este direct implicată în multe reacții chimice care au loc în celule, inclusiv în procesele de scindare a compușilor organici. Este una dintre materiile prime în reacțiile de fotosinteză. Oxigenul produs în timpul fotosintezei este eliberat atunci când moleculele de apă se descompun.
Apa ca solvent ia parte la fenomenele de osmoză, jucându-se rol importantîn activitatea celulelor corpului. Osmoză- aceasta este mișcarea moleculelor de apă printr-o membrană semipermeabilă (de exemplu, prin membrana citoplasmatică a unei celule) dintr-o zonă cu o concentrație mai mică de substanțe dizolvate (de exemplu, săruri, zaharuri sau uree) într-o zonă cu o concentrație mai mare din aceste substanţe (Fig. 3). Datorită osmozei, concentrațiile de substanțe dizolvate în celulă și mediul extracelular sunt egalizate.
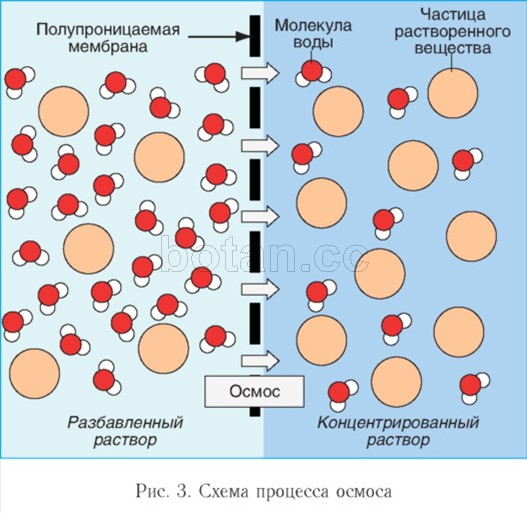
Dacă o soluție și un solvent (de exemplu, apă) sunt separate de o membrană permeabilă selectiv, există o mișcare a moleculelor de solvent prin membrană în soluție. Pentru a preveni intrarea solventului, soluției trebuie aplicată o anumită presiune, care se numește presiune osmotică. Cu cât soluția este mai concentrată, cu atât presiunea osmotică a acesteia este mai mare.
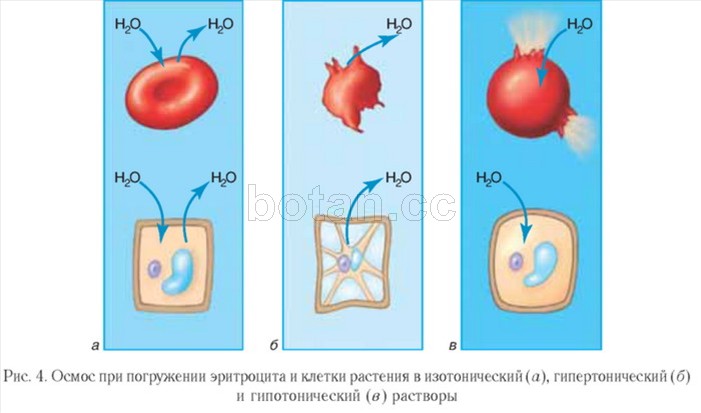
Soluțiile a căror presiune osmotică este aceeași ca în celule se numesc izotonice. Volumul celulelor scufundate în soluții izotonice rămâne neschimbat (Fig. 4, A). Soluțiile izotonice, în special soluția salină fiziologică (o soluție apoasă de NaCl cu o fracție de masă de 0,9%), sunt utilizate în medicină. Sunt utilizate pentru deshidratare severă și pierderi de sânge de către pacienți, pentru a se dizolva medicamente administrat prin injectare.
O soluție a cărei presiune osmotică este mai mare decât în celule se numește hipertonică. Celulele scufundate într-o soluție hipertonă pierd apă și scad în volum, adică se micșorează (Fig. 4, b). Soluția salină hipertonică își găsește utilizare în tratamentul rănilor. Un bandaj de tifon umezit cu o astfel de soluție absoarbe bine puroiul, ceea ce ajută la curățarea și vindecarea rănii.
Imaginea opusă se observă atunci când celulele sunt scufundate într-o soluție hipotonă, în care concentrația de substanțe dizolvate este mai mică decât în celule. În acest caz, apa se năpustește în celulă, celula se umflă și se poate liza, adică se poate sparge (Fig. 4, în).
De asemenea, asociat cu apa regulament regim termic organisme. Apa are o capacitate ridicată de căldură - capacitatea de a absorbi un numar mare de căldură pentru mici schimbări de temperatură. Datorită acestui fapt, apa previne schimbările bruște de temperatură în celule și în organism în ansamblu, chiar și atunci când fluctuațiile de temperatură în mediu inconjurator sunt suficient de mari.
Numărul total de legături de hidrogen dintre moleculele de apă variază în funcție de temperatură. Când gheața se topește, aproximativ 15% din legăturile de hidrogen sunt distruse, iar la 40 ° C - jumătate. La trecerea la starea de vapori, toate legăturile de hidrogen sunt distruse. Când temperatura se schimbă Mediul extern apa absoarbe (sau eliberează) căldură datorită ruperii (sau formării) a numeroase legături de hidrogen. Aceasta explică înaltul căldura specifică apă.
În timpul evaporării apei de către organisme (transpirația la plante, transpirația la mamifere), se consumă multă căldură, ceea ce le protejează de supraîncălzire.
Datorită conductibilității sale termice ridicate, apa oferă distributie uniforma căldură între țesuturile corpului (de exemplu, prin sistemul circulator). Astfel, apa este implicată în reglarea regimului termic al organismului.
săruri minerale și acizi. Sărurile minerale sunt necesare pentru a menține activitatea vitală a celulelor și a corpului în ansamblu. În organismele vii, ele sunt fie în formă dizolvată (disociate în ioni) fie în stare solidă. Din punct de vedere biologic, cei mai importanți dintre ioni sunt cationii K+, Na+, Ca 2+, Mgr + și anionii SG, HCO3, HPO ^, H0PO4.
Conținutul total de săruri minerale în diferite celule variază de la unu la câteva procente. Rolul lor în celulă este variat. Astfel, concentrațiile diferite de ioni de K + și Na + în interiorul și în exteriorul celulelor duc la apariția unei diferențe de potențiale electrice pe membrana citoplasmatică, ceea ce este foarte important pentru transmiterea impulsurilor nervoase, precum și pentru transportul substanțelor prin membrana. Cu o scădere a acestei diferențe, excitabilitatea celulelor scade.
Unii ioni sunt esențiali pentru sinteza substanțelor organice. De exemplu, reziduurile de acid fosforic fac parte din nucleotide și ATP, ionul Fe 2+ face parte din hemoglobină, Mg 2+ este parte din clorofilă etc. Ionii NO3, NHJ sunt surse de atomi de azot, ion SO 2- - atomi de sulf, care sunt necesari organismelor autotrofe pentru sinteza aminoacizilor. Funcția de reglare și activarea multor enzime sunt realizate de ionii de Ca 2+ și Mg 2+. În plus, ionii de Mg 2 * activează metabolismul energetic și sinteza ATP.
Compușii de calciu (de exemplu, CaCO 3) fac parte din cochiliile moluștelor, ale crustaceelor și ale altor animale. În unele proteste, scheletul intracelular este construit din oxid de siliciu (IV) Si02 sau sulfat de stronțiu SrS04.
Acizii anorganici funcționează și ei caracteristici importante in corp. Deci, în stomacul vertebratelor, acidul clorhidric creează un mediu acid, contribuind la distrugerea agenților patogeni și la activarea enzimelor sucului gastric și stimulează contracțiile pereților stomacului. Acidul carbonic și anionii săi formează un sistem tampon de bicarbonat, iar anionii de acid fosforic formează un sistem tampon de fosfat.
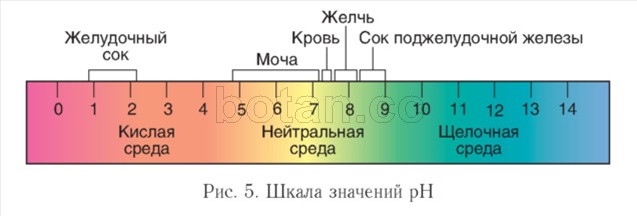
Aciditatea mediului. Cursul reacțiilor biochimice în organismele vii este afectat semnificativ de concentrația ionilor de hidrogen (H +) - aciditatea mediului ambiant. LAîn soluţii neutre, această concentraţie este 1 (G 7 mol/l. Pentru a caracteriza aciditatea mediului, este convenabil de utilizat Valoarea pH-ului ( pH) și shkpH stacojiu(Fig. 5).
În soluțiile apoase, valoarea pH-ului ia, de obicei, valori de la 0 la 14. Un mediu neutru este caracterizat printr-o valoare a pH-ului de \u003d 7, într-un mediu alcalin pH-ul este mai mare de 7, într-un mediu acid este mai mică de 7. Cu cât valoarea pH-ului diferă mai mult de 7, cu atât soluția este mai acidă sau mai alcalină.
In interiorul celulelor mediul este neutru sau usor alcalin (pH = 7,0-7,3), in sange pH-ul este putin mai mare decat in celule si variaza de obicei intre 7,35-7,45. În tractul digestiv, pH-ul variază foarte mult. Valorile extreme ale pH-ului sunt caracteristice stomacului (1-2) și intestinului subțire (mai mult de 8). În urină se observă fluctuații semnificative ale pH-ului (4,8-7,4).
Conceptul de soluții tampon. Organismele vii în ansamblu și celulele lor individuale au capacitatea de a menține aciditatea mediului la un anumit nivel. In mentinerea unei reactii usor alcaline a mediului extracelular
sunt implicaţi acidul carbonic H 2 CO 3 şi ionul hidrocarbonat HCO3. Acidul carbonic este un electrolit slab, în soluție o anumită parte a moleculelor sale este disociată și se observă un echilibru:
H2C03 ^ H + + HCOd.
Dacă, din orice motiv, concentrația ionilor H + în soluție crește (mediul devine mai acid), anionii HCO îi leagă:
H + + HCO3 ->. H2C03.
Dacă aciditatea mediului scade, moleculele de acid carbonic se disociază, eliberând ioni de hidrogen suplimentari:
H2CO3H++ + HCO3.
Astfel, în soluție se menține o concentrație relativ constantă de ioni H +. În mod similar, anionii acidului fosforic HoPO^ și HPO^ mențin un mediu neutru sau ușor alcalin în interiorul celulelor. Soluțiile în care, atunci când compoziția mediului se modifică, se asigură o constantă relativă a concentrației ionilor de hidrogen (H +) se numesc tampon.
1. Ce substanțe anorganice fac parte din organismele vii?
2. Ce substanțe se numesc hidrofile? Hidrofob? Dă exemple.
3. Descrie rol biologic săruri minerale și acizi.
4. Câtă apă este conținută în organismele vii? De ce depinde? De ce se ofilesc plantele când lipsește apa?
5. Două soluții de glucoză sunt separate printr-o membrană care nu permite trecerea moleculelor de glucoză, dar permite trecerea apei. Concentrația de glucoză în prima soluție este de 1%, în a doua - 0,1%. Ce se întâmplă cu moleculele de apă? Care este numele acestui fenomen?
6. Care sunt principalele funcții ale apei în organismele vii? Atât fizic cât și Proprietăți chimice apă asociată cu funcțiile sale biologice?
7. De ce crezi că majoritatea substanțelor polare se dizolvă bine în apă, în timp ce substanțele nepolare, de regulă, sunt insolubile în ea?
8. Proprietățile tampon ale mediului extracelular sunt asigurate de acidul carbonic și ionul bicarbonat, în interiorul celulelor această funcție este îndeplinită de anionii de acid fosforic. De ce acești compuși fac posibilă menținerea unei anumite concentrații de ioni de hidrogen în soluții, în timp ce azotul și acid clorhidric, precum și anionii lor, nu au astfel de proprietăți?
- § 1. Conţinutul de elemente chimice din organism. Macro- și microelemente
- § 2. Compuşi chimici în organismele vii. substante anorganice
- § 10. Istoria descoperirii celulei. Crearea teoriei celulare
- § 15. Reticulul endoplasmatic. Complexul Golgi. Lizozomi
Capitolul 1. Componentele chimice ale organismelor vii
Capitolul 2. Celula – unitate structurală și funcțională a organismelor vii
capitolul 3
1. Ce substanțe anorganice fac parte din organismele vii?
Compoziția organismelor vii include substanțe anorganice precum apa, săruri minerale, acizi anorganici (minerale) și altele.
2. Ce substanțe se numesc hidrofile? Hidrofob? Dă exemple.
Substanțele hidrofile sunt substanțe care interacționează activ cu moleculele de apă cu formarea de legături de hidrogen. De regulă, substanțele hidrofile sunt foarte solubile în apă. Substanțele hidrofobe interacționează slab cu moleculele de apă, „se străduiesc” să evite contactul cu aceasta. Astfel de substanțe nu se dizolvă în apă. Pentru un nivel de bază de studiu de biologie, este suficient ca studenții să caracterizeze substanțele hidrofile ca solubile în apă, iar substanțele hidrofobe ca insolubile în ea.
Substanțele hidrofile sunt, de exemplu, mono- și dizaharidele, alcoolii inferiori, acizii carboxilici inferiori, mulți acizi și săruri anorganice. Hidrofobe includ grăsimi, acizi carboxilici superiori și alte substanțe.
3. Descrieți rolul biologic al sărurilor minerale și al acizilor.
Sărurile minerale insolubile fac parte din diferitele structuri de susținere ale organismelor vii, de exemplu, carbonatul de calciu (CaCO 3) este parte a cochiliilor de moluște și a crustaceelor. Scheletul intracelular al unor protisti este construit din sulfat de stronțiu (SrSO 4).
Sărurile minerale solubile din organismele vii sunt sub formă de ioni. în mediu acvatic are loc disocierea lor. Din punct de vedere biologic, cei mai importanţi dintre ionii sunt cationii K + , Na + , Ca 2+ , Mg 2+ şi anionii Cl - , HCO 3 - , HPO 4 2- , H 2 RO 4 - . Concentrație diferită Ionii de K + și Na + în interiorul și în exteriorul celulelor duce la apariția unei diferențe de potențiale electrice pe membrana citoplasmatică, care este importantă pentru transmiterea impulsurilor nervoase și pentru transportul substanțelor prin membrană. Cu o scădere a acestei diferențe, excitabilitatea celulelor scade. Reziduurile de acid fosforic fac parte din nucleotide și ATP. Fe 2+ face parte din hemoglobină, Mg 2+ face parte din clorofilă. Ionii NO 3 - și NH 4 + sunt surse de atomi de azot, iar ionii SO 4 2 - - atomi de sulf, care sunt necesari organismelor autotrofe pentru sinteza aminoacizilor. Ionii de Ca 2+ și Mg 2+ îndeplinesc o funcție de reglare, activează multe enzime. De exemplu, ionii de Mg 2+ activează metabolismul energetic și sinteza ATP.
Acizii minerali (anorganici) îndeplinesc și funcții biologice importante. Acidul clorhidric creează un mediu acid în stomacul vertebratelor și al oamenilor, contribuind la distrugerea agenților patogeni și la activarea enzimelor sucului gastric și stimulează contracțiile pereților stomacului. Anionii acidului fosforic formează un sistem tampon fosfat care menține un mediu neutru sau ușor alcalin în interiorul celulelor. Acidul carbonic și anionii săi formează un sistem tampon de bicarbonat care menține o reacție ușor alcalină a mediului extracelular.
4. Câtă apă este conținută în organismele vii? De ce depinde? De ce se ofilesc plantele când lipsește apa?
Conținutul de apă depinde de tipul de organism, vârsta acestuia, tipul de celule (țesuturi) și starea lor fiziologică. De exemplu, la oameni, materia cenușie a creierului conține aproximativ 85% apă, iar țesutul osos - 22%. Cel mai mare conținut de apă din organism se observă în perioada embrionară (aproximativ 95%) și scade treptat odată cu vârsta, ceea ce duce la scăderea activității funcționale a celulelor, țesuturilor și a corpului în ansamblu.
Apa determină volumul celulei și presiunea intracelulară (turgor), ceea ce provoacă starea de stres a membranei celulare. Cu lipsa apei în celule, presiunea turgenței scade, astfel încât plantele se ofilesc.
5. Două soluții de glucoză sunt separate printr-o membrană care nu permite trecerea moleculelor de glucoză, dar permite trecerea apei. Concentrația de glucoză în prima soluție este de 1%, în a doua - 0,1%. Ce se întâmplă cu moleculele de apă? Care este numele acestui fenomen?
Moleculele de apă se deplasează printr-o membrană semi-permeabilă de la o soluție mai puțin concentrată (cu o fracție de masă de glucoză 0,1%) la o soluție mai concentrată (cu o fracție de masă de glucoză 1%). Acest fenomen se numește osmoză. Osmoza egalizează concentrațiile de glucoză în soluții separate printr-o membrană semipermeabilă.
6. Care sunt principalele funcții ale apei în organismele vii? Cum sunt proprietățile fizice și chimice ale apei legate de funcțiile sale biologice?
Apa face parte din celule și substanță intercelulară, stă la baza sângelui, limfei, lichidului tisular, secrețiilor glandelor. Determină volumul celulelor și asigură menținerea presiunii turgenței. Apa este un solvent universal pentru compușii polari și principalul mediu în care au loc procesele metabolice ale organismelor vii. Majoritatea reacțiilor chimice din organism au loc în soluții apoase. Intrarea și ieșirea substanțelor din celule se efectuează, de regulă, într-o formă dizolvată. Apa ca solvent participă la fenomenele de osmoză, datorită cărora concentrațiile de substanțe dizolvate în celule și mediul extracelular sunt egalizate.
Apa este un participant direct la multe reacții biochimice, de exemplu, reacțiile de scindare hidrolitică (hidroliza) a compușilor organici. Este una dintre materiile prime în reacțiile de fotosinteză. Oxigenul eliberat în timpul fotosintezei provine din descompunerea moleculelor de apă.
Apa este implicată în reglarea regimului termic al organismelor. Asigură o distribuție uniformă a căldurii între țesuturi și organe, previne schimbările bruște de temperatură în celule și în organism în ansamblu, chiar și atunci când fluctuațiile de temperatură din mediu sunt suficient de mari. În timpul evaporării apei de către organisme (transpirația la plante, transpirația la mamifere), se consumă multă căldură, care le protejează de supraîncălzire.
Apa este un solvent universal și un mediu pentru procesele metabolice datorită polarității moleculelor și capacității acestora de a forma legături de hidrogen intermoleculare cu alți compuși. Dimensiunea redusă a moleculelor de apă joacă un rol important în fenomenele osmotice. Participarea apei la reglarea regimului termic al organismelor este asociată cu capacitatea sa ridicată de căldură, conductivitate termică bună și căldură ridicată de vaporizare. Acest lucru, la rândul său, se datorează capacității moleculelor de apă de a forma numeroase legături de hidrogen între ele.
7. De ce crezi că majoritatea substanțelor polare se dizolvă bine în apă, în timp ce substanțele nepolare, de regulă, sunt insolubile în ea?
Moleculele de apă sunt polare, ceea ce le permite să interacționeze intens cu alte substanțe polare. Apa contribuie la separarea particulelor structurale ale compușilor polari (ioni, molecule), tranziția lor în soluție, formează învelișuri de hidratare în jurul ionilor și moleculelor polare.
Moleculele de apă interacționează foarte slab cu compușii nepolari. Astfel de substanțe sunt practic insolubile în apă, dar ușor solubile în solvenți nepolari (de exemplu, în benzină). Aici este potrivit să ne amintim de regula antică a alchimiștilor: „Asemenea se dizolvă în asemănător”.
opt*. Proprietățile tampon ale mediului extracelular sunt asigurate de acidul carbonic și ionul de bicarbonat; în interiorul celulelor, această funcție este îndeplinită de anionii de acid fosforic. De ce acești compuși fac posibilă menținerea unei anumite concentrații de ioni de hidrogen în soluții, în timp ce acizii azotic și clorhidric, precum și anionii lor, nu au astfel de proprietăți?
Acidul carbonic este un electrolit slab. În soluțiile apoase, doar o mică parte din moleculele sale este disociată în ioni, prin urmare, în mediul intercelular, împreună cu ionii de bicarbonat (HCO 3 -), sunt conținute și molecule nedisociate de acid carbonic (H 2 CO 3 ). În interiorul celulelor, există un anumit echilibru (echilibru) între anionii acidului fosforic H 2 PO 4 - și HPO 4 2-:
H 2 CO 3 ↔ H ++ + HCO 3 -
H 2 RO 4 – ↔ H + + HRO 4 2–
Odată cu scăderea acidității mediului, echilibrul se deplasează spre dreapta - sunt eliberați ioni de hidrogen suplimentari (H +). Odată cu creșterea acidității, echilibrul se deplasează spre stânga - există o legare a ionilor de H + „extra”. Din acest motiv, reacția mediului extracelular (sau conținutului intracelular) practic nu se modifică.
Acizii azotic și clorhidric sunt electroliți puternici. Când sunt dizolvate în apă, se disociază aproape complet în ioni:
HNO 3 → H + + NO 3 -
HCl → H + + Cl –
Disocierea electroliților puternici este practic ireversibilă, astfel încât soluțiile lor nu au proprietăți tampon.
* Sarcinile marcate cu asterisc impun elevilor să prezinte diverse ipoteze. Prin urmare, atunci când stabilește o notă, profesorul ar trebui să se concentreze nu numai pe răspunsul dat aici, ci să ia în considerare fiecare ipoteză, evaluând gândirea biologică a elevilor, logica raționamentului lor, originalitatea ideilor etc. După aceea, este se recomandă familiarizarea elevilor cu răspunsul dat.
După cum știm deja, celula este formată din substanțe chimice tipuri organice și anorganice. Principalele substanțe anorganice care alcătuiesc celula sunt sărurile și apa.
Apa ca componentă a vieții
Apa este componenta dominantă a tuturor organismelor. Funcții biologice importante ale apei sunt îndeplinite de proprietăți unice moleculele sale, în special prezența dipolilor, care fac posibilă apariția legăturilor de hidrogen între celule.
Datorită moleculelor de apă din corpul ființelor vii, au loc procesele de stabilizare termică și termoreglare. Procesul de termoreglare are loc datorită capacității mari de căldură a moleculelor de apă: schimbările de temperatură exterioară nu afectează schimbările de temperatură din interiorul corpului.
Datorită apei, organelor corpul umanîși păstrează elasticitatea. Apa este una dintre componentele principale ale fluidelor lubrifiante necesare articulațiilor vertebratelor sau sacului pericardic.
Este inclus în mucus, care facilitează mișcarea substanțelor prin intestine. Apa este o componentă a bilei, a lacrimilor și a salivei.
Săruri și alte substanțe anorganice
Celulele unui organism viu, pe lângă apă, conțin substanțe anorganice precum acizi, baze și săruri. Cel mai importanţăîn viața organismului au Mg2+, H2PO4, K, CA2, Na, C1-. Acizi slabi garanție stabilă mediu intern celule (uşor alcaline).
Concentrația ionilor în substanța intercelulară și în interiorul celulei poate fi diferită. Deci, de exemplu, ionii de Na + sunt concentrați numai în fluidul intercelular, în timp ce K + se găsește exclusiv în celulă.
O reducere sau o creștere bruscă a numărului anumitor ioni din compoziția celulei duce nu numai la disfuncția acesteia, ci și la moarte. De exemplu, o scădere a cantității de Ca + din celulă provoacă convulsii în interiorul celulei și moartea ulterioară a acesteia.
Unele substanțe anorganice interacționează adesea cu grăsimile, proteinele și carbohidrații. Asa de un prim exemplu sunt compuși organici cu fosfor și sulf.
Sulful, care face parte din moleculele de proteine, este responsabil pentru formarea de legături moleculare în organism. Datorită sintezei fosforului și a substanțelor organice, energia este eliberată din moleculele de proteine.
Săruri de calciu
Sărurile de calciu contribuie la dezvoltarea normală a țesutului osos, precum și la funcționarea creierului și a măduvei spinării. Metabolismul calciului în organism se realizează datorită vitaminei D. Excesul sau lipsa sărurilor de calciu duce la disfuncția organismului.
