Amoniak patrí do skupiny chemikálií. Výroba amoniaku v priemysle. Získanie amoniaku v laboratóriu
Amoniak -NH 3
Amoniak (v európskych jazykoch jeho názov znie ako „amoniak“) vďačí za svoj názov oáze Ammon v r. severná Afrika nachádza sa na križovatke karavanových ciest. V horúcom podnebí sa močovina (NH 2) 2 CO obsiahnutá v živočíšnom odpade rozkladá obzvlášť rýchlo. Jedným z produktov rozkladu je amoniak. Podľa iných zdrojov dostal amoniak svoj názov zo staroegyptského slova amoniak. Takzvaní ľudia uctievajú boha Amona. Počas rituálnych obradov šnupali čpavok NH 4 Cl, ktorý pri zahriatí odparuje čpavok.
1. Štruktúra molekuly
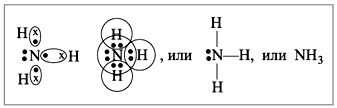
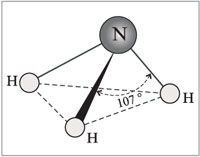
Molekula amoniaku má tvar trigonálnej pyramídy s atómom dusíka na vrchu. Tri nepárové p-elektróny atómu dusíka sa podieľajú na tvorbe polárnych kovalentných väzieb s 1s-elektrónmi troch atómov vodíka (väzby N-H), štvrtý pár vonkajších elektrónov je nezdieľaný, môže vytvárať väzbu donor-akceptor s vodíkom ión, tvoriaci amónny ión NH4+.
vyhliadka chemická väzba: kovalentné polárne, tri jednoduchéσ - NH väzba sigma
2. Fyzikálne vlastnosti amoniaku
o normálnych podmienkach- bezfarebný plyn s ostrým charakteristickým zápachom (zápach po čpavku), takmer dvakrát ľahší ako vzduch, jedovatý.Podľa fyziologického účinku na organizmus patrí do skupiny látok s dusivým a neurotropným účinkom, ktoré sú schopné spôsobiť toxický pľúcny edém a ťažké poranenia pri inhalačnom poškodení. nervový systém. Pary amoniaku silne dráždia sliznice očí a dýchacích orgánov, ako aj koža. To je to, čo vnímame ako štipľavý zápach. Výpary amoniaku spôsobujú hojné slzenie, bolesť očí, chemické poleptanie spojovky a rohovky, stratu zraku, záchvaty kašľa, začervenanie a svrbenie kože. Rozpustnosť NH 3 vo vode je extrémne vysoká - asi 1200 objemov (pri 0 °C) alebo 700 objemov (pri 20 °C) v objeme vody.
3.
|
V laboratóriu |
V priemysle |
|
Na získanie amoniaku v laboratóriu sa používa pôsobenie silných alkálií na amónne soli: NH4Cl + NaOH = NH3 + NaCl + H20 (NH4)2S04 + Ca(OH)2 = 2NH3 + CaS04 + 2H20 Pozor !Hydroxid amónny je nestabilná zásada, rozkladá sa: NH4OH ↔ NH3 + H20 Pri prijímaní amoniaku držte skúmavku - prijímač hore dnom, pretože amoniak je ľahší ako vzduch: |
Priemyselná metóda výroby amoniaku je založená na priamej interakcii vodíka a dusíka: N2 (g) + 3H2 (g) ↔ 2NH3 (g) + 45,9 k J Podmienky: katalyzátor - porézne železo teplota - 450 - 500 ˚С tlak - 25 - 30 MPa Ide o takzvaný Haberov proces (nemecký fyzik vyvinul fyzikálno-chemické základy metódy). |
4. Chemické vlastnosti amoniak
Pre amoniak sú reakcie charakteristické:
- so zmenou oxidačného stavu atómu dusíka (oxidačné reakcie)
- bez zmeny oxidačného stavu atómu dusíka (adícia)
|
Reakcie so zmenou oxidačného stavu atómu dusíka (oxidačné reakcie) N-3 → N° → N +2 NH3-silné redukčné činidlo. |
|
s kyslíkom 1. Spaľovanie amoniaku (pri zahrievaní) 4NH3 + 302 -> 2N2 + 6H20 2. Katalytická oxidácia amoniaku (katalyzátorPt – Rh, teplota) 4NH3 + 502 -> 4NO + 6H20 Video - Experiment "Oxidácia amoniaku v prítomnosti oxidu chrómu" |
|
s oxidmi kovov 2 NH3 + 3CuO \u003d 3Cu + N2 + 3 H20 |
|
so silnými oxidantmi 2 NH3 + 3 Cl2 \u003d N2 + 6 HCl (pri zahrievaní) |
|
amoniak je krehká zlúčenina, pri zahrievaní sa rozkladá 2NH3↔N2 + 3H 2 |
|
Reakcie bez zmeny oxidačného stavu atómu dusíka (prídavok - Tvorba amónneho iónu NH4+podľa mechanizmu donor-akceptor) Video – Experiment „Kvalitatívna reakcia na amoniak“ Video – Experiment „Dym bez ohňa“ Video - Experiment "Interakcia amoniaku s koncentrovanými kyselinami" Video – Experiment „Fontána“ Video – Experiment „Rozpúšťanie amoniaku vo vode“ |
5. Aplikácia amoniaku
Pokiaľ ide o objemy výroby, amoniak zaujíma jedno z prvých miest; ročne dostane na celom svete asi 100 miliónov ton tejto zlúčeniny. Amoniak sa vyrába v kvapalnej forme alebo vo forme vodného roztoku - čpavková voda, ktorý zvyčajne obsahuje 25 % NH 3 . Ďalej sa používa obrovské množstvo amoniaku na výrobu kyseliny dusičnej ktorý ide do výroba hnojív a mnoho ďalších produktov. Amoniakálna voda sa používa aj priamo ako hnojivo a niekedy sa polia polievajú z nádrží priamo tekutým čpavkom. Z amoniaku dostávajú rôzne amónne soli, močovinu, urotropín. Jeho používa sa aj ako lacné chladivo v priemyselných chladiacich systémoch.
Používa sa aj amoniak na výrobu syntetických vlákien, napríklad nylon a kaprón. AT ľahký priemysel je on? používa sa pri čistení a farbení bavlny, vlny a hodvábu. V oleji chemický priemyselčpavok sa používa na neutralizáciu kyslého odpadu a pri výrobe prírodného kaučuku pomáha čpavok konzervovať latex počas prepravy z plantáže do továrne. Amoniak sa používa aj pri výrobe sódy Solvayovou metódou. V oceliarstve sa čpavok používa na nitridáciu – nasýtenie povrchových vrstiev ocele dusíkom, čím sa výrazne zvyšuje jej tvrdosť.
Lekári používajú vodné roztoky amoniaku (amoniak) v každodennej praxi: vatový tampón namočený v čpavku preberie človeka z mdloby. Pre človeka nie je amoniak v takejto dávke nebezpečný.
SIMULÁTORY
Simulátor №1 "Spaľovanie amoniaku"
Simulátor №2 "Chemické vlastnosti amoniaku"
ÚLOHY NA POSILŇOVANIE
№1. Vykonajte transformácie podľa schémy:
a) Dusík → Amoniak → Oxid dusnatý (II)
b) Dusičnan amónny → Amoniak → Dusík
c) Amoniak → Chlorid amónny → Amoniak → Síran amónny
Pre OVR zostavte elektronické váhy, pre RIO kompletné iónové rovnice.č. 2. Napíšte štyri rovnice chemické reakciečo vedie k tvorbe amoniaku.
Okvetné lístky zozelenajú a - sčernejú.
Kvetinári, ako sa hovorí, berú na vedomie. však amoniak užitočné v iných oblastiach činnosti. Dozvieme sa zvyšok vlastností látky, zoznámime sa so spôsobmi jej aplikácie.
Vlastnosti amoniaku
Pri práci s parami amoniaku by ste mali byť opatrní. Pri určitej koncentrácii je zmes činidla so vzduchom výbušná.
Okrem toho je plyn toxický. "Komunikácia" s ním je plná nervových porúch, straty sluchu, čiastočnej straty pamäti, zakalenia šošoviek. Tieto príznaky sa pozorujú u ľudí pracujúcich pri výrobe amoniaku.
Pary amoniaku sa vždy vynárajú, pretože plyn je ľahší ako vzduch. Látka je za normálnych podmienok plyn. Amoniak sa skvapalňuje na prepravu a predaj.
Na to potrebujete vysoký krvný tlak. Získajte bezvodý koncentrát. Pre neho existuje 6221-90 GOST.
Skvapalnený amoniak v nádobách má však plynnú fázu. Pod tlakom sú oba stavy hmoty v rovnováhe.
V tomto prípade musí byť teplota pod kritickou hodnotou, rovnako ako tlak. Ak je viac ako 132 stupňov a 11 megapascalov, rovnováha sa naruší.
Koeficient objemovej kompresie látky je niekoľkonásobne menší ako jej koeficient rozťažnosti.
Ak je nádoba naplnená po vrch, zvýšenie teploty môže viesť k tlaku 52 megapascalov.
To stačí na rozbitie kovových švov nádoby, ktorá obsahuje. V súlade s tým dôjde k výbuchu.
Z koncentrátu amoniaku môžete získať roztok amoniaku akúkoľvek intenzitu. Aj keď bezvodá verzia príde ľudstvu vhod.
Napríklad je to jedno z hnojív. Okrem toho je v látke prítomný iba vodík. Posledné 3 atómy, to znamená, že vzorec plynu je nasledujúci: - NH3.
Tento obsah vodíka je dôvodom vynikajúcej rozpustnosti amoniaku vo vode. Iné plyny sa tým nemôžu pochváliť.
Medzi amoniakom a vodou vznikajú silné vodíkové väzby. Čím je roztok nasýtenejší, tým má lepšie rozpúšťacie vlastnosti.
Pre nich látka konkuruje etylalkohol, len s tým rozdielom, že tá druhá je organického pôvodu.
takze vodný amoniak, ako aj koncentrát, sú schopné rozpúšťať kovy skupín alkalických kovov a kovov alkalických zemín.
Výsledkom reakcie sú tmavomodré kvapaliny. Je to výsledok valenčnej elektrónovej ionizácie a solvatácie.
Posledný pojem označuje elektrostatický kontakt medzi molekulami rozpustených kovov a amoniaku.
Z amoniaku zápach amoniaku prichádza z ničoho nič. Činidlom je vodný roztok hydroxidu amónneho.
t.j. amoniak je amoniak alkohol. Hydroxid amónny sa nachádza aj v moči, ako aj v produktoch organického rozkladu.
Preto napríklad hnijúce masy z dna močiarov nepríjemne zapáchajú. Rozkladajú zvyšky rastlín, rýb,.
V tých istých rybníkoch sa amoniak prirodzene mieša s vodou. V roztoku je prítomná OH skupina.
To znamená, že zmes je schopná alkalickej reakcie, je slabá zásada. Rozpúšťa hrdinu a alkohol. Amoniak nie náhodou zmiešaný s amoniakom.
V koncentrovanej forme nitrid vodíka silne láme svetlo, to znamená, že mení smer jeho lúčov.
Ďalšia kuriózna vlastnosť hrdinu článku sa varí mínusové teploty. Malo by byť okolo 34 pod nulou.
Ak znížite teplotu na 78 stupňov, kvapalina úplne stvrdne. Ukazuje sa, že belavé vločky, podobné snehu. látky majú pravidelný, symetrický tvar.
Ťažba amoniaku
Výroba amoniaku znížiť na 100 000 000 ton ročne. Vyťaží sa približne rovnaké množstvo chlóru. Amoniak je zároveň menej toxický.
V uvedenom objem amoniaku zahŕňa látku extrahovanú z prírodných zdrojov dusíka a syntetizovanú za podmienok.
Priemyselná metóda je založená na kombinácii vodíka a dusíka. Amoniak z nich sa získava pri teplote nie nižšej ako 500 stupňov Celzia.
Ďalšia podmienka: - tlak 350 atmosfér. Bez katalyzátora sa nezaobídete. Urýchľuje pomalú reakciu bez toho, aby do nej sám vstúpil.
Úlohu katalyzátora zvyčajne plní huba. Z drahších pomocníkov sa volí oxid, príp.
Konečný výťažok produktu pri interakcii jednoduchých látok je približne 30-35%.
Toto je maximum, pri najnižšej možnej teplote a najvyššom tlaku. Práve tento duet zabezpečuje účinnosť reakcie.
Avšak pri nižšej teplotnej lište sa rýchlosť procesu znižuje. Ak zapnete teplo, čiastočne zostanete bez amoniak ale dostaneš to rýchlejšie.
Syntetická metóda výroby amoniaku nenecháva prakticky žiadnu šancu na jeho extrakciu v prírode z produktov rozkladu organickej hmoty. Tento proces je dlhý.
Amoniak sa tvorí, ale rýchlo prchá. Do pascí zemská kôra plyn je zriedkavý.
Amoniak sa zvyčajne pomaly vyparuje, čo spôsobuje, že prírodné usadeniny sú nelikvidné.
Aplikácia amoniaku
Aplikácia látky v poľnohospodárskom sektore už boli spomenuté. Teraz prejdime do kozmetického priemyslu, zapamätajme si amoniak na vlasy.
Tu si pripomíname, že roztok látky je slabá zásada. Z toho vyplýva vymenovanie: - poskytovať alkalické Ph farby v oblasti 10.
Takéto prostredie prispieva k opuchu vlasov, čo spúšťa rozkladnú reakciu peroxidu vodíka.
Posledne menovaný je čistiaci prostriedok, preto sa nevyhnutne používa v odtieňoch blond.
Existovať farba bez amoniaku. Výrobcovia sú však čiastočne prefíkaní. Namiesto čistá substancia aplikujú sa jeho deriváty.
Tiež zvyšujú Ph na alkalickú úroveň, ale sú drahšie. V súlade s tým a farba na vlasy bez amoniaku vyžaduje náklady.

Spotrebitelia sú však na ne pripravení, aby si zachránili vlasy. Čistý amoniak totiž silnejšie otvára póry vlasov.
Začnú pripomínať špongiu, ktorej povrch sa dá vyhladiť iba drahou silikónovou kozmetikou, ktorá vyplní prázdne miesta.
Z potravín vyjadrené alkálie -. Na jeho výrobu, aj réžiu syntéza amoniaku.
Vyrába sa aj na získanie dusíka kyseliny. Amoniak premenený na oxid dusnatý.
Ten sa oxiduje na oxid. Potom sú oxidy absorbované vodou. Tak to dostanú.
Vzorec amoniaku, ako už bolo spomenuté, je základom tvorby výbušných látok.
Látka je potrebná aj pri výrobe chladiacich zariadení. Jeho pôsobenie je založené na odparovaní skvapalnený plyn. Zároveň sa absorbuje veľa tepla, čo v skutočnosti poskytuje chlad.
V šperkárstve sa podieľal aj na čpavku. Používa sa na čistenie výrobkov po leštení pastou.
Potreba čpavku ľudstvom odráža trend v jeho výrobe. Ešte pred 30 rokmi sa ročne vytvorilo 70 000 000 ton činidla.
Teraz, ako je uvedené v kapitole „Produkcia“, je to 100 000 000. Len vedúci výroby sa nezmenili. Toto sú stále USA a teraz.
V referenčných knihách minulých rokov sa samozrejme objavuje ZSSR. Že náklady na látku sa zmenili a nie je potrebné hádať. Zoznámime sa s aktuálnou cenovkou pre čpavok.
Cena amoniaku
kúpiť amoniak môže byť veľkoobchodný aj maloobchodný. Veľké dodávky sa spravidla uskutočňujú v tonách.
Za 1000 kilogramov žiadajú od 19 000 rubľov. Malé podniky sú pripravené predávať za kilogram a požadujú asi 30 rubľov.
V maloobchode sa kilogramy ponúkajú zriedka, tony neponúkajú vôbec. Preštudujme si cenník lekární, venujme pozornosť čpavku.
Zvyčajne sa naleje do fliaš s objemom 40 mililitrov. Takýto objem stojí od 15 do 31 rubľov.
Je zaujímavé, že ak existujú fľaše s objemom 25 a 100 mililitrov, stoja približne rovnako, od 13 do 55 rubľov.
Zároveň stojí za zváženie, že alkoholový roztok je 10 percent. Skvapalnený amoniak pri veľkoobchodných dodávkach sa koncentruje.
Priemyselníci preto musia myslieť na správnu prepravu tovaru. Existujú špeciálne návesy s nádržami.
Vek nádob by nemal presiahnuť 30 rokov. Dôležité je aj zloženie pre nádrže, pretože čpavok rozpúšťa mnohé kovy.
Je tiež potrebné vziať do úvahy tlak v nádrži, teplotu. Preto sa popri inzerátoch na predaj činidla spravidla objavujú aj ponuky na predaj a prenájom návesov. Bez nich sa nezaobídete.
Kvapalina
Amoniak- NH 3, nitrid vodíka, za normálnych podmienok - bezfarebný plyn s ostrým charakteristickým zápachom (zápach po amoniaku), takmer dvakrát ľahší ako vzduch, jedovatý. Rozpustnosť NH3 vo vode je extrémne vysoká - asi 1200 objemov (pri 0 °C) alebo 700 objemov (pri 20 °C) v objeme vody. AT chladenie sa nazýva R717, kde R je chladivo (chladivo), 7 je typ chladiva (anorganická zlúčenina), 17 je molekulová hmotnosť.
Molekula amoniaku má tvar trigonálnej pyramídy s atómom dusíka na vrchu. Tri nepárové p-elektróny atómu dusíka sa podieľajú na tvorbe polárnych kovalentných väzieb s 1s-elektrónmi troch atómov vodíka (väzby N-H), štvrtý pár vonkajších elektrónov je nezdieľaný, môže vytvárať väzbu donor-akceptor s vodíkom ión, tvoriaci amónny ión NH4+. Vzhľadom na to, že neväzbový dvojelektrónový oblak je striktne orientovaný v priestore, molekula amoniaku má vysokú polaritu, čo vedie k jej dobrej rozpustnosti vo vode.
V kvapalnom amoniaku sú molekuly spojené vodíkovými väzbami. Porovnanie fyzikálnych vlastností kvapalného amoniaku s vodou ukazuje, že amoniak má nižšie teploty varu (t bal -33,35 ° C) a teploty topenia (t pl -77,70 ° C), ako aj viac nízka hustota, viskozita (viskozita kvapalného amoniaku je 7-krát menšia ako viskozita vody), vodivosť a dielektrická konštanta. To sa do určitej miery vysvetľuje skutočnosťou, že sila týchto väzieb v kvapalnom amoniaku je výrazne nižšia ako vo vode, a tiež skutočnosťou, že v molekule amoniaku je iba jeden pár nezdieľaných elektrónov, na rozdiel od dvoch párov. v molekule vody, čo neumožňuje vytvorenie rozsiahlej siete vodíkových väzieb medzi viacerými molekulami. Amoniak ľahko prechádza do bezfarebnej kvapaliny s hustotou 681,4 kg / m³, ktorá silne láme svetlo. Rovnako ako voda, aj kvapalný amoniak je vo veľkej miere spojený, najmä prostredníctvom tvorby vodíkových väzieb. Kvapalný amoniak prakticky nevedie elektriny. Kvapalný amoniak je dobrým rozpúšťadlom pre veľmi Vysoké číslo organické, ako aj pre mnohé anorganické zlúčeniny. Pevný amoniak sú bezfarebné kubické kryštály.
Chemické vlastnosti
- V dôsledku prítomnosti osamelého elektrónového páru pôsobí amoniak v mnohých reakciách ako nukleofil alebo komplexotvorné činidlo. Takže pripája protón a vytvára amónny ión:
- Vodný roztok amoniaku ("amoniak") má mierne alkalickú reakciu v dôsledku procesu:
- Interakciou s kyselinami sa získajú zodpovedajúce amónne soli:
- Amoniak je tiež veľmi slabá kyselina(10 000 000 000 krát slabší ako voda), schopný tvoriť soli s kovmi - amidy. Zlúčeniny obsahujúce NH 2 - ióny sa nazývajú amidy, NH 2 - - imidy a N 3 - - nitridy. Amidy alkalických kovov sa získavajú pôsobením amoniaku na ne:
V dôsledku určitých reakcií v kvapalnom amoniaku vznikajú amidy, imidy a nitridy mnohých kovov. Nitridy možno získať zahrievaním kovov v dusíkovej atmosfére.
Amidy kovov sú analógmi hydroxidov. Táto analógia je posilnená skutočnosťou, že ióny OH- a NH2-, ako aj molekuly H20 a NH3, sú izoelektronické. Amidy sú silnejšie zásady ako hydroxidy, a preto podliehajú ireverzibilnej hydrolýze vo vodných roztokoch:
NaNH 2 + H 2 O → NaOH + NH 3 CaNH + 2H 2 O → Ca(OH) 2 + NH 3 Zn 3 N 2 + 6H 2 O → 3Zn(OH) 2 + 2NH 3
a v alkoholoch:
KNH2 + C2H5OH → C2H5OK + NH3
Podobne ako vodné roztoky alkálií, aj roztoky amidov amoniaku dobre vedú elektrický prúd, čo je spôsobené disociáciou:
MNH2 → M++ NH2-
Fenolftaleín v týchto roztokoch sčervená, po pridaní kyselín sa neutralizujú. Rozpustnosť amidov sa mení v rovnakom poradí ako rozpustnosť hydroxidov: LiNH 2 je nerozpustný, NaNH 2 je málo rozpustný, KNH 2, RbNH 2 a CsNH 2 sú vysoko rozpustné.
- Pri zahrievaní vykazuje amoniak redukčné vlastnosti. Horí teda v kyslíkovej atmosfére, pričom vzniká voda a dusík. Oxidáciou amoniaku vzduchom na platinovom katalyzátore vznikajú oxidy dusíka, ktoré sa v priemysle používajú na výrobu kyseliny dusičnej:
Použitie amoniaku NH 4 Cl na čistenie povrchu kovov od oxidov pri ich spájkovaní je založené na redukčnej schopnosti NH 3:
3CuO + 2NH4Cl → 3Cu + 3H20 + 2HCl + N2
Oxidáciou amoniaku chlórnanom sodným v prítomnosti želatíny sa získa hydrazín:
2NH3 + NaClO -> N2H4 + NaCl + H20
- Halogény (chlór, jód) tvoria s amoniakom nebezpečné výbušniny - halogenidy dusíka (chlorid dusnatý, jodid dusnatý).
- S halogénalkánmi vstupuje amoniak do nukleofilnej adičnej reakcie, pričom vytvára substituovaný amóniový ión (metóda na získanie amínov):
- S karboxylovými kyselinami, ich anhydridmi, halogenidmi, estermi a inými derivátmi vznikajú amidy. S aldehydmi a ketónmi - Schiffovými zásadami, ktoré možno redukovať na zodpovedajúce amíny (reduktívna aminácia).
- Pri 1000 °C reaguje amoniak s uhlím, pričom vzniká HCN a čiastočne sa rozkladá na dusík a vodík. Môže tiež reagovať s metánom za vzniku rovnakej kyseliny kyanovodíkovej:
História mien
Amoniak (v európskych jazykoch jeho názov znie ako „amoniak“) vďačí za svoj názov oáze Ammon v severnej Afrike, ktorá sa nachádza na križovatke karavánových ciest. V horúcom podnebí sa močovina (NH 2) 2 CO obsiahnutá v živočíšnom odpade rozkladá obzvlášť rýchlo. Jedným z produktov rozkladu je amoniak. Podľa iných zdrojov dostal amoniak svoj názov zo staroegyptského slova amoniak. Takzvaní ľudia uctievajú boha Amona. Počas rituálnych obradov šnupali čpavok NH 4 Cl, ktorý pri zahriatí odparuje čpavok.
Kvapalný amoniak
Kvapalný amoniak, aj keď v malom rozsahu, disociuje na ióny, v ktorých sa prejavuje jeho podobnosť s vodou:
2NH 3 → NH 4 + + NH 2 -
Samoionizačná konštanta kvapalného amoniaku pri teplote -50 °C je približne 10 -33 (mol/l)².
Kvapalný amoniak, podobne ako voda, je silné ionizujúce rozpúšťadlo, v ktorom sa rozpúšťa množstvo aktívnych kovov: alkálie, kovy alkalických zemín, Mg, Al, ako aj Eu a Yb. Rozpustnosť alkalických kovov v kvapalnom NH 3 je niekoľko desiatok percent. Kvapalný amoniak NH3 tiež rozpúšťa niektoré intermetalické zlúčeniny obsahujúce alkalické kovy, ako je Na4Pb9.
Zriedené roztoky kovov v kvapalnom amoniaku sú zafarbené modrá farba, koncentrované roztoky majú kovový lesk a sú podobné bronzu. Pri odparovaní amoniaku sa uvoľňujú alkalické kovy čistej forme, a alkalických zemín - vo forme komplexov s amoniakom [E (NH 3) 6] s kovovou vodivosťou. Pri miernom zahriatí sa tieto komplexy rozkladajú na kov a NH3.
Kov rozpustený v NH3 postupne reaguje za vzniku amidu:
2Na + 2NH3 → 2NaNH2 + H2 -
Kovové amidy vznikajúce pri reakcii s amoniakom obsahujú záporný ión NH 2 -, ktorý vzniká aj pri samoionizácii amoniaku. Amidy kovov sú teda analógmi hydroxidov. Rýchlosť reakcie sa zvyšuje pri prechode z Li na Cs. Reakcia sa výrazne urýchli v prítomnosti aj malých nečistôt H20.
Roztoky kov-amoniak majú kovovú elektrickú vodivosť, atómy kovov sa v nich rozpadajú na kladné ióny a solvatované elektróny obklopené molekulami NH3. Kovovo-amoniakové roztoky obsahujúce voľné elektróny sú najsilnejšie redukčné činidlá.
komplexná formácia
Vďaka svojim vlastnostiam darcu elektrónov môžu molekuly NH3 vstupovať do komplexných zlúčenín ako ligand. Zavedenie prebytočného amoniaku do roztokov solí d-kovov teda vedie k tvorbe ich aminokomplexov:
CuSO 4 + 4NH 3 → SO 4 Ni(NO 3) 2 + 6NH 3 → (NO 3) 2
Komplexáciu zvyčajne sprevádza zmena farby roztoku, takže pri prvej reakcii sa modrá farba (CuSO 4) zmení na tmavomodrú (farba komplexu) a pri druhej reakcii sa farba zmení zo zelenej ( Ni (NO 3) 2) na modrofialovú. Najsilnejšie komplexy s NH 3 tvoria chróm a kobalt v oxidačnom stave +3.
Biologická úloha
Amoniak je konečným produktom metabolizmu dusíka u ľudí a zvierat. Vzniká pri metabolizme bielkovín, aminokyselín a iných dusíkatých zlúčenín. Pre telo je vysoko toxický, takže väčšina amoniaku sa počas ornitínového cyklu premení v pečeni na neškodnejšiu a menej toxickú zlúčeninu – močovinu (močovinu). Močovina sa potom vylučuje obličkami a časť močoviny sa môže premeniť pečeňou alebo obličkami späť na amoniak.
Amoniak môže byť tiež použitý v pečeni na reverzný proces, resyntézu aminokyselín z amoniaku a aminokyselinových keto analógov. Tento proces sa nazýva "reduktívna aminácia". Takže zo šťaveľa octová kyselina ukazuje sa aspartát, z α-ketoglutarovej - glutamín atď.
Fyziologické pôsobenie
Podľa fyziologického účinku na organizmus patrí do skupiny látok s dusivým a neurotropným účinkom, ktoré pri vdýchnutí môžu spôsobiť toxický pľúcny edém a ťažké poškodenie nervového systému. Amoniak má lokálne aj resorpčné účinky.
Pary amoniaku silne dráždia sliznice očí a dýchacích orgánov, ako aj pokožku. To je to, čo vnímame ako štipľavý zápach. Výpary amoniaku spôsobujú hojné slzenie, bolesť očí, chemické poleptanie spojovky a rohovky, stratu zraku, záchvaty kašľa, začervenanie a svrbenie kože. Keď sa skvapalnený amoniak a jeho roztoky dostanú do kontaktu s pokožkou, dochádza k pocitu pálenia, je možné chemické popálenie s pľuzgiermi a ulceráciami. Okrem toho skvapalnený amoniak absorbuje teplo pri odparovaní a pri kontakte s pokožkou vznikajú omrzliny rôzneho stupňa. Zápach amoniaku je cítiť pri koncentrácii 37 mg/m³.
V konečnom dôsledku prípustná koncentrácia vo vzduchu pracovisko výrobné priestory je 20 mg/m³. Preto, ak je cítiť zápach amoniaku, potom je už nebezpečné pracovať bez ochranných prostriedkov. Podráždenie hltana sa prejavuje, keď je obsah amoniaku vo vzduchu 280 mg / m³, oko - 490 mg / m³. Pri vystavení veľmi vysokým koncentráciám spôsobuje amoniak kožné lézie: 7-14 g/m³ - erytematózne, 21 g/m³ alebo viac - bulózna dermatitída. Toxický pľúcny edém vzniká pri hodinovom vystavení amoniaku s koncentráciou 1,5 g/m³. Krátkodobá expozícia amoniaku v koncentrácii 3,5 g/m³ alebo rýchlejšie vedie k rozvoju všeobecných toxických účinkov. Maximálna prípustná koncentrácia amoniaku v atmosférický vzduch osady sa rovná: priemernej dennej dávke 0,04 mg/m³; maximálna jednotlivá dávka 0,2 mg/m³.
Vo svete sa maximálna koncentrácia amoniaku v atmosfére (viac ako 1 mg / m³) pozoruje v Indoganžskej nížine, v centrálnom údolí USA a v regióne južného Kazachstanu.
Aplikácia
Amoniak je jedným z najvýznamnejších produktov chemického priemyslu, jeho ročná svetová produkcia dosahuje 150 miliónov ton. Používa sa najmä na výrobu dusíkatých hnojív (dusičnan a síran amónny, močovina), výbušnín a polymérov, kyseliny dusičnej, sódy (amoniaková metóda) a iných chemických produktov. Ako rozpúšťadlo sa používa kvapalný amoniak.
Pri chladení sa používa ako chladivo (R717)
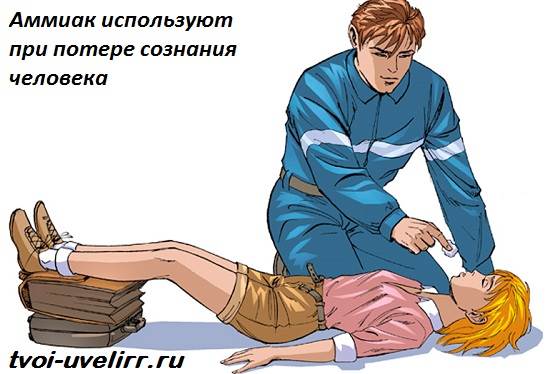
V medicíne sa 10% roztok čpavku, často nazývaný čpavok, používa na mdloby (na stimuláciu dýchania), na stimuláciu zvracania, ako aj zvonka - neuralgia, myozitída, bodnutie hmyzom, ošetrenie rúk chirurga. o nesprávne použitie môže spôsobiť poleptanie pažeráka a žalúdka (v prípade požitia neriedeného roztoku), reflexné zastavenie dýchania (pri vdýchnutí vo vysokých koncentráciách).
Aplikujte lokálne, inhalačne aj zvnútra. Na vzrušenie dýchania a odstránenie pacienta z mdloby opatrne prineste do nosa pacienta malý kúsok gázy alebo vaty navlhčenej amoniakom (na 0,5-1 s). Vnútri (len v chove) na vyvolanie zvracania. S uhryznutím hmyzom - vo forme pleťových vôd; s neuralgiou a myozitídou - trenie s amoniakom. V chirurgickej praxi sa chovajú v teplej prevarenej vode a umývajú si ruky.
Keďže ide o slabú zásadu, pri interakcii neutralizuje kyseliny.
Fyziologický účinok amoniaku je spôsobený štipľavým zápachom amoniaku, ktorý dráždi špecifické receptory nosovej sliznice a excituje dýchacie a vazomotorické centrá mozgu, čo spôsobuje zvýšené dýchanie a zvýšený krvný tlak.
Potvrdenie
Priemyselná metóda výroby amoniaku je založená na priamej interakcii vodíka a dusíka:
N2 (g) + 3H2 (g) ↔ 2NH3 (g) + 45,9 kJ
Ide o takzvaný Haberov proces (nemecký fyzik vyvinul fyzikálno-chemické základy metódy).
Reakcia nastáva s uvoľnením tepla a znížením objemu. Preto, na základe princípu Le Chatelier, by sa reakcia mala uskutočniť v nízke teploty a pri vysokých tlakoch - vtedy sa rovnováha posunie doprava. Rýchlosť reakcie pri nízkych teplotách je však zanedbateľná a pri vysokých teplotách sa rýchlosť reverznej reakcie zvyšuje. Uskutočnenie reakcie pri veľmi vysokých tlakoch vyžaduje vytvorenie špeciálnej odolnosti vysoký tlak zariadení, a teda veľká investícia. Navyše rovnováha reakcie, dokonca aj pri 700 °C, sa nastavuje príliš pomaly na jej praktické využitie.
Použitie katalyzátora (porézne železo s prímesami Al 2 O 3 a K 2 O) umožnilo urýchliť dosiahnutie rovnovážneho stavu. Je zaujímavé, že pri hľadaní katalyzátora pre túto úlohu sa vyskúšalo viac ako 20 tisíc rôznych látok.
Pri zohľadnení všetkých vyššie uvedených faktorov sa proces získavania amoniaku uskutočňuje pri nasledujúcich podmienok: teplota 500 °C, tlak 350 atmosfér, katalyzátor. Výťažok amoniaku za takýchto podmienok je asi 30 %. AT priemyselné prostredie využíva sa princíp cirkulácie – ochladzovaním sa odstraňuje amoniak a nezreagovaný dusík a vodík sa vracajú do syntéznej kolóny. To sa ukazuje byť ekonomickejšie ako dosiahnutie vyššieho výťažku reakcie zvýšením tlaku.
Na získanie amoniaku v laboratóriu sa používa pôsobenie silných alkálií na amónne soli:
NH4Cl + NaOH = NH3 + NaCl + H20.
Zvyčajne sa získava laboratórnym spôsobom, získava sa slabým zahrievaním zmesi chloridu amónneho s hasené vápno. 2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3 + 2H20
Na vysušenie amoniaku prechádza cez zmes vápna a lúhu sodného.
Veľmi suchý amoniak možno získať rozpustením kovového sodíka v ňom a následnou destiláciou. Najlepšie sa to robí v systéme vyrobenom z kovu vo vákuu. Systém musí byť schopný odolať vysokému tlaku izbová teplota tlak nasýtené pary amoniak asi 10 atmosfér). V priemysle sa amoniak suší v absorpčných kolónach.
Amoniak v medicíne
Pri uhryznutí hmyzom sa amoniak aplikuje zvonka vo forme pleťových vôd. možné vedľajšie účinky: Pri dlhšej expozícii (inhalačné použitie) môže amoniak spôsobiť reflexné zastavenie dýchania. Lokálna aplikácia je kontraindikovaná pri dermatitíde, ekzémoch a iných kožné ochorenia, ako aj s otvorenými traumatickými poraneniami kože. Pri inhalačnej aplikácii - reflexná zástava dýchania, pri lokálnej aplikácii - podráždenie, dermatitída, ekzém v mieste aplikácie. Lokálna aplikácia je možná len na neporušenú pokožku. V prípade náhodného poškodenia sliznice oka vypláchnite vodou (15 minút každých 10 minút) alebo 5 % roztokom kyselina boritá. Nepoužívajú sa oleje a masti. S porážkou nosa a hltanu - 0,5% roztok kyselina citrónová alebo prírodné šťavy. V prípade požitia vypite vodu, ovocný džús, mlieko, najlepšie 0,5% roztok kyseliny citrónovej alebo 1% roztok kyseliny octovej, kým sa obsah žalúdka úplne nezneutralizuje. Interakcia s ostatnými lieky neznámy. (Návod na použitie)
Vo vode
- Halogény (chlór, jód) tvoria s amoniakom nebezpečné výbušniny - halogenidy dusíka (chlorid dusnatý, jodid dusnatý).
- S halogénalkánmi vstupuje amoniak do nukleofilnej adičnej reakcie, pričom vytvára substituovaný amóniový ión (metóda na získanie amínov):
- S karboxylovými kyselinami, ich anhydridmi, halogenidmi kyselín, estermi a inými derivátmi vznikajú amidy. S aldehydmi a ketónmi - Schiffovými zásadami, ktoré možno redukovať na zodpovedajúce amíny (reduktívna aminácia).
- Pri 1000 °C reaguje amoniak s uhlím, pričom vzniká kyselina kyanovodíková HCN a čiastočne sa rozkladá na dusík a vodík. Môže tiež reagovať s metánom za vzniku rovnakej kyseliny kyanovodíkovej:
História mien
Amoniak (v európskych jazykoch jeho názov znie ako „amoniak“) vďačí za svoj názov oáze Ammon v severnej Afrike, ktorá sa nachádza na križovatke karavánových ciest. V horúcom podnebí sa močovina (NH 2) 2 CO obsiahnutá v živočíšnom odpade rozkladá obzvlášť rýchlo. Jedným z produktov rozkladu je amoniak. Podľa iných zdrojov dostal amoniak svoj názov zo staroegyptského slova amoniak. Takzvaní ľudia uctievajúci boha Amona. Počas rituálnych obradov šnupali čpavok NH 4 Cl, ktorý pri zahriatí odparuje čpavok.
Kvapalný amoniak
Kvapalný amoniak, aj keď v malej miere, disociuje na ióny (autoprotolýza), v ktorej sa prejavuje jeho podobnosť s vodou:
Samoionizačná konštanta kvapalného amoniaku pri teplote -50 °C je približne 10 -33 (mol/l)².
Kovové amidy vznikajúce pri reakcii s amoniakom obsahujú záporný NH 2 − ión, ktorý tiež vzniká pri samoionizácii amoniaku. Amidy kovov sú teda analógmi hydroxidov. Rýchlosť reakcie sa zvyšuje pri prechode z Li na Cs. Reakcia sa výrazne urýchli v prítomnosti aj malých nečistôt H20.
Roztoky kov-amoniak majú kovovú elektrickú vodivosť, atómy kovov sa v nich rozpadajú na kladné ióny a solvatované elektróny obklopené molekulami NH3. Kovovo-amoniakové roztoky obsahujúce voľné elektróny sú najsilnejšie redukčné činidlá.
komplexná formácia
Vďaka svojim vlastnostiam darcu elektrónov môžu molekuly NH3 vstupovať do komplexných zlúčenín ako ligand. Zavedenie prebytočného amoniaku do roztokov solí d-kovov teda vedie k tvorbe ich aminokomplexov:
Komplex je zvyčajne sprevádzaný zmenou farby roztoku. Takže v prvej reakcii sa modrá farba (CuSO 4) zmení na tmavo modrú (farba komplexu) a v druhej reakcii sa farba zmení zo zelenej (Ni (NO 3) 2) na modrofialovú. Najsilnejšie komplexy s NH 3 tvoria chróm a kobalt v oxidačnom stave +3.
Biologická úloha
Amoniak je konečným produktom metabolizmu dusíka u ľudí a zvierat. Vzniká pri metabolizme bielkovín, aminokyselín a iných dusíkatých zlúčenín. Pre telo je vysoko toxický, takže väčšina amoniaku sa počas ornitínového cyklu premení v pečeni na neškodnejšiu a menej toxickú zlúčeninu – močovinu (močovinu). Močovina sa potom vylučuje obličkami a časť močoviny sa môže premeniť pečeňou alebo obličkami späť na amoniak.
Amoniak môže pečeň využiť aj na reverzný proces - resyntézu aminokyselín z amoniaku a keto analógov aminokyselín. Tento proces sa nazýva "reduktívna aminácia". Kyselina asparágová sa teda získava z kyseliny oxaloctovej, kyselina glutámová sa získava z kyseliny α-ketoglutarovej atď.
Fyziologické pôsobenie
Podľa fyziologického účinku na organizmus patrí do skupiny látok s dusivým a neurotropným účinkom, ktoré pri vdýchnutí môžu spôsobiť toxický pľúcny edém a ťažké poškodenie nervového systému. Amoniak má lokálne aj resorpčné účinky.
Pary amoniaku silne dráždia sliznice očí a dýchacích orgánov, ako aj pokožku. Toto je osoba a vníma ju ako štipľavý zápach. Výpary amoniaku spôsobujú hojné slzenie, bolesť očí, chemické poleptanie spojovky a rohovky, stratu zraku, záchvaty kašľa, začervenanie a svrbenie kože. Keď sa skvapalnený amoniak a jeho roztoky dostanú do kontaktu s pokožkou, dochádza k pocitu pálenia, je možné chemické popálenie s pľuzgiermi a ulceráciami. Okrem toho skvapalnený amoniak absorbuje teplo pri odparovaní a pri kontakte s pokožkou vznikajú omrzliny rôzneho stupňa. Zápach amoniaku je cítiť pri koncentrácii 37 mg/m³.
Aplikácia
Amoniak je jedným z najvýznamnejších produktov chemického priemyslu, jeho ročná svetová produkcia dosahuje 150 miliónov ton. Používa sa najmä na výrobu dusíkatých hnojív (dusičnan a síran amónny, močovina), výbušnín a polymérov, kyseliny dusičnej, sódy (amoniaková metóda) a iných chemických produktov. Ako rozpúšťadlo sa používa kvapalný amoniak.
Miera spotreby na tonu čpavku
Výroba jednej tony čpavku v Rusku spotrebuje v priemere 1200 nm³ zemný plyn, v Európe - 900 nm³.
Bieloruský „Grodno Azot“ spotrebuje 1200 Nm³ zemného plynu na tonu čpavku, po modernizácii sa očakáva pokles spotreby na 876 Nm³.
Ukrajinskí výrobcovia spotrebujú od 750 Nm³ do 1170 Nm³ zemného plynu na tonu čpavku.
Technológia UHDE uvádza spotrebu 6,7 - 7,4 Gcal energetických zdrojov na tonu čpavku.
Amoniak v medicíne
Pri uhryznutí hmyzom sa amoniak aplikuje zvonka vo forme pleťových vôd. 10% vodný roztok amoniaku je známy ako amoniak.
Možné vedľajšie účinky: pri dlhšej expozícii (inhalačné použitie) môže amoniak spôsobiť reflexné zastavenie dýchania.
Lokálna aplikácia je kontraindikovaná pri dermatitíde, ekzémoch, iných kožných ochoreniach, ako aj pri otvorených traumatických poraneniach kože.
V prípade náhodného poškodenia sliznice oka vypláchnite vodou (15 minút každých 10 minút) alebo 5% roztokom kyseliny boritej. Nepoužívajú sa oleje a masti. S porážkou nosa a hltanu - 0,5% roztok kyseliny citrónovej alebo prírodných štiav. V prípade požitia vypite vodu, ovocný džús, mlieko, najlepšie 0,5% roztok kyseliny citrónovej alebo 1% roztok kyseliny octovej, kým sa obsah žalúdka úplne nezneutralizuje.
Interakcia s inými liekmi nie je známa.
Výrobcovia amoniaku
Výrobcovia amoniaku v Rusku
| Spoločnosť | 2006, tisíc ton | 2007, tisíc ton |
|---|---|---|
| JSC "Togliattiazot"]] | 2 635 | 2 403,3 |
| OAO NAK Azot | 1 526 | 1 514,8 |
| JSC "Akron" | 1 526 | 1 114,2 |
| OAO Nevinnomyssky Azot, Nevinnomyssk | 1 065 | 1 087,2 |
| Minudobreniya JSC (Rossosh) | 959 | 986,2 |
| JSC "AZOT" | 854 | 957,3 |
| OJSC "Azot" | 869 | 920,1 |
| OJSC "Kirovo-Chepetsky Khim. kombinovať" | 956 | 881,1 |
| OJSC Čerepovec Azot | 936,1 | 790,6 |
| ZAO Kuibyshevazot | 506 | 570,4 |
| Gazprom Salavat neftechim" | 492 | 512,8 |
| "Minerálne hnojivá" (Perm) | 437 | 474,6 |
| OJSC Dorogobuzh | 444 | 473,9 |
| Minerálne hnojivá OAO Voskresensk | 175 | 205,3 |
| OJSC Shchekinoazot | 58 | 61,1 |
| OOO MendelejevskAzot | - | - |
| Celkom | 13 321,1 | 12 952,9 |
Rusko predstavuje asi 9 % svetovej produkcie amoniaku. Rusko je jedným z najväčších svetových vývozcov čpavku. Asi 25 % celkovej produkcie čpavku ide na export, čo je asi 16 % svetového exportu.
Výrobcovia čpavku na Ukrajine
- Jupiterove oblaky sú tvorené čpavkom.
pozri tiež
Poznámky
Odkazy
- //
- // Encyklopedický slovník Brockhausa a Efrona: V 86 zväzkoch (82 zväzkov a 4 dodatočné). - St. Petersburg. 1890-1907.
- // Encyklopedický slovník Brockhausa a Efrona: V 86 zväzkoch (82 zväzkov a 4 dodatočné). - St. Petersburg. 1890-1907.
amoniak. Molekuly tohto plynu majú tvar pyramídy, v jednom z vrcholov ktorej je atóm dusíka. Sú tvorené vodíkovými väzbami a vyznačujú sa silnou polaritou. To vysvetľuje nezvyčajné fyzikálne vlastnosti amoniaku: jeho teplota topenia je asi -80 stupňov. Je vysoko rozpustný vo vode, alkoholoch a iných organické rozpúšťadlá.
Aplikácia amoniaku
Amoniak hrá dôležitá úloha v priemysle. S jeho pomocou získajte dusíkaté hnojivá aplikovaný v poľnohospodárstvo, kyselina dusičná a dokonca aj výbušniny. Amoniak, ktorý lekári bežne používajú, sa tiež vyrába pomocou amoniaku. Štipľavý zápach tohto plynu dráždi sliznicu nosa a stimuluje dýchacie funkcie. Amoniak používa sa pri mdlobách alebo otravách alkoholom. Existuje aj vonkajšie použitie amoniaku v medicíne. Je to vynikajúce antiseptikum, ktoré si chirurgovia ošetrujú ruky pred operáciami.
Amoniak, ako produkt rozkladu amoniaku, sa používa pri spájkovaní kovov. o vysoká teplota amoniak sa získava z amoniaku, ktorý chráni kov pred tvorbou oxidového filmu.
Otrava amoniakom
Amoniak je toxická látka. Často v práci dochádza k otrave týmto plynom, ktorá je sprevádzaná dusením, delíriom a silným vzrušením. Ako môžete pomôcť niekomu, kto je v tejto situácii? Najprv mu musíte vypláchnuť oči vodou a dať si gázový obväz predtým navlhčený v slabom roztoku kyseliny citrónovej. Potom je potrebné ho odstrániť zo zóny, kde je pozorovaná vysoká koncentrácia amoniaku. Otrava je možná pri koncentrácii okolo 350 mg/m³.
Ak sa amoniak dostane do kontaktu s pokožkou, okamžite postihnuté miesta umyte vodou. V závislosti od množstva amoniaku na koži môže byť silné začervenanie alebo chemické popáleniny s pľuzgiermi.
V závodoch, kde sa vyrába amoniak, boli zavedené prísne opatrenia požiarna bezpečnosť. Faktom je, že zmes amoniaku a vzduchu je vysoko horľavá. Nádoby, kde je uložený, môžu pri zahriatí ľahko explodovať.
Chemické vlastnosti amoniaku
Amoniak reaguje s mnohými kyselinami. V dôsledku tejto interakcie sa získajú rôzne amónne soli. Pri reakcii s viacsýtnymi kyselinami sa získajú dva typy solí (v závislosti od počtu mólov amoniaku).
