Aké anorganické látky sú zahrnuté v kompozícii. anorganické látky
Po oboznámení sa s chemickými prvkami obsiahnutými v živých organizmoch prejdime k štúdiu látok, v ktorých sú tieto prvky zahrnuté. Medzi nimi sú anorganické (voda, minerálne soli a kyseliny) a Organické zlúčeniny(obr. 1). Väčšina hmoty v živých organizmoch obsahuje vodu.
Voda. Obsah vody v živých organizmoch je 60 – 75 % ich hmotnosti a v niektorých, ako sú medúzy, až 98 %. v listoch a šťavnaté ovocie Obsah vody v rastlinách môže dosiahnuť aj 98 %.
Množstvo vody nie je rovnaké rôzne tkaniny a orgánov. Takže u človeka v šedej hmote mozgu je jeho obsah 85% a v kostnom tkanive - 22%. Najvyšší obsah vody v tele sa pozoruje v embryonálnom období (95 %) a s vekom postupne klesá. Bez použitia vody môže človek žiť nie viac ako 5-7 dní.
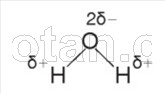
Ako už viete z kurzu chémie, molekula vody (H 2 0) pozostáva z dvoch atómov vodíka spojených kovalentnými polárnymi väzbami s atómom kyslíka.
Väzby H–O–H sú navzájom umiestnené pod uhlom 104,5°. Kyslík má väčšiu elektronegativitu ako vodík, takže atóm kyslíka priťahuje zdieľané elektrónové páry a získava čiastočne záporný náboj. Atómy vodíka získavajú čiastočne kladný náboj, t.j. molekula vody je polárny.
Medzi atómom kyslíka jednej molekuly vody a atómom vodíka inej molekuly vzniká elektrostatická príťažlivosť. Takáto interakcia
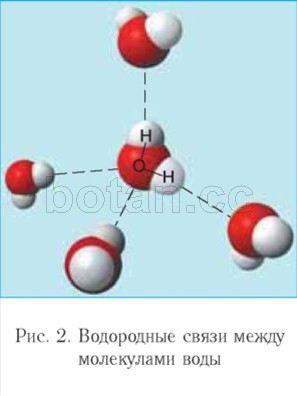
slabšia ako iónová väzba sa nazýva vodíková väzba. Každá molekula vody ako malý magnet priťahuje k sebe ďalšie štyri molekuly v dôsledku tvorby vodíkových väzieb (obr. 2). V dôsledku tvorby vodíkových väzieb sú molekuly vody navzájom spojené. Preto voda pri teplotách od 0 ° C do 100 ° C môže zadržať kvapalinu stav agregácie, zatiaľ čo podobné zlúčeniny vodíka (napríklad H 2 S, NH 3, HF) sú plyny.
Biologická úloha vody v živých organizmoch je spojená s jej vlastnosťami, predovšetkým s malou veľkosťou molekúl, ich polaritou a schopnosťou vytvárať vodíkové väzby medzi sebou a s inými zlúčeninami.
Je to voda, ktorá určuje objem buniek a intracelulárne (turgor) tlak. Molekuly vody sú vďaka svojej polarite schopné vytvárať okolo iónov a polárnych molekúl takzvané hydratačné obaly. To prispieva k oddeľovaniu častíc a zabraňuje ich zlepovaniu, čo je dôležité najmä napríklad pre molekuly bielkovín.
Polarita molekúl a schopnosť vytvárať vodíkové väzby vytvára vodu univerzálne rozpúšťadlo pre polárne látky, lepšie ako väčšina známych tekutín. Podľa rozpustnosti vo vode sa zlúčeniny bežne delia na rozpustné, príp hydrofilné(z gréčtiny. sprievodca- voda, fshsha- láska), a nerozpustná, príp hydrofóbne(z gréčtiny. phobos- strach). Hydrofilné látky sú mono- a disacharidy, mnohé minerálne soli a kyseliny, nižšie alkoholy, nižšie karboxylové kyseliny atď. Vyššie karboxylové kyseliny, tuky a niektoré ďalšie látky sú hydrofóbne.
Voda je médium pre prúdenie mnohých metabolické procesy. Väčšina chemické reakcie v tele sa vyskytuje práve vo vodných roztokoch. Vstup a výstup látok z bunky sa spravidla uskutočňuje v rozpustenej forme. Voda sa priamo podieľa na mnohých chemických reakciách, ktoré prebiehajú v bunkách, vrátane procesov štiepenia organických zlúčenín. Je to jedna z počiatočných látok v reakciách fotosyntézy. Kyslík produkovaný počas fotosyntézy sa uvoľňuje pri rozpade molekúl vody.
Voda ako rozpúšťadlo sa zúčastňuje javov osmózy, hry dôležitá úloha v činnosti buniek tela. Osmóza- ide o pohyb molekúl vody cez semipermeabilnú membránu (napríklad cez cytoplazmatickú membránu bunky) z oblasti s nižšou koncentráciou rozpustených látok (napríklad solí, cukrov alebo močoviny) do oblasti s vyššou koncentráciou týchto látok (obr. 3). V dôsledku osmózy sa koncentrácie rozpustených látok v bunke a extracelulárnom médiu vyrovnávajú.
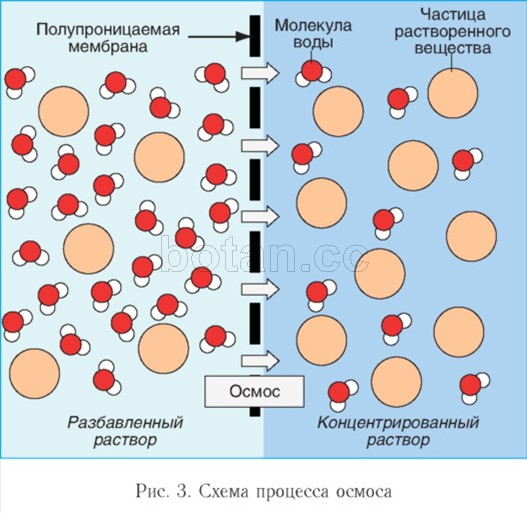
Ak sú roztok a rozpúšťadlo (napríklad voda) oddelené selektívne priepustnou membránou, pozoruje sa pohyb molekúl rozpúšťadla cez membránu do roztoku. Aby sa zabránilo vniknutiu rozpúšťadla, musí sa na roztok vyvinúť určitý tlak, ktorý sa nazýva osmotický tlak. Čím je roztok koncentrovanejší, tým vyšší je jeho osmotický tlak.
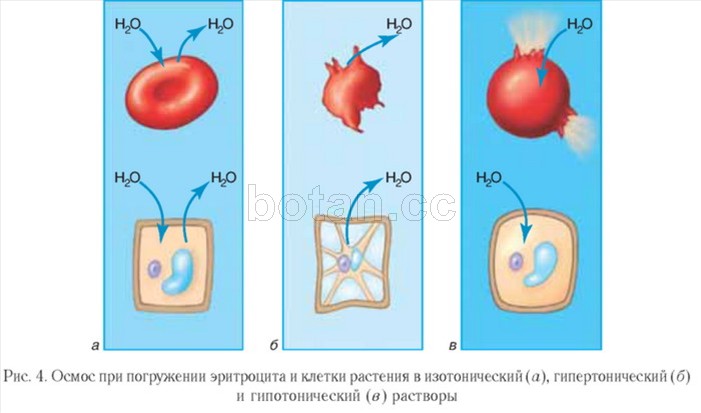
Roztoky, ktorých osmotický tlak je rovnaký ako v bunkách, sa nazývajú izotonické. Objem buniek ponorených do izotonických roztokov zostáva nezmenený (obr. 4, a). V medicíne sa používajú izotonické roztoky, najmä fyziologický roztok (vodný roztok NaCl s hmotnostným zlomkom 0,9 %). Používajú sa pri silnej dehydratácii a strate krvi pacientmi, aby sa rozpustili lieky podávané injekciou.
Roztok, ktorého osmotický tlak je vyšší ako v bunkách, sa nazýva hypertonický. Bunky ponorené do hypertonického roztoku strácajú vodu a zmenšujú svoj objem, t.j. zmenšujú sa (obr. 4, b). Hypertonický fyziologický roztok nachádza využitie pri liečbe rán. Gázový obväz navlhčený takýmto roztokom dobre absorbuje hnis, čo pomáha pri čistení a hojení rany.
Opačný obraz pozorujeme, keď sú bunky ponorené do hypotonického roztoku, v ktorom je koncentrácia rozpustených látok nižšia ako v bunkách. V tomto prípade do bunky vnikne voda, bunka napučí a môže lyzovať, t.j. prasknúť (obr. 4, v).
Tiež spojené s vodou regulácia tepelný režim organizmov. Voda má vysokú tepelnú kapacitu - schopnosť absorbovať veľké množstvo teplo pre malé zmeny teploty. Voda vďaka tomu bráni náhlym zmenám teploty v bunkách a celkovo v tele aj pri kolísaní teplôt životné prostredie sú dostatočne veľké.
Celkový počet vodíkových väzieb medzi molekulami vody sa mení s teplotou. Keď sa ľad topí, asi 15% vodíkových väzieb sa zničí a pri 40 ° C - polovica. Pri prechode do parného stavu sú všetky vodíkové väzby zničené. Pri zmene teploty vonkajšie prostredie voda absorbuje (alebo uvoľňuje) teplo v dôsledku rozpadu (alebo tvorby) mnohých vodíkových väzieb. To vysvetľuje vysokú špecifické teplo voda.
Pri vyparovaní vody organizmami (transpirácia u rastlín, potenie u cicavcov) sa spotrebuje veľa tepla, ktoré ich chráni pred prehriatím.
Vďaka svojej vysokej tepelnej vodivosti poskytuje voda Rovnomerné rozdelenie teplo medzi telesnými tkanivami (napríklad cez obehový systém). Voda sa teda podieľa na regulácii tepelného režimu organizmu.
minerálne soli a kyseliny. Minerálne soli sú potrebné na udržanie vitálnej aktivity buniek a tela ako celku. V živých organizmoch sú buď v rozpustenej forme (disociované na ióny), alebo v pevnom stave. Z biologického hľadiska sú medzi iónmi najdôležitejšie katióny K +, Na +, Ca 2+, Mgr + a anióny SG, HCO3, HPO ^, H0PO4.
Celkový obsah minerálnych solí v rôzne bunky sa pohybuje od jedného do niekoľkých percent. Ich úloha v bunke je rôzna. Rozdielne koncentrácie iónov K + a Na + vo vnútri a mimo buniek teda vedú k vzniku rozdielu v elektrických potenciáloch na cytoplazmatickej membráne, čo je veľmi dôležité pre prenos nervových vzruchov, ako aj pre transport látok membrána. S poklesom tohto rozdielu klesá excitabilita buniek.
Niektoré ióny sú nevyhnutné pre syntézu organických látok. Napríklad zvyšky kyseliny fosforečnej sú súčasťou nukleotidov a ATP, ión Fe 2+ je súčasťou hemoglobínu, Mg 2+ je súčasťou chlorofylu atď. Ióny NO3, NHJ sú zdrojom atómov dusíka, iónu SO 2- - atómov síry, ktoré sú potrebné pre autotrofné organizmy na syntézu aminokyselín. Regulačnú funkciu a aktiváciu mnohých enzýmov vykonávajú ióny Ca2+ a Mg2+. Okrem toho ióny Mg 2 * aktivujú energetický metabolizmus a syntézu ATP.
Zlúčeniny vápnika (napríklad CaCO 3) sú súčasťou schránok mäkkýšov, schránok kôrovcov a iných živočíchov. Pri niektorých protestoch je vnútrobunková kostra postavená z oxidu kremičitého Si02 alebo síranu strontnatého SrS04.
Účinkujú aj anorganické kyseliny dôležité vlastnosti v tele. Takže v žalúdku stavovcov kyselina chlorovodíková vytvára kyslé prostredie, čo prispieva k ničeniu patogénov a aktivácii enzýmov žalúdočnej šťavy a stimuluje kontrakcie stien žalúdka. Kyselina uhličitá a jej anióny tvoria hydrogénuhličitanový tlmivý systém a anióny kyseliny fosforečnej tvoria fosfátový tlmivý systém.
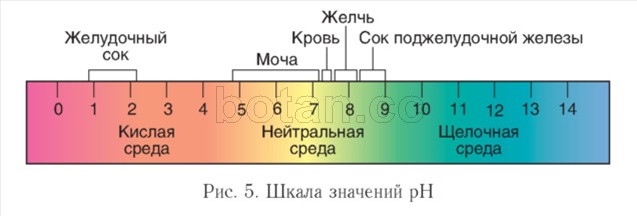
Kyslosť prostredia. Priebeh biochemických reakcií v živých organizmoch výrazne ovplyvňuje koncentrácia vodíkových iónov (H +) - kyslosť prostredia. AT v neutrálnych roztokoch je táto koncentrácia 1 (G 7 mol/l. Na charakterizáciu kyslosti média je vhodné použiť hodnota pH ( pH) a shkšarlátové pH(obr. 5).
Vo vodných roztokoch má hodnota pH zvyčajne hodnoty od 0 do 14. Neutrálne prostredie sa vyznačuje hodnotou pH \u003d 7, v zásaditom prostredí je pH väčšie ako 7, v kyslom je menej ako 7. Čím viac sa hodnota pH líši od hodnoty 7, tým je roztok kyslejší alebo zásaditejší.
Vo vnútri buniek je médium neutrálne alebo mierne zásadité (pH = 7,0-7,3), v krvi je pH o niečo vyššie ako v bunkách a zvyčajne sa pohybuje v rozmedzí 7,35-7,45. V tráviacom trakte sa pH veľmi líši. Extrémne hodnoty pH sú charakteristické pre žalúdok (1-2) a tenké črevo (viac ako 8). V moči sa pozoruje výrazné kolísanie pH (4,8-7,4).
Koncept tlmivých roztokov.Živé organizmy ako celok a ich jednotlivé bunky majú schopnosť udržiavať kyslosť prostredia na určitej úrovni. Pri udržiavaní mierne zásaditej reakcie extracelulárneho prostredia
kyselina uhličitá H 2 CO 3 a hydrokarbonátový ión HCO3. Kyselina uhličitá je slabý elektrolyt, v roztoku je určitá časť jej molekúl disociovaná a pozoruje sa rovnováha:
H2C03^H+ + HCOd.
Ak sa z akéhokoľvek dôvodu zvýši koncentrácia iónov H + v roztoku (prostredie sa stane kyslejším), anióny HCO ich naviažu:
H+ + HCO3 ->. H2C03.
Ak kyslosť média klesá, molekuly kyseliny uhličitej disociujú a uvoľňujú ďalšie vodíkové ióny:
H2C03H++ HCO3.
V roztoku sa teda udržiava relatívne konštantná koncentrácia iónov H +. Podobne anióny kyseliny fosforečnej HoPO^ a HPO^ udržiavajú vo vnútri buniek neutrálne alebo mierne zásadité prostredie. Roztoky, v ktorých je pri zmene zloženia média zabezpečená relatívna stálosť koncentrácie vodíkových iónov (H +), tzv. vyrovnávacia pamäť.
1. Aké anorganické látky sú súčasťou živých organizmov?
2. Aké látky sa nazývajú hydrofilné? Hydrofóbne? Uveďte príklady.
3. Opíšte biologická úloha minerálne soli a kyseliny.
4. Koľko vody obsahujú živé organizmy? Od čoho to závisí? Prečo rastliny vädnú pri nedostatku vody?
5. Dva roztoky glukózy sú oddelené membránou, ktorá neprepúšťa molekuly glukózy, ale prepúšťa vodu. Koncentrácia glukózy v prvom roztoku je 1%, v druhom - 0,1%. Čo sa stane s molekulami vody? Aký je názov tohto fenoménu?
6. Aké sú hlavné funkcie vody v živých organizmoch? Ako fyzické, tak aj Chemické vlastnosti voda spojená s jej biologickými funkciami?
7. Prečo sa podľa vás väčšina polárnych látok dobre rozpúšťa vo vode, kým nepolárne látky sú v nej spravidla nerozpustné?
8. Tlmiace vlastnosti extracelulárneho prostredia zabezpečuje kyselina uhličitá a hydrogénuhličitanový ión, vo vnútri buniek túto funkciu vykonávajú anióny kyseliny fosforečnej. Prečo tieto zlúčeniny umožňujú udržiavať určitú koncentráciu vodíkových iónov v roztokoch, zatiaľ čo dusík a kyselina chlorovodíková, ako aj ich anióny takéto vlastnosti nemajú?
- § 1. Obsah chemických prvkov v tele. Makro- a mikroprvky
- § 2. Chemické zlúčeniny v živých organizmoch. anorganické látky
- § 10. História objavenia cely. Vytvorenie bunkovej teórie
- § 15. Endoplazmatické retikulum. Golgiho komplex. lyzozómy
Kapitola 1. Chemické zložky živých organizmov
Kapitola 2. Bunka - stavebná a funkčná jednotka živých organizmov
Kapitola 3
1. Aké anorganické látky sú súčasťou živých organizmov?
Zloženie živých organizmov zahŕňa také anorganické látky, ako je voda, minerálne soli, anorganické (minerálne) kyseliny a niektoré ďalšie.
2. Aké látky sa nazývajú hydrofilné? Hydrofóbne? Uveďte príklady.
Hydrofilné látky sú látky, ktoré aktívne interagujú s molekulami vody za vzniku vodíkových väzieb. Hydrofilné látky sú spravidla vysoko rozpustné vo vode. Hydrofóbne látky slabo interagujú s molekulami vody, "usilujú sa" vyhnúť sa kontaktu s ňou. Takéto látky sa nerozpúšťajú vo vode. Pre základný stupeň štúdia biológie študentom stačí charakterizovať hydrofilné látky ako rozpustné vo vode a hydrofóbne látky ako v nej nerozpustné.
Hydrofilné látky sú napríklad mono- a disacharidy, nižšie alkoholy, nižšie karboxylové kyseliny, mnohé anorganické kyseliny a soli. Medzi hydrofóbne patria tuky, vyššie karboxylové kyseliny a niektoré ďalšie látky.
3. Opíšte biologickú úlohu minerálnych solí a kyselín.
Nerozpustné minerálne soli sú súčasťou rôznych nosných štruktúr živých organizmov, napríklad uhličitan vápenatý (CaCO 3) je súčasťou schránok mäkkýšov a schránok kôrovcov. Vnútrobunková kostra niektorých protistov je postavená zo síranu strontnatého (SrSO 4).
Rozpustné minerálne soli v živých organizmoch sú vo forme iónov. v vodné prostredie dochádza k ich disociácii. Z biologického hľadiska sú medzi iónmi najdôležitejšie katióny K +, Na +, Ca 2+, Mg 2+ a anióny Cl -, HCO 3 -, HPO 4 2-, H 2 RO 4 -. Iná koncentrácia K + a Na + ióny vnútri a mimo buniek vedú k objaveniu sa rozdielu elektrických potenciálov na cytoplazmatickej membráne, čo je dôležité pre prenos nervových impulzov a pre transport látok cez membránu. S poklesom tohto rozdielu klesá excitabilita buniek. Zvyšky kyseliny fosforečnej sú súčasťou nukleotidov a ATP. Fe 2+ je súčasťou hemoglobínu, Mg 2+ je súčasťou chlorofylu. Ióny NO 3 - a NH 4 + sú zdrojom atómov dusíka a ión SO 4 2 - - atómov síry, ktoré sú potrebné pre autotrofné organizmy na syntézu aminokyselín. Ióny Ca 2+ a Mg 2+ plnia regulačnú funkciu, aktivujú mnohé enzýmy. Napríklad ióny Mg 2+ aktivujú energetický metabolizmus a syntézu ATP.
Dôležité biologické funkcie plnia aj minerálne (anorganické) kyseliny. Kyselina chlorovodíková vytvára v žalúdku stavovcov a ľudí kyslé prostredie, čím prispieva k ničeniu patogénov a aktivácii enzýmov žalúdočnej šťavy a stimuluje sťahy žalúdočných stien. Anióny kyseliny fosforečnej tvoria fosfátový tlmivý systém, ktorý udržiava neutrálne alebo mierne zásadité prostredie vo vnútri buniek. Kyselina uhličitá a jej anióny tvoria bikarbonátový tlmivý systém, ktorý udržiava mierne alkalickú reakciu extracelulárneho média.
4. Koľko vody obsahujú živé organizmy? Od čoho to závisí? Prečo rastliny vädnú pri nedostatku vody?
Obsah vody závisí od typu organizmu, jeho veku, typu buniek (tkanív) a ich fyziologického stavu. Napríklad u ľudí obsahuje sivá hmota mozgu asi 85% vody a kostné tkanivo - 22%. Najvyšší obsah vody v tele sa pozoruje v embryonálnom období (asi 95 %) a s vekom postupne klesá, čo vedie k zníženiu funkčnej aktivity buniek, tkanív a organizmu ako celku.
Voda určuje objem bunky a vnútrobunkový (turgor) tlak, ktorý spôsobuje stresový stav bunkovej membrány. S nedostatkom vody v bunkách klesá tlak turgoru, takže rastliny vädnú.
5. Dva roztoky glukózy sú oddelené membránou, ktorá neprepúšťa molekuly glukózy, ale prepúšťa vodu. Koncentrácia glukózy v prvom roztoku je 1%, v druhom - 0,1%. Čo sa stane s molekulami vody? Aký je názov tohto fenoménu?
Molekuly vody sa pohybujú cez polopriepustnú membránu z menej koncentrovaného roztoku (s hmotnostným zlomkom glukózy 0,1 %) do koncentrovanejšieho roztoku (s hmotnostným podielom glukózy 1 %). Tento jav sa nazýva osmóza. Osmóza vyrovnáva koncentrácie glukózy v roztokoch oddelených polopriepustnou membránou.
6. Aké sú hlavné funkcie vody v živých organizmoch? Ako súvisia fyzikálne a chemické vlastnosti vody s jej biologickými funkciami?
Voda je súčasťou buniek a medzibunkovej hmoty, je základom krvi, lymfy, tkanivového moku, sekrétov žliaz. Určuje objem buniek a zabezpečuje udržiavanie tlaku turgoru. Voda je univerzálnym rozpúšťadlom pre polárne zlúčeniny a hlavným médiom, v ktorom prebiehajú metabolické procesy živých organizmov. Väčšina chemických reakcií v tele prebieha vo vodných roztokoch. Vstup a výstup látok z buniek sa spravidla uskutočňuje v rozpustenej forme. Voda ako rozpúšťadlo sa podieľa na javoch osmózy, vďaka čomu sa vyrovnávajú koncentrácie rozpustených látok v bunkách a extracelulárnom médiu.
Voda je priamym účastníkom mnohých biochemických reakcií, napríklad reakcií hydrolytického štiepenia (hydrolýzy) organických zlúčenín. Je to jedna z východiskových látok pri reakciách fotosyntézy. Kyslík uvoľnený počas fotosyntézy pochádza z rozkladu molekúl vody.
Voda sa podieľa na regulácii tepelného režimu organizmov. Zabezpečuje rovnomernú distribúciu tepla medzi tkanivami a orgánmi, zabraňuje náhlym teplotným zmenám v bunkách a celkovo v tele, aj keď sú teplotné výkyvy v prostredí dostatočne veľké. Pri vyparovaní vody organizmami (transpirácia u rastlín, potenie u cicavcov) sa spotrebuje veľa tepla, ktoré ich chráni pred prehriatím.
Voda je vďaka polarite molekúl a ich schopnosti vytvárať medzimolekulové vodíkové väzby s inými zlúčeninami univerzálne rozpúšťadlo a médium pre metabolické procesy. Malá veľkosť molekúl vody hrá dôležitú úlohu pri osmotických javoch. Účasť vody na regulácii tepelného režimu organizmov je spojená s jej vysokou tepelnou kapacitou, dobrou tepelnou vodivosťou a vysokým výparným teplom. To je zase spôsobené schopnosťou molekúl vody vytvárať medzi sebou početné vodíkové väzby.
7. Prečo sa podľa vás väčšina polárnych látok dobre rozpúšťa vo vode, kým nepolárne látky sú v nej spravidla nerozpustné?
Molekuly vody sú polárne, čo im umožňuje intenzívnu interakciu s inými polárnymi látkami. Voda prispieva k separácii štruktúrnych častíc polárnych zlúčenín (iónov, molekúl), ich prechodu do roztoku, vytvára hydratačné obaly okolo iónov a polárnych molekúl.
Molekuly vody interagujú s nepolárnymi zlúčeninami veľmi slabo. Takéto látky sú prakticky nerozpustné vo vode, ale ľahko rozpustné v nepolárnych rozpúšťadlách (napríklad v benzíne). Tu je vhodné pripomenúť prastaré pravidlo alchymistov: „Aké sa rozpúšťa v podobnom“.
osem*. Tlmiace vlastnosti extracelulárneho prostredia zabezpečuje kyselina uhličitá a hydrogénuhličitanový ión, vo vnútri buniek túto funkciu vykonávajú anióny kyseliny fosforečnej. Prečo tieto zlúčeniny umožňujú udržiavať určitú koncentráciu vodíkových iónov v roztokoch, zatiaľ čo kyselina dusičná a chlorovodíková, ako aj ich anióny, takéto vlastnosti nemajú?
Kyselina uhličitá je slabý elektrolyt. Vo vodných roztokoch je len malá časť jeho molekúl disociovaná na ióny, preto sú v medzibunkovom prostredí spolu s hydrogénuhličitanovými iónmi (HCO 3 -) obsiahnuté aj nedisociované molekuly kyseliny uhličitej (H 2 CO 3). Vo vnútri buniek existuje určitá rovnováha (rovnováha) medzi aniónmi kyseliny fosforečnej H 2 PO 4 - a HPO 4 2-:
H 2 CO 3 ↔ H + + HCO 3 -
H 2 RO 4 – ↔ H + + HRO 4 2–
S poklesom kyslosti média sa rovnováha posúva doprava - uvoľňujú sa ďalšie vodíkové ióny (H +). So zvýšením kyslosti sa rovnováha posúva doľava - dochádza k väzbe "extra" iónov H +. Vďaka tomu sa reakcia extracelulárneho prostredia (resp. intracelulárneho obsahu) prakticky nemení.
Kyselina dusičná a chlorovodíková sú silné elektrolyty. Keď sa rozpustia vo vode, takmer úplne disociujú na ióny:
HNO 3 → H + + NO 3 -
HCl → H + + Cl –
Disociácia silných elektrolytov je prakticky nevratná, preto ich roztoky nemajú pufrovacie vlastnosti.
* Úlohy označené hviezdičkou vyžadujú od študentov, aby predložili rôzne hypotézy. Preto by sa učiteľ pri hodnotení mal zamerať nielen na tu uvedenú odpoveď, ale brať do úvahy každú hypotézu, hodnotiť biologické myslenie žiakov, logiku ich uvažovania, originalitu myšlienok atď. je vhodné oboznámiť študentov s uvedenou odpoveďou.
Ako už vieme, bunka pozostáva z chemických látok organické a anorganické typy. Hlavnými anorganickými látkami, ktoré tvoria bunku, sú soli a voda.
Voda ako súčasť života
Voda je dominantnou zložkou všetkých organizmov. Dôležité biologické funkcie vody vykonávajú jedinečné vlastnosti jeho molekuly, najmä prítomnosť dipólov, ktoré umožňujú vznik vodíkových väzieb medzi bunkami.
Vďaka molekulám vody v tele živých bytostí dochádza k procesom tepelnej stabilizácie a termoregulácie. Proces termoregulácie nastáva v dôsledku vysokej tepelnej kapacity molekúl vody: vonkajšie zmeny teploty neovplyvňujú zmeny teploty vo vnútri tela.
Vďaka vode, orgány Ľudské telo zachovávajú svoju elasticitu. Voda je jednou z hlavných zložiek mazacích tekutín potrebných pre kĺby stavovcov alebo perikardiálny vak.
Je obsiahnutý v hliene, čo uľahčuje pohyb látok cez črevá. Voda je súčasťou žlče, sĺz a slín.
Soli a iné anorganické látky
Bunky živého organizmu okrem vody obsahujú také anorganické látky, ako sú kyseliny, zásady a soli. Väčšina dôležitosti v živote organizmu majú Mg2+, H2PO4, K, CA2, Na, C1-. Slabé kyseliny záruka stabilná vnútorné prostredie bunky (mierne alkalické).
Koncentrácia iónov v medzibunkovej látke a vo vnútri bunky môže byť rôzna. Takže napríklad ióny Na + sú sústredené iba v medzibunkovej tekutine, zatiaľ čo K + sa nachádza výlučne v bunke.
Prudké zníženie alebo zvýšenie počtu určitých iónov v zložení bunky vedie nielen k jej dysfunkcii, ale aj k smrti. Napríklad pokles množstva Ca + v bunke spôsobuje kŕče vo vnútri bunky a jej ďalšiu smrť.
Niektoré anorganické látky často interagujú s tukmi, bielkovinami a sacharidmi. Takže ukážkový príklad sú organické zlúčeniny s fosforom a sírou.
Síra, ktorá je súčasťou proteínových molekúl, je zodpovedná za tvorbu molekulárnych väzieb v tele. Vďaka syntéze fosforu a organických látok sa z molekúl bielkovín uvoľňuje energia.
Soli vápnika
Soli vápnika prispievajú k normálnemu vývoju kostného tkaniva, ako aj fungovaniu mozgu a miechy. Metabolizmus vápnika v tele sa uskutočňuje vďaka vitamínu D. Nadbytok alebo nedostatok vápenatých solí vedie k dysfunkcii tela.
