Ce compuși reacţionează cu apa. Rolul apei în procesele chimice
Golikova Olga
Prezentarea reflectă proprietățile fizice ale apei; se da clasificarea substantelor in functie de solubilitatea lor in apa; determinarea soluţiilor apoase şi a electroliţilor. Sunt prezentate principalele prevederi ale teoriei disocierii electrolitice (TED). Sunt date definiţii ale acizilor, bazelor şi sărurilor din poziţia TED Rolul apei este prezentat ca vehiculși ca participant la reacții chimice
Descarca:
Previzualizare:
Pentru a utiliza previzualizarea prezentărilor, creați un cont Google (cont) și conectați-vă: https://accounts.google.com
Subtitrările diapozitivelor:
Completat de o elevă de clasa a 11-a Golikova Olga Prezentarea la chimie pe tema: Rolul apei în reacții chimice
Apa este cel mai comun solvent de pe Pământ, determinând în mare măsură natura chimiei terestre ca știință. Cea mai mare parte a chimiei, la începuturile sale ca știință, a început tocmai ca chimia soluțiilor apoase de substanțe. Denumire sistematică: oxid de hidrogen Denumiri tradiționale: apă Formula chimica: H2O Masă molară: 18,01528 g/mol
Apa este un lichid incolor, inodor și fără gust, tbp = 100 °C, t pl = 0 °C, p = 1g/cm 3 (la 4 °C). Apa nu conduce electricitate, slab conductor de căldură, căldura specifică apa este foarte mare. Apa este singura substanță care se contractă atunci când se solidifică. Prin urmare, densitatea gheții este mai mică decât densitatea apei lichide. Acesta este motivul pentru care gheața plutește la suprafața apei. Apă
Apa este unică Substanta chimica, al cărui rol în reacțiile chimice este greu de supraestimat apa Mediu de reacție Factor de disociere Reactiv de transport al substanței catalizator
Un număr mare de reacții chimice au loc în mediu acvatic. Prin solubilitate în apă, toate substanțele sunt împărțite condiționat în trei grupe.Solubilitatea substanțelor în apă
Acestea sunt sisteme omogene formate din molecule de apă, particule de dizolvat și produși ai interacțiunii lor.Procesul de hidratare este rezultatul interacțiunii apei cu moleculele solutului.Soluții apoase -
Substanțele care se descompun în ioni în soluții se disociază. Raportul dintre numărul de moli ai unei substanțe descompuse în ioni și cantitatea totală de substanță dizolvată se numește grad de disociere electrolitică.Toți electroliții se împart în: - puternici (gradul de disociere tinde spre unitate) - slabi (se disociază foarte mult). putin in solutii) Electroliti
Svante August Arrhenius (1859-1927) chimist și fizician suedez. În 1887 a formulat în sfârșit teoria disocierii electrolitice, în 1887 a explicat abaterea soluțiilor electrolitice de la legile lui Van't Hoff și legea lui Raoult (arată sens fizic factor de corecție i). El a creat teoria izohidricității, a dezvoltat teoria hidrolizei sării. El a stabilit natura exotermă a majorității proceselor de disociere a electroliților și dependența vitezei și completității acestor procese de temperatură. Teoria disocierii electrolitice
Acizii sunt electroliți care se disociază în cationi de hidrogen și anioni ai reziduului acid; Bazele sunt electroliți care se disociază în cationi metalici (amoniu sau bază organică) și anioni hidroxid. Sărurile sunt electroliți care se disociază în cationi metalici (amoniu sau bază organică) și anioni reziduuri acide Trei tipuri de electroliți
Toate mediile lichide sunt mai mult de 90-98% apă; Sângele transportă oxigen în tot corpul nutrienți, hormoni și alți compuși, în timp ce se îndepărtează dioxid de carbonși produse de descompunere Rolul apei ca vehicul
Reacție de hidratare (reacție de adiție) reacție de hidratare a compușilor acetilenici cu formarea de compuși carbonilici. Când acetilena este hidratată, se formează acetaldehidă, în cazul acetilenelor substituite - în principal cetone Apa ca participant la reacțiile chimice
Este o sursă de hidrogen pur și oxigen. Interacțiunea hidrogenului și oxigenului servește drept reacție care vă permite să vă puneți pe orbită nave spațiale Apa este implicată în procesele de electroliză
Vă mulțumim pentru atenție
1. Care este structura unei molecule de apă? Care sunt proprietățile sale fizice?
2. Extinderea rolului integrator al apei în știința naturii – între chimie, biologie, fizică și geografie. Este posibil să faceți acest lucru complet fără probleme de structurare și actualizare de integrare? 
3. Vorbește despre rolul apei în soluție probleme economice societate. 
4. Deschide problema globala umanitatea este o problemă apa dulce pe Pământ și oferă o modalitate de a o rezolva. 
5. Povestește-ne despre rolul apei în reacțiile chimice. 
6. Demonstrați că disocierea electroliților este rezultatul procesului de hidratare. Ce rol au jucat chimiștii ruși în studierea acestei părți a teoriei disocierii electrolitice? 
7. Care este gradul de disociere electrolitică? În ce grupe sunt împărțiți electroliții în funcție de gradul de disociere electrolitică? Dați exemple de reprezentanți ai fiecărui grup. 
8. Enumerați proprietățile chimice ale apei. Care dintre aceste proprietăți sunt utile în practică? 
9. Ce sunt hidrații cristalini? Ce proces stă la baza aplicării gipsului sau fabricarea pieselor de alabastru? 
10. Notați ecuațiile de reacție cu care puteți efectua următoarele transformări: 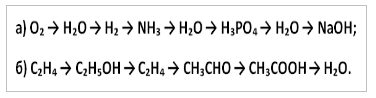
MBOU „Școala secundară Molodkovskaya”
districtul Mglinsky, regiunea Bryansk
Profesor de chimie: Shtyrhunova Tatyana Aleksandrovna
Rezumatul unei lecții de chimie din clasa a 11-a pe tema: „Rolul apei în reacțiile chimice”.
Scopul lecției: Sistematizarea cunoștințelor despre compoziția, structura, proprietățile apei, sensul, starea în natura, probleme apa dulce.
Obiectivele lecției: 1. Luați în considerare diverse zone rolul apei în reacțiile chimice.
2. Să dezvolte gândirea logică, abilitățile de obținere a informațiilor din diverse surse.. Să insufle abilitățile de autoorganizare și stima de sine.
3. Să educe elevii în raport cu apa ca substanță indispensabilă în viața tuturor organismelor vii.
Tip de lecție: Lecție combinată.
Echipament folosit:computer, proiector multimedia, carduri, tabel de solubilitate, o serie de metale active.
COR-uri folosite:prezentare pe calculator.
Cunoștințe chimice formate, abilități, abilități ale elevilor: sistematizarea cunoștințelor elevilor despre prevalența apei în natură, fizică și proprietăți chimice, domenii de aplicare a apei, extinderea cunoștințelor elevilor despre rolul apei, despre probleme de mediu apa dulce.
Competențe formate:
competențe educaționale și cognitive: dezvoltarea abilităților de a compara, analiza, dovedi, a fi capabil să rezolve următoarele sarcini practice vitale: capacitatea de a evalua starea mediu inconjurator, propunându-și ideile pentru protecția resurselor de apă din țara natală;competență informațională: dezvoltarea capacităţii de analiză şi selecţie informatie necesara, capacitatea de a pregăti și de a face mesaje, capacitatea de a folosi internetul pentru a căuta informații educaționale.
În timpul orelor.
1. Moment organizatoric.
Verificarea d.z.
Ei răspund la o serie de întrebări pe tema: Reacții reversibile și ireversibile.Echilibru chimic.
2. Discurs introductiv al profesorului.
Profesor. Băieți, în lecția de astăzi ne vom familiariza cu o substanță uimitoare, ea proprietăți fizice, anomalii, fiind în natură, valoare și rezervații naturale. Vă invit să faceți o excursie în Țara transformărilor miraculoase și să ne desfășurați lecția sub deviza „Bucuria de a vedea și înțelege este cel mai mare dar al naturii.” (A. Einstein) Cu ce locuitor al acestei țări vom întâlni astăzi?
Slide 1. Am citit o poezie despre apă.
Deci, ce substanță va fi discutată în lecție?
Formulez tema lecției, introduc scopul lecției.
„Apa... Nu ai gust, nu ai culoare, nu ai miros, nu poți fi descris – te distrezi fără să știi ce ești.
Nu ești doar necesar pentru viață, ești viața însăși. Ești un zeu, ești perfecțiune, eșticea mai mare bogăție din lume"
Aceste cuvinte au fost scrise despre apă de un scriitor francezAntoine de Saint-Exupery.
Și lecția noastră este dedicatăcel mai familiar și în același timp cel mai misteriossubstanta este apa.
Notăm subiectul lecției în caiete: « Rolul apei în reacțiile chimice.
Discurs introductiv al profesorului despre apă:
Apa este familiară și de neînțeles, uimitoare, paradoxală, misterioasă, imprevizibilă. Nu există un număr de epitete care ar putea caracteriza pe deplin această substanță unică. Ea a fost și rămâne o muză, o sursă de inspirație pentru poeți, artiști, compozitori, oameni de știință care dezvăluie de mulți ani secretele acestei mari creații a naturii și nu încetează să fie uimiți de ceea ce învață.
Cunoașterea diapozitivelor” 2-6.
Profesor. Din cursul geografiei, știți că apa este cea mai comună substanță de pe Pământ.
Mesaj 1. „Apa pe Pământ”
Apa este cea mai importantă, cea mai importantă substanță din lumea din jurul nostru. Este atât familiar, cât și necunoscut, și cunoscut și misterios... Apă naturală! Privește cerul și vei vedea nori sau nori care se întind pe kilometri. Cât de ușor plutesc! Dar nu vă imaginați că sunt fără greutate. Masa de 1 km3 de nori este de aproximativ 2000 de tone, iar în atmosfera Pământului de vapori de apă este de aproximativ 12300 km3, iar aceasta este și apă naturală. Toată lumea știe curentulpâraie de uscat: pâraie, râuri, râuri. Uneori se răspândesc larg și liber pe câmpie, alteori formează repezi puternice, cad de la o înălțime de zeci și sute de metri în cascade, ducându-și apele în oceane și mări. Aproximativ 71% din suprafața Pământului nostru este acoperită de Oceanul Mondial, reprezentând aproximativ 97% din total suprafata apei iar jumătate din litosferic.
Atât de multă sau de puțină apă pe Pământ? Foarte putin! Apa reprezintă aproximativ 2,5 miliarde km3 din întregul volum al Pământului.
Învelișul de apă al Pământului are 1,5 miliarde km3, iar restul se află în straturile adânci. Scoarta terestra. Cea mai mare parte a apei este sărată, și locuibilă, proaspătă, doar aproximativ 5 milioane km3. În fiecare an, o persoană are nevoie din ce în ce mai multă apă proaspătă, apă curată. Omenirea este amenințată de o criză din cauza poluării apei. Unele țări se confruntă deja cu o lipsă de apă proaspătă curată și sunt forțate să o importe din străinătate. Apa trebuie protejată.
Profesor. Din cursul tău de biologie, știi că apa este indisolubil legată de existența vieții pe Pământ.
Câtă apă este în corpul uman?(65%- 75%)
Știați că creierul conține80% apă.6 slide.
Mesajul 3. „Apa într-un organism viu”
Toate ființele vii de pe planeta noastră sunt 2/3 apă. În ceea ce privește conținutul de apă dintr-un organism viu, microorganismele sunt pe primul loc în masă, plantele sunt pe locul al doilea, animalele sunt pe al treilea, iar oamenii sunt pe ultimul.
Bacteriile sunt 81% apă, spori 50%, țesutul animal în medie 70%, limfa 90%. Cel mai bogat țesut în apă este corpul vitros al ochiului, care conține până la 99% umiditate.
Apa din organism îndeplinește mai multe funcții: substanțele dizolvate în ea reacționează între ele, apa ajută la îndepărtarea deșeurilor metabolice, servește ca regulator de temperatură, fiind un bun purtător de căldură, precum și un lubrifiant.
În organismele vii, apa poate fi sintetizată în țesuturi. Deci, de exemplu, într-o cămilă, grăsimea din cocoașă, oxidată, poate renunța la40 litri de apă. O persoană, care bea 2,5 litri de apă pe zi, spală zilnic stomacul cu 10 litri de lichid și evaporă 0,7 litri de apă.
2 .Structura moleculei de apă şiproprietăți fizice (7 slide și 8).
(sondaj frontal)
Slide 9. Găsiți erori chimice în text (lucrarea o facem frontal).
Profesor: Răspunsurile tale au arătat că ești pregătit pentru următoarea călătorie.
Da, rolul apei în reacțiile chimice are mai multe fațete. Slide 11.
12. Apa este un mediu de reacție.
Apa este cel mai bun solvent din lume, dizolvă multe solide, lichide și substante gazoase. Apa mărilor și oceanelor conține aproape toate elementele sistem periodic, miliarde de tone de minereuri metalice. apa oceanului Prin urmare, ei îl numesc „minereu lichid”, din el sunt extrase sodiu, clor, aur, uraniu și diverse săruri.Această proprietate a apei este de mare importanță pentru natură, aproape toate transformările chimice de pe Pământ, inclusiv cele din organismele vii, au loc în apă, în prezența ei sau cu participarea ei.
Datorită polarității mari a moleculelor, apa este capabilă să dizolve multe substanțe cu legături polare ionice și covalente.
În ceea ce privește apa, substanțele sunt împărțite în:
1) solubil2) insolubil3) ușor solubil Slide13.
Luați în considerare tabelul de solubilitate a substanțelor.
Folosind tabelul de solubilitate,scrie exemple pe tablă.
Ba(OH)2,KCl,BaSO4, CaSO4,NaNO3, CuSO4, HNO3, AgCl,FeS, Ca(OH)2
Slide 14. Apa este un factor de disociere.
Slide 15. Catalizator de apă.
Amintiți-vă, ce este un catalizator?
Slide 16. Apa este un transportator de substanțe.
Mesaj.
Literal, fiecare proces din organism are loc cu ajutorul apei. Fiecare celulă este saturată cu apă, fiecare reacție chimică are loc cu ajutorul apei. Aceasta include reacțiile chimice care au loc în corpul tău care produc energie, ajutându-te să rămâi activ și să ai un metabolism eficient. Deoarece apa este componenta sângelui care furnizează organismului dumneavoastră nutrienți, trebuie să existe suficientă apă în sânge pentru a furniza nutrienți fiecărei celule. Lipsa de apă încetinește rata metabolică.
Slide 17. Apa este un reactiv. Să ne amintim cu ce reacționează apa?
Apa este una dintre cele mai reactive substanțe.
Student: Din materialul acoperit, știm că oxizii, hidrurile, metalele alcaline interacționează cu apa.... și alte substanțe (numite ele)
Ei răspund la o serie de întrebări.
Ce se formează când un oxid bazic reacţionează cu apa? un oxid acid?.....
Notează ecuațiile de reacție într-un caiet.
Controlul asupra asimilării materialului de lecție.
Profesor: Deci, am navigat până la stația finală. Să facem câteva sarcini.
Slide 19. Cu ce substanțe reacționează apa? Notați ecuațiile reacției (Lucrează în perechi) Apoi verificăm sarcina.
Slide 18. Indicați rolul apei în procesele enumerate.
Scrieți într-un caiet, apoi verificați.
Slide 20. Despre ce în cauzăîn acest pasaj? Ce rol are apa?
Rezumând lecția.Diapozitiv 21. Christina citește un verset despre apă.
Concluzie: Ce este apa?
Slide 22. Economisiți apă.
Profesor : Amintiți-vă că alimentarea cu apă curată se epuizează în mod constant șitrebuie sa economisim apa.
10. Reflecţie.
Pe mesele elevilor sunt trei cartonașe colorate, cu ajutorul cărora vom evalua lecția.
Cartonaș albastru - "3", cartonaș galben - "4", cartonaș roșu - "5".
Cum ați evalua cunoștințele dvs. dobândite în lecția de astăzi?
Cum evaluezi munca colegilor tăi la lecție?
Cum apreciați lecția în ansamblu?
Notarea unei lecții.
11. Teme: paragraful 17, nr. 3,4,5.
