Katere anorganske snovi so vključene v sestavo. anorganske snovi
Ko smo se seznanili s kemičnimi elementi, ki jih vsebujejo živi organizmi, se obrnimo na preučevanje snovi, v katerih so ti elementi vključeni. Med njimi so anorganske (voda, mineralne soli in kisline) in organske spojine(slika 1). Večina mase živih organizmov vsebuje vodo.
Voda. Vsebnost vode v živih organizmih znaša 60-75 % njihove mase, v nekaterih, kot so meduze, pa tudi do 98 %. v listih in sočno sadje Vsebnost vode v rastlinah lahko doseže tudi 98%.
Količina vode ni enaka različne tkanine in organi. Torej je pri človeku v sivi snovi možganov njegova vsebnost 85%, v kostnem tkivu pa 22%. Najvišjo vsebnost vode v telesu opazimo v embrionalnem obdobju (95 %) in se s starostjo postopoma zmanjšuje. Brez uporabe vode lahko oseba živi največ 5-7 dni.
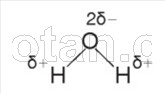
Kot že veste iz predmeta kemije, je molekula vode (H 2 0) sestavljena iz dveh vodikovih atomov, ki sta s kovalentnimi polarnimi vezmi povezana z atomom kisika.
Vezi H–O–H se nahajajo med seboj pod kotom 104,5°. Kisik ima večjo elektronegativnost kot vodik, zato atom kisika privlači skupne elektronske pare in pridobi delno negativen naboj. Atomi vodika pridobijo delno pozitiven naboj, to je molekula vode polarno.
Med atomom kisika ene molekule vode in atomom vodika druge molekule nastane elektrostatična privlačnost. Takšna interakcija
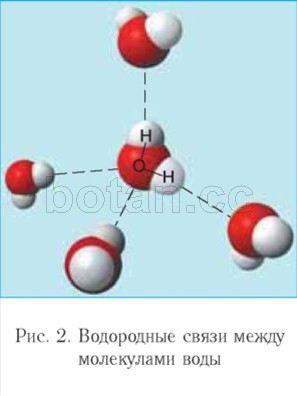
šibkejša od ionske vezi se imenuje vodikova vez. Vsaka molekula vode kot majhen magnet pritegne k sebi še štiri molekule zaradi tvorbe vodikovih vezi (slika 2). Zaradi tvorbe vodikovih vezi so molekule vode med seboj povezane. Zato lahko voda pri temperaturah od 0 ° C do 100 ° C zadrži tekočino agregatno stanje, medtem ko so podobne vodikove spojine (na primer H 2 S, NH 3 , HF) plini.
Biološka vloga vode v živih organizmih je povezana z njenimi lastnostmi, predvsem z majhnostjo molekul, njihovo polarnostjo in zmožnostjo tvorjenja vodikovih vezi med seboj in z drugimi spojinami.
Voda je tista, ki določa prostornino celic in znotrajceličnih (turgor) pritisk. Zaradi svoje polarnosti so molekule vode sposobne tvoriti tako imenovane hidratacijske lupine okoli ionov in polarnih molekul. To prispeva k ločevanju delcev in preprečuje njihovo lepljenje, kar je še posebej pomembno na primer za beljakovinske molekule.
Polarnost molekul in sposobnost tvorbe vodikovih vezi ustvarjata vodo univerzalno topilo za polarne snovi, boljši od večine znanih tekočin. Glede na topnost v vodi spojine konvencionalno delimo na topne oz hidrofilna(iz grščine. vodnik- voda, fshsha- ljubezen), in netopna, oz hidrofobna(iz grščine. fobos- strah). Hidrofilne snovi so mono- in disaharidi, številne mineralne soli in kisline, nižji alkoholi, nižje karboksilne kisline itd. Hidrofobne so višje karboksilne kisline, maščobe in nekatere druge snovi.
Voda je medij za pretok mnogih presnovni procesi. večina kemične reakcije v telesu se pojavlja ravno v vodnih raztopinah. Vstop in izstop snovi iz celice se praviloma izvaja v raztopljeni obliki. Voda je neposredno vključena v številne kemične reakcije, ki se pojavljajo v celicah, vključno s procesi cepitve organskih spojin. Je eden od izhodnih materialov v reakcijah fotosinteze. Kisik, ki nastane med fotosintezo, se sprosti, ko se molekule vode razgradijo.
Voda kot topilo sodeluje pri pojavih osmoze, igranja pomembno vlogo v aktivnosti telesnih celic. Osmoza- to je gibanje molekul vode skozi polprepustno membrano (na primer skozi citoplazmatsko membrano celice) iz območja z nižjo koncentracijo topljencev (na primer soli, sladkorjev ali sečnine) v območje z višjo koncentracijo teh snovi (slika 3). Zaradi osmoze se izenačijo koncentracije raztopljenih snovi v celici in zunajceličnem mediju.
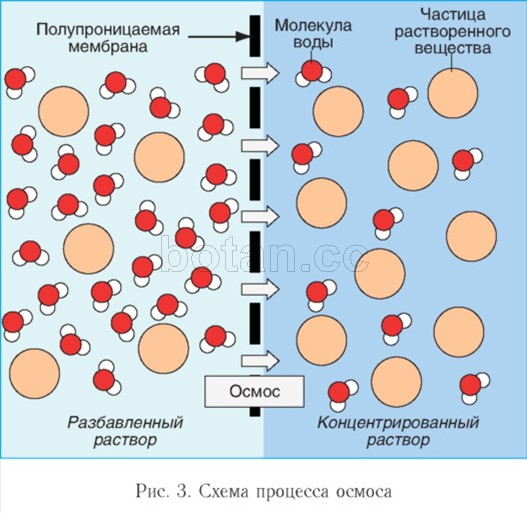
Če raztopino in topilo (na primer vodo) loči selektivno prepustna membrana, pride do premikanja molekul topila skozi membrano v raztopino. Da bi preprečili vstop topila, je treba na raztopino uporabiti določen tlak, ki se imenuje osmotski tlak. Bolj kot je raztopina koncentrirana, višji je njen osmotski tlak.
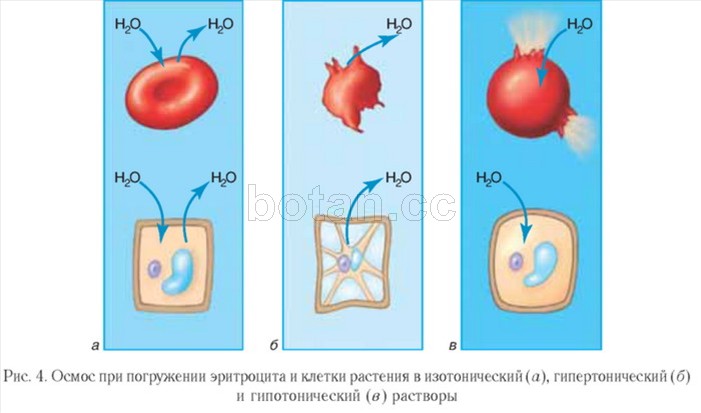
Raztopine, katerih osmotski tlak je enak kot v celicah, imenujemo izotonične. Volumen celic, potopljenih v izotonične raztopine, ostane nespremenjen (slika 4, a). V medicini se uporabljajo izotonične raztopine, zlasti fiziološka raztopina (vodna raztopina NaCl z masnim deležem 0,9%). Uporabljajo se pri hudi dehidraciji in izgubi krvi bolnikov, za raztapljanje zdravila ki se daje z injekcijo.
Raztopina, katere osmotski tlak je višji kot v celicah, se imenuje hipertonična. Celice, potopljene v hipertonično raztopino, izgubijo vodo in se zmanjšajo v volumnu, torej se skrčijo (slika 4, b). Hipertonična fiziološka raztopina najde uporabo pri zdravljenju ran. Gazni povoj, navlažen s takšno raztopino, dobro absorbira gnoj, kar pomaga pri čiščenju in celjenju rane.
Nasprotno sliko opazimo, ko celice potopimo v hipotonično raztopino, v kateri je koncentracija raztopljenih snovi nižja kot v celicah. V tem primeru voda hiti v celico, celica nabrekne in lahko lizira, torej poči (slika 4, v).
Povezan tudi z vodo ureditev toplotni režim organizmov. Voda ima visoko toplotno kapaciteto - sposobnost absorpcije veliko število toplote za majhne spremembe temperature. Zahvaljujoč temu voda preprečuje nenadne spremembe temperature v celicah in telesu kot celoti, tudi pri temperaturnih nihanjih v okolje so dovolj veliki.
Skupno število vodikovih vezi med molekulami vode se spreminja s temperaturo. Ko se led stopi, se uniči približno 15% vodikovih vezi, pri 40 ° C pa polovica. Ob prehodu v parno stanje se uničijo vse vodikove vezi. Ko se temperatura spremeni zunanje okolje voda absorbira (ali sprošča) toploto zaradi prekinitve (ali tvorbe) številnih vodikovih vezi. To pojasnjuje visoko Specifična toplota voda.
Pri izhlapevanju vode s strani organizmov (transpiracija pri rastlinah, potenje pri sesalcih) se porabi veliko toplote, ki jih ščiti pred pregrevanjem.
Zaradi visoke toplotne prevodnosti zagotavlja voda enakomerna porazdelitev toplota med telesnimi tkivi (na primer skozi cirkulacijski sistem). Tako je voda vključena v uravnavanje toplotnega režima telesa.
mineralne soli in kisline. Mineralne soli so potrebne za vzdrževanje vitalne aktivnosti celic in telesa kot celote. V živih organizmih so bodisi v raztopljeni obliki (razpadne na ione) bodisi v trdnem stanju. Z biološkega vidika so med ioni najpomembnejši kationi K +, Na +, Ca 2+, Mgr + in anioni SG, HCO3, HPO ^, H0PO4.
Skupna vsebnost mineralnih soli v različne celice se giblje od enega do nekaj odstotkov. Njihova vloga v celici je raznolika. Tako različne koncentracije ionov K + in Na + v celicah in zunaj njih povzročijo nastanek razlike v električnih potencialih na citoplazemski membrani, kar je zelo pomembno za prenos živčnih impulzov, pa tudi za transport snovi skozi membrano. Z zmanjšanjem te razlike se razdražljivost celic zmanjša.
Nekateri ioni so bistveni za sintezo organskih snovi. Na primer, ostanki fosforne kisline so del nukleotidov in ATP, ion Fe 2+ je del hemoglobina, Mg 2+ je del klorofila itd. Ioni NO3, NHJ so viri dušikovih atomov, ionov SO 2- - atomov žvepla, ki so potrebni za avtotrofne organizme za sintezo aminokislin. Regulacijsko funkcijo in aktivacijo številnih encimov izvajajo ioni Ca 2+ in Mg 2+. Poleg tega ioni Mg 2 * aktivirajo energetski metabolizem in sintezo ATP.
Kalcijeve spojine (na primer CaCO 3) so del lupin mehkužcev, lupin rakov in drugih živali. V nekaterih protestih je znotrajcelični skelet zgrajen iz silicijevega (IV) oksida Si0 2 ali stroncijevega sulfata SrS0 4 .
Delujejo tudi anorganske kisline pomembne lastnosti v telesu. Torej v želodcu vretenčarjev klorovodikova kislina ustvarja kislo okolje, ki prispeva k uničenju patogenov in aktivaciji encimov želodčnega soka ter spodbuja krčenje želodčnih sten. Ogljikova kislina in njeni anioni tvorijo bikarbonatni puferski sistem, anioni fosforne kisline pa fosfatni pufrski sistem.
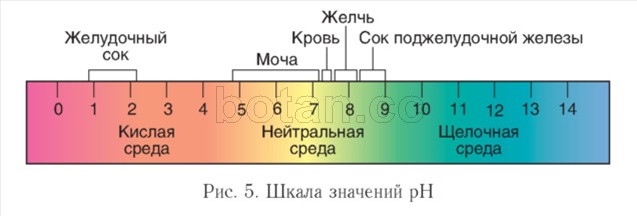
Zakisanost okolja. Na potek biokemičnih reakcij v živih organizmih pomembno vpliva koncentracija vodikovih ionov (H +) - kislost okolja. AT v nevtralnih raztopinah je ta koncentracija 1 (G 7 mol/l. Za karakterizacijo kislosti medija je priročna za uporabo pH vrednost ( pH) in shkškrlatni pH(slika 5).
V vodnih raztopinah je pH vrednost običajno od 0 do 14. Za nevtralno okolje je značilna pH vrednost \u003d 7, v alkalnem okolju je pH večji od 7, v kislem je manj kot 7. Bolj ko se pH vrednost razlikuje od 7, bolj kisla ali alkalna je raztopina.
V notranjosti celic je medij nevtralen ali rahlo alkalen (pH = 7,0-7,3), v krvi je pH nekoliko višji kot v celicah in se običajno giblje med 7,35-7,45. V prebavnem traktu se pH močno razlikuje. Ekstremne vrednosti pH so značilne za želodec (1-2) in tanko črevo (več kot 8). V urinu so opažena pomembna nihanja pH (4,8-7,4).
Koncept puferskih rešitev.Živi organizmi kot celota in njihove posamezne celice imajo sposobnost ohranjanja kislosti okolja na določeni ravni. Pri vzdrževanju rahlo alkalne reakcije zunajceličnega okolja
sodelujeta ogljikova kislina H 2 CO 3 in hidrokarbonatni ion HCO3. Ogljikova kislina je šibek elektrolit, v raztopini se določen del njenih molekul disociira in opazimo ravnovesje:
H 2 C0 3 ^ H + + HCod.
Če se iz kakršnega koli razloga koncentracija ionov H + v raztopini poveča (okolje postane bolj kislo), jih vežejo anioni HCO:
H + + HCO3 ->. H 2 C0 3.
Če se kislost medija zmanjša, se molekule ogljikove kisline disociirajo in sprostijo dodatne vodikove ione:
H 2 C0 3 H + + HCO3.
Tako se v raztopini vzdržuje relativno konstantna koncentracija ionov H +. Podobno aniona fosforjeve kisline HoPO^ in HPO^ vzdržujeta nevtralno ali rahlo alkalno okolje znotraj celic. Raztopine, pri katerih je ob spremembi sestave medija zagotovljena relativna konstantnost koncentracije vodikovih ionov (H +), se imenujejo pufer.
1. Katere anorganske snovi so del živih organizmov?
2. Katere snovi imenujemo hidrofilne? Hidrofobna? Navedite primere.
3. Opišite biološka vloga mineralne soli in kisline.
4. Koliko vode vsebujejo živi organizmi? od česa je odvisno? Zakaj rastline ovenejo, ko primanjkuje vode?
5. Dve raztopini glukoze sta ločeni z membrano, ki ne dopušča prehoda molekul glukoze, dovoljuje pa vodo. Koncentracija glukoze v prvi raztopini je 1%, v drugi - 0,1%. Kaj se zgodi z molekulami vode? Kako se imenuje ta pojav?
6. Katere so glavne funkcije vode v živih organizmih? Tako fizično kot Kemijske lastnosti voda, povezana z njenimi biološkimi funkcijami?
7. Zakaj se po vašem mnenju večina polarnih snovi dobro raztopi v vodi, medtem ko so nepolarne snovi v njej praviloma netopne?
8. Puferske lastnosti zunajceličnega okolja zagotavljajo ogljikova kislina in bikarbonatni ion, znotraj celic to funkcijo opravljajo anioni fosforne kisline. Zakaj te spojine omogočajo vzdrževanje določene koncentracije vodikovih ionov v raztopinah, medtem ko dušik in klorovodikova kislina, pa tudi njihovi anioni, nimajo takih lastnosti?
- § 1. Vsebnost kemičnih elementov v telesu. Makro- in mikroelementi
- § 2. Kemične spojine v živih organizmih. anorganske snovi
- § 10. Zgodovina odkritja celice. Ustvarjanje celične teorije
- § 15. Endoplazmatski retikulum. Golgijev kompleks. lizosomi
Poglavje 1. Kemične sestavine živih organizmov
Poglavje 2. Celica - strukturna in funkcionalna enota živih organizmov
3. poglavje
1. Katere anorganske snovi so del živih organizmov?
Sestava živih organizmov vključuje anorganske snovi, kot so voda, mineralne soli, anorganske (mineralne) kisline in nekatere druge.
2. Katere snovi imenujemo hidrofilne? Hidrofobna? Navedite primere.
Hidrofilne snovi so snovi, ki aktivno sodelujejo z molekulami vode s tvorbo vodikovih vezi. Hidrofilne snovi so praviloma zelo topne v vodi. Hidrofobne snovi šibko medsebojno delujejo z molekulami vode, "stremijo", da bi se izognile stiku z njo. Takšne snovi se ne raztopijo v vodi. Za osnovno stopnjo študija biologije je dovolj, da študenti hidrofilne snovi označijo kot topne v vodi, hidrofobne pa kot netopne v njej.
Hidrofilne snovi so na primer mono- in disaharidi, nižji alkoholi, nižje karboksilne kisline, številne anorganske kisline in soli. Hidrofobne so maščobe, višje karboksilne kisline in nekatere druge snovi.
3. Opiši biološko vlogo mineralnih soli in kislin.
Netopne mineralne soli so del različnih podpornih struktur živih organizmov, na primer kalcijev karbonat (CaCO 3) je del školjk mehkužcev in rakov. Znotrajcelični skelet nekaterih protistov je zgrajen iz stroncijevega sulfata (SrSO 4).
Topne mineralne soli v živih organizmih so v obliki ionov. v vodno okolje pride do njihove disociacije. Z biološkega vidika so med ioni najpomembnejši kationi K + , Na + , Ca 2+ , Mg 2+ in anioni Cl - , HCO 3 - , HPO 4 2- , H 2 RO 4 - . Različna koncentracija Ioni K + in Na + znotraj in zunaj celic povzročijo nastanek razlike v električnih potencialih na citoplazemski membrani, kar je pomembno za prenos živčnih impulzov in za transport snovi skozi membrano. Z zmanjšanjem te razlike se razdražljivost celic zmanjša. Ostanki fosforne kisline so del nukleotidov in ATP. Fe 2+ je del hemoglobina, Mg 2+ je del klorofila. Iona NO 3 - in NH 4 + sta vira dušikovih atomov, ion SO 4 2 - - žveplovih atomov, ki sta potrebna za avtotrofne organizme za sintezo aminokislin. Ioni Ca 2+ in Mg 2+ opravljajo regulacijsko funkcijo, aktivirajo številne encime. Ioni Mg 2+ na primer aktivirajo energetski metabolizem in sintezo ATP.
Pomembne biološke funkcije opravljajo tudi mineralne (anorganske) kisline. Klorovodikova kislina ustvarja kislo okolje v želodcu vretenčarjev in ljudi, prispeva k uničenju patogenov in aktivaciji encimov želodčnega soka ter spodbuja krčenje želodčnih sten. Anioni fosforjeve kisline tvorijo fosfatni puferski sistem, ki ohranja nevtralno ali rahlo alkalno okolje znotraj celic. Ogljikova kislina in njeni anioni tvorijo bikarbonatni puferski sistem, ki vzdržuje rahlo alkalno reakcijo zunajceličnega medija.
4. Koliko vode vsebujejo živi organizmi? od česa je odvisno? Zakaj rastline ovenejo, ko primanjkuje vode?
Vsebnost vode je odvisna od vrste organizma, njegove starosti, vrste celic (tkiv) in njihovega fiziološkega stanja. Na primer, pri ljudeh siva snov možganov vsebuje približno 85% vode, kostno tkivo pa 22%. Najvišjo vsebnost vode v telesu opazimo v embrionalnem obdobju (približno 95%) in s starostjo postopoma upada, kar vodi do zmanjšanja funkcionalne aktivnosti celic, tkiv in telesa kot celote.
Voda določa prostornino celice in znotrajcelični (turgorni) tlak, ki povzroča stresno stanje celične membrane. Ob pomanjkanju vode v celicah se turgorni tlak zmanjša, zato rastline ovenejo.
5. Dve raztopini glukoze sta ločeni z membrano, ki ne dopušča prehoda molekul glukoze, dovoljuje pa vodo. Koncentracija glukoze v prvi raztopini je 1%, v drugi - 0,1%. Kaj se zgodi z molekulami vode? Kako se imenuje ta pojav?
Molekule vode se premikajo skozi polprepustno membrano iz manj koncentrirane raztopine (z masnim deležem glukoze 0,1 %) v bolj koncentrirano raztopino (z masnim deležem glukoze 1 %). Ta pojav se imenuje osmoza. Osmoza izenači koncentracije glukoze v raztopinah, ločenih s polprepustno membrano.
6. Katere so glavne funkcije vode v živih organizmih? Kako so fizikalne in kemijske lastnosti vode povezane z njenimi biološkimi funkcijami?
Voda je del celic in medcelične snovi, je osnova krvi, limfe, tkivne tekočine, izločkov žlez. Določa prostornino celic in zagotavlja vzdrževanje turgorskega tlaka. Voda je univerzalno topilo za polarne spojine in glavni medij, v katerem potekajo presnovni procesi živih organizmov. Večina kemičnih reakcij v telesu poteka v vodnih raztopinah. Vstop in izstop snovi iz celic poteka praviloma v raztopljeni obliki. Voda kot topilo sodeluje pri pojavih osmoze, zaradi česar se izenačijo koncentracije raztopljenih snovi v celicah in zunajceličnem mediju.
Voda je neposreden udeleženec v številnih biokemičnih reakcijah, na primer v reakcijah hidrolitičnega cepljenja (hidrolize) organskih spojin. Je eden od izhodnih materialov v reakcijah fotosinteze. Kisik, ki se sprosti med fotosintezo, izvira iz razgradnje vodnih molekul.
Voda sodeluje pri uravnavanju toplotnega režima organizmov. Zagotavlja enakomerno porazdelitev toplote med tkivi in organi, preprečuje nenadne temperaturne spremembe v celicah in telesu kot celoti, tudi ko so temperaturna nihanja v okolju dovolj velika. Pri izhlapevanju vode s strani organizmov (transpiracija pri rastlinah, potenje pri sesalcih) se porabi veliko toplote, ki jih ščiti pred pregrevanjem.
Voda je zaradi polarnosti molekul in njihove sposobnosti tvorjenja medmolekularnih vodikovih vezi z drugimi spojinami univerzalno topilo in medij za presnovne procese. Majhna velikost molekul vode igra pomembno vlogo pri osmotskih pojavih. Sodelovanje vode pri uravnavanju toplotnega režima organizmov je povezano z njeno visoko toplotno kapaciteto, dobro toplotno prevodnostjo in visoko toploto izhlapevanja. To pa je posledica sposobnosti vodnih molekul, da med seboj tvorijo številne vodikove vezi.
7. Zakaj se po vašem mnenju večina polarnih snovi dobro raztopi v vodi, medtem ko so nepolarne snovi v njej praviloma netopne?
Molekule vode so polarne, kar jim omogoča intenzivno interakcijo z drugimi polarnimi snovmi. Voda prispeva k ločevanju strukturnih delcev polarnih spojin (ionov, molekul), njihovemu prehodu v raztopino, tvori hidratacijske lupine okoli ionov in polarnih molekul.
Molekule vode zelo šibko delujejo z nepolarnimi spojinami. Takšne snovi so praktično netopne v vodi, vendar so zlahka topne v nepolarnih topilih (na primer v bencinu). Tukaj je primerno spomniti se na starodavno pravilo alkimistov: "Podobno se raztopi v podobnem."
osem*. Puferske lastnosti zunajceličnega okolja zagotavljajo ogljikova kislina in bikarbonatni ion, v celicah pa to funkcijo opravljajo anioni fosforjeve kisline. Zakaj te spojine omogočajo vzdrževanje določene koncentracije vodikovih ionov v raztopinah, medtem ko dušikova in klorovodikova kislina ter njihovi anioni nimajo takšnih lastnosti?
Ogljikova kislina je šibek elektrolit. V vodnih raztopinah se le majhen del njegovih molekul disociira na ione, zato so v medceličnem mediju skupaj z bikarbonatnimi ioni (HCO 3 -) tudi nedisociirane molekule ogljikove kisline (H 2 CO 3). V celicah obstaja določeno ravnovesje (ravnotežje) med anioni fosforjeve kisline H 2 PO 4 - in HPO 4 2-:
H 2 CO 3 ↔ H + + HCO 3 -
H 2 RO 4 – ↔ H + + HRO 4 2–
Z zmanjšanjem kislosti medija se ravnotežje premakne v desno - sproščajo se dodatni vodikovi ioni (H +). S povečanjem kislosti se ravnotežje premakne v levo - pride do vezave "dodatnih" ionov H +. Zaradi tega se reakcija zunajceličnega okolja (ali znotrajcelične vsebine) praktično ne spremeni.
Dušikova in klorovodikova kislina sta močni elektroliti. Ko se raztopijo v vodi, se skoraj popolnoma disociirajo v ione:
HNO 3 → H + + NO 3 -
HCl → H + + Cl -
Disociacija močnih elektrolitov je praktično nepovratna, zato njihove raztopine nimajo puferskih lastnosti.
* Naloge, označene z zvezdico, od študentov zahtevajo, da postavijo različne hipoteze. Zato naj se učitelj pri postavljanju ocene osredotoči ne le na tukaj podan odgovor, ampak upošteva vsako hipotezo, oceni biološko mišljenje učencev, logiko njihovega sklepanja, izvirnost idej itd. je priporočljivo študente seznaniti z danim odgovorom.
Kot že vemo, je celica sestavljena iz kemične snovi organske in anorganske vrste. Glavne anorganske snovi, ki sestavljajo celico, so soli in voda.
Voda kot sestavina življenja
Voda je prevladujoča sestavina vseh organizmov. Pomembne biološke funkcije vode opravljajo edinstvene lastnosti njegovih molekul, zlasti prisotnost dipolov, ki omogočajo nastanek vodikovih vezi med celicami.
Zahvaljujoč molekulam vode v telesu živih bitij potekajo procesi toplotne stabilizacije in termoregulacije. Proces termoregulacije nastane zaradi visoke toplotne kapacitete molekul vode: zunanje temperaturne spremembe ne vplivajo na temperaturne spremembe v telesu.
Zahvaljujoč vodi, organom Človeško telo ohranijo svojo elastičnost. Voda je ena glavnih sestavin mazalnih tekočin, potrebnih za sklepe vretenčarjev ali perikardialno vrečko.
Vključen je v sluz, ki olajša gibanje snovi skozi črevesje. Voda je sestavni del žolča, solz in sline.
Soli in druge anorganske snovi
Celice živega organizma poleg vode vsebujejo tudi anorganske snovi, kot so kisline, baze in soli. Večina pomembnosti v življenju telesa imajo Mg2+, H2PO4, K, CA2, Na, C1-. Šibke kisline garancija stabilna notranje okolje celice (rahlo alkalne).
Koncentracija ionov v medcelični snovi in znotraj celice je lahko različna. Tako so na primer ioni Na + koncentrirani le v medcelični tekočini, medtem ko se K + nahaja izključno v celici.
Močno zmanjšanje ali povečanje števila določenih ionov v sestavi celice ne vodi le v njeno disfunkcijo, ampak tudi v smrt. Na primer, zmanjšanje količine Ca + v celici povzroči krče znotraj celice in njeno nadaljnjo smrt.
Nekatere anorganske snovi pogosto sodelujejo z maščobami, beljakovinami in ogljikovimi hidrati. Torej odličen primer so organske spojine s fosforjem in žveplom.
Žveplo, ki je del beljakovinskih molekul, je odgovorno za nastanek molekularnih vezi v telesu. Zahvaljujoč sintezi fosforja in organskih snovi se iz beljakovinskih molekul sprosti energija.
Kalcijeve soli
Kalcijeve soli prispevajo k normalnemu razvoju kostnega tkiva, pa tudi k delovanju možganov in hrbtenjače. Presnova kalcija v telesu se izvaja zaradi vitamina D. Presežek ali pomanjkanje kalcijevih soli vodi do motenj v delovanju telesa.
