Amoniak spada v skupino kemikalij. Proizvodnja amoniaka v industriji. Pridobivanje amoniaka v laboratoriju
amoniak -NH 3
Amoniak (v evropskih jezikih njegovo ime zveni kot "amoniak") svoje ime dolguje oazi Amon v Severna afrika ki se nahaja na križišču karavanskih poti. V vročem podnebju se sečnina (NH 2) 2 CO, ki jo vsebujejo živalski iztrebki, še posebej hitro razgradi. Eden od produktov razgradnje je amoniak. Po drugih virih je amoniak dobil ime po staroegipčanski besedi amonian. Tako imenovani ljudje, ki častijo boga Amona. Med obrednimi obredi so njuhali amoniak NH 4 Cl, ki pri segrevanju izhlapi amoniak.
1. Zgradba molekule
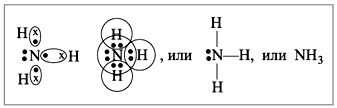
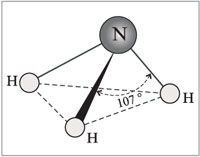
Molekula amoniaka ima obliko trikotne piramide z atomom dušika na vrhu. Trije neparni p-elektroni atoma dušika sodelujejo pri tvorbi polarnih kovalentnih vezi z 1s-elektroni treh vodikovih atomov (vezi N-H), četrti par zunanjih elektronov je nedeljen, lahko tvori donorno-akceptorsko vez z vodikom ion, ki tvori amonijev ion NH 4 + .
Pogled kemična vez: kovalentna polarna, tri enojneσ - vez N-H sigma
2. Fizikalne lastnosti amoniaka
pri normalne razmere- brezbarven plin z ostrim značilnim vonjem (vonj po amoniaku), skoraj dvakrat lažji od zraka, strupen.Po fiziološkem delovanju na telo spada v skupino snovi z zadušljivim in nevrotropnim učinkom, ki lahko ob vdihavanju povzročijo toksični pljučni edem in hude poškodbe. živčni sistem. Hlapi amoniaka močno dražijo sluznico oči in dihalnih organov ter kožo. To je tisto, kar zaznavamo kot oster vonj. Hlapi amoniaka povzročajo obilno solzenje, bolečine v očeh, kemične opekline veznice in roženice, izgubo vida, napade kašlja, pordelost in srbenje kože. Topnost NH 3 v vodi je izredno visoka – približno 1200 volumnov (pri 0 °C) oziroma 700 volumnov (pri 20 °C) v volumnu vode.
3.
|
V laboratoriju |
V industriji |
|
Za pridobivanje amoniaka v laboratoriju se uporablja delovanje močnih alkalij na amonijeve soli: NH 4 Cl + NaOH = NH 3 + NaCl + H 2 O (NH 4) 2 SO 4 + Ca(OH) 2 = 2NH 3 + CaSO 4 + 2H 2 O Pozor!Amonijev hidroksid je nestabilna baza, razpade: NH 4 OH ↔ NH 3 + H 2 O Pri sprejemanju amoniaka naj bo epruveta - sprejemnik obrnjena na glavo, saj je amoniak lažji od zraka: |
Industrijska metoda za proizvodnjo amoniaka temelji na neposredni interakciji vodika in dušika: N 2 (g) + 3H 2 (g) ↔ 2NH 3 (g) + 45,9k J Pogoji: katalizator - porozno železo temperatura - 450 - 500 ˚С tlak - 25 - 30 MPa To je tako imenovan Haberjev proces (nemški fizik, razvil fizikalno-kemijske temelje metode). |
4. Kemijske lastnosti amoniak
Za amoniak so značilne reakcije:
- s spremembo oksidacijskega stanja atoma dušika (oksidacijske reakcije)
- brez spreminjanja oksidacijskega stanja atoma dušika (adicija)
|
Reakcije s spremembo oksidacijskega stanja atoma dušika (oksidacijske reakcije) N-3 → N 0 → N +2 NH3-močno redukcijsko sredstvo. |
|
s kisikom 1. Zgorevanje amoniaka (pri segrevanju) 4 NH 3 + 3 O 2 → 2 N 2 + 6 H 2 0 2. Katalitska oksidacija amoniaka (katalizatorPt – Rh, temperatura) 4NH 3 + 5O 2 → 4NO + 6H 2 O Video - Poskus "Oksidacija amoniaka v prisotnosti kromovega oksida" |
|
s kovinskimi oksidi 2 NH 3 + 3CuO \u003d 3Cu + N 2 + 3 H 2 O |
|
z močnimi oksidanti 2 NH 3 + 3 Cl 2 \u003d N 2 + 6 HCl (pri segrevanju) |
|
amoniak je krhka spojina, pri segrevanju razpade 2NH 3 ↔ N 2 + 3H 2 |
|
Reakcije brez spreminjanja oksidacijskega stanja atoma dušika (dodatek - Tvorba amonijevega iona NH4+glede na donorsko-akceptorski mehanizem) Video - Eksperiment "Kvalitativna reakcija na amoniak" Video - Eksperiment "Dim brez ognja" Video - Eksperiment "Interakcija amoniaka s koncentriranimi kislinami" Video - Eksperiment "Fontana" Video - Poskus "Raztapljanje amoniaka v vodi" |
5. Uporaba amoniaka
Po obsegu proizvodnje je amoniak eno od prvih mest; letno po vsem svetu prejme približno 100 milijonov ton te spojine. Amoniak se proizvaja v tekoči obliki ali v obliki vodne raztopine - amoniakova voda, ki običajno vsebuje 25 % NH 3 . Nadalje se uporabljajo ogromne količine amoniaka za proizvodnjo dušikove kisline ki gre v proizvodnja gnojil in številni drugi izdelki. Amonijačna voda se uporablja tudi neposredno kot gnojilo, včasih pa se polja zalivajo iz rezervoarjev neposredno s tekočim amoniakom. Iz amoniaka prejemajo različne amonijeve soli, sečnino, urotropin. Njegovo uporablja se tudi kot poceni hladilno sredstvo v industrijskih hladilnih sistemih.
Uporablja se tudi amoniak za proizvodnjo sintetičnih vlaken, na primer najlon in kapron. AT lahka industrija on uporablja se pri čiščenju in barvanju bombaža, volne in svile. V olju kemična industrija amoniak se uporablja za nevtralizacijo kislih odpadkov, pri proizvodnji naravnega kavčuka pa amoniak pomaga ohranjati lateks med njegovim transportom od plantaže do tovarne. Amoniak se uporablja tudi pri proizvodnji sode po metodi Solvay. V jeklarski industriji se amoniak uporablja za nitriranje - nasičenje površinskih plasti jekla z dušikom, kar znatno poveča njegovo trdoto.
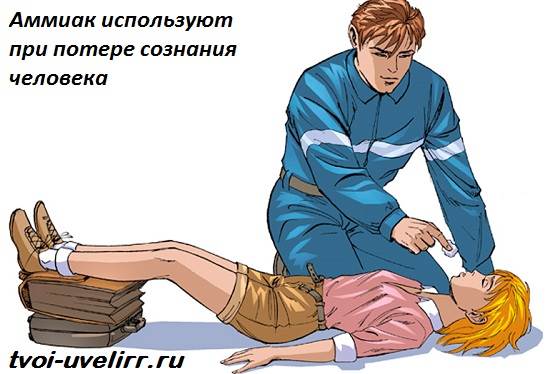
Zdravniki uporabljajo vodne raztopine amoniaka (amoniaka) v vsakdanji praksi: vatirana palčka, namočena v amoniak, človeka spravi iz omedlevice. Za človeka amoniak v takem odmerku ni nevaren.
SIMULATORJI
Simulator №1 "Izgorevanje amoniaka"
Simulator №2 "Kemične lastnosti amoniaka"
NALOGE ZA OKREPITEV
№1. Izvedite transformacije po shemi:
a) Dušik → Amoniak → Dušikov oksid (II)
b) Amonijev nitrat → Amoniak → Dušik
c) Amoniak → Amonijev klorid → Amoniak → Amonijev sulfat
Za OVR sestavite e-bilance, za RIO popolne ionske enačbe.št. 2. Napišite štiri enačbe kemične reakcije kar povzroči nastanek amoniaka.
Cvetni listi postanejo zeleni in - postanejo črni.
Cvetličarji, kot pravijo, upoštevajte. vendar amoniak uporaben na drugih področjih delovanja. Spoznamo ostale lastnosti snovi, se seznanimo z načini njene uporabe.
Lastnosti amoniaka
Pri delu s hlapi amoniaka morate biti previdni. Pri določeni koncentraciji je mešanica reagenta z zrakom eksplozivna.
Poleg tega je plin strupen. "Komunikacija" z njim je polna živčnih motenj, izgube sluha, delne izgube spomina, zamegljenosti leč. Ti simptomi so opaženi pri ljudeh, ki delajo v proizvodnji amoniaka.
Hlapi amoniaka vedno hitijo navzgor, ker je plin lažji od zraka. Snov je v normalnih pogojih plin. Amoniak se utekočini za prevoz in prodajo.
Za to potrebujete visok krvni pritisk. Pridobite brezvodni koncentrat. Zanj obstaja 6221-90 GOST.
Utekočinjeni amoniak v posodah pa ima kljub temu plinasto fazo. Pod tlakom sta obe agregatni stanji v ravnotežju.
V tem primeru mora biti temperatura pod kritično, prav tako tlak. Če je več kot 132 stopinj in 11 megapaskalov, bo ravnotežje porušeno.
Volumetrični kompresijski koeficient snovi je nekajkrat manjši od njenega razteznega koeficienta.
Če je posoda napolnjena do vrha, lahko zvišanje temperature povzroči tlak 52 megapaskalov.
To je dovolj, da zlomi kovinske šive posode. V skladu s tem bo prišlo do eksplozije.
Iz koncentrata amoniaka lahko dobite raztopina amoniaka kakršne koli intenzivnosti. Čeprav tudi brezvodna različica pride človeštvu prav.
Na primer, to je eno od gnojil. Poleg tega je v snovi prisoten le vodik. Zadnji 3 atomi, to je formula plina, je naslednja: - NH 3.
Ta vsebnost vodika je razlog za odlično topnost amoniaka v vodi. Drugi plini se s tem ne morejo pohvaliti.
Med amoniakom in vodo nastanejo močne vodikove vezi. Bolj ko je raztopina nasičena, večje so njene lastnosti raztapljanja.
Za njih snov tekmuje s etilni alkohol, s to razliko, da je slednji organskega izvora.
Torej, vodni amoniak, kot tudi koncentrat, lahko raztopijo kovine alkalijskih in zemeljskoalkalijskih skupin.
Posledica reakcije so temno modre tekočine. To je posledica ionizacije in solvatacije valenčnih elektronov.
Slednji koncept označuje elektrostatični stik med molekulami raztopljenih kovin in amoniaka.
Iz amoniaka vonj po amoniaku pride od nikoder. Sredstvo je vodna raztopina amonijevega hidroksida.
to je amoniak je amoniak alkohol. Amonijev hidroksid najdemo tudi v urinu, pa tudi v produktih organske razgradnje.
Zato na primer gnijoče gmote z dna močvirij neprijetno dišijo. Razkrajajo ostanke rastlin, rib,.
V istih ribnikih se amoniak naravno meša z vodo. V raztopini je prisotna OH skupina.
To pomeni, da je zmes sposobna alkalne reakcije, je šibka baza. Razpusti junaka in alkohol. amoniak ne po naključju zmešan z njim v amoniaku.
V koncentrirani obliki vodikov nitrid močno lomi svetlobo, torej spremeni smer žarkov.
Še ena radovedna lastnost junaka članka vre temperature pod ničlo. Moralo bi biti okoli 34 pod ničlo.
Če temperaturo znižate na 78 stopinj, se tekočina popolnoma strdi. Izkazalo se je, da so belkasti kosmiči, podobni snegu. snovi imajo pravilno, simetrično obliko.
Pridobivanje amoniaka
Proizvodnja amoniaka zmanjšana na 100.000.000 ton letno. Ekstrahira se približno enaka količina klora. Hkrati je amoniak manj strupen.
V navedenem volumen amoniaka vključuje snov, ekstrahirano iz naravnih virov dušika in sintetizirano pod pogoji.
Industrijska metoda temelji na kombinaciji vodika in dušik. amoniak od njih se pridobiva pri temperaturi, ki ni nižja od 500 stopinj Celzija.
Drugi pogoj: - tlak 350 atmosfer. Brez katalizatorja ne gre. Pospešuje počasno reakcijo, ne da bi sama vstopila vanjo.
Vlogo katalizatorja običajno opravlja goba. Od dražjih pomočnikov se izbere oksid oz.
Končni izkoristek produkta med interakcijo enostavnih snovi je približno 30-35%.
To je največ, ob upoštevanju najnižje možne temperature in najvišjega tlaka. Prav ta duet zagotavlja učinkovitost reakcije.
Pri nižji temperaturni vrstici pa se hitrost postopka zmanjša. Če vklopite toploto, boste delno ostali brez amoniak pa boš hitreje dobil.
Sintetična metoda za proizvodnjo amoniaka praktično ne pušča možnosti za njegovo ekstrakcijo v naravi iz razpadnih produktov organske snovi. Ta proces je dolg.
amoniak nastane, vendar hitro izhlapi. V pasti zemeljska skorja plin je redek.
Običajno amoniak postopoma izhlapeva, zaradi česar so naravna nahajališča nelikvidna.
Uporaba amoniaka
Aplikacija snovi v kmetijskem sektorju so že bile omenjene. Zdaj pa pojdimo k lepotni industriji in se spomnimo amoniak za lase.
Tukaj se spomnimo, da je raztopina snovi šibka alkalija. Zato imenovanje: - zagotoviti alkalne Ph barve, v območju 10.
Takšno okolje prispeva k nabrekanju las, kar sproži reakcijo razgradnje vodikovega peroksida.
Slednji je čistilec, zato se nujno uporablja v odtenkih blond.
obstaja barva brez amonijaka. Vendar so proizvajalci delno zviti. Namesto čista snov uporabljajo se njegove izpeljanke.
Prav tako dvignejo Ph na alkalno raven, vendar so dražji. V skladu s tem in barva za lase brez amonijaka zahteva stroške.

Vendar so potrošniki pripravljeni nanje, da bi rešili svoje lase. Dejstvo je, da čisti amoniak močneje odpre pore las.
Začnejo spominjati na gobo, katere površino je mogoče zgladiti le z drago silikonsko kozmetiko, ki zapolni praznine.
Iz hrane izražene alkalije -. Za njegovo izdelavo tudi usmerjena sinteza amoniaka.
Proizvaja se tudi za pridobivanje dušika kisline. amoniak pretvori v dušikov oksid.
Slednji se oksidira v dioksid. Nato okside absorbira voda. Tako dobijo.
Formula amoniaka, kot že omenjeno, je osnova za nastanek eksplozivnih snovi.
Snov je potrebna tudi pri proizvodnji hladilne opreme. Njegovo delovanje temelji na izhlapevanju utekočinjen plin. Hkrati se absorbira veliko toplote, ki pravzaprav zagotavlja hlad.
Pri nakitu je bil vpleten tudi amoniak. Uporablja se za čiščenje izdelkov po poliranju s pasto.
Potreba človeštva po amoniaku odraža trend njegove proizvodnje. Še pred 30 leti je nastajalo 70.000.000 ton reagenta na leto.
Zdaj, kot je omenjeno v poglavju »Proizvodnja«, jih je 100 000 000. Samo vodje proizvodnje se niso spremenili. To so še vedno ZDA in zdaj,.
V referenčnih knjigah preteklih let se seveda pojavlja ZSSR. Da se je cena snovi spremenila in ni treba ugibati. Spoznajmo trenutno ceno za amoniak.
Cena amoniaka
kupi amoniak lahko na debelo in na drobno. Velike dostave se praviloma izvajajo v tonah.
Za 1000 kilogramov zahtevajo od 19.000 rubljev. Mala podjetja so pripravljena prodati na kilogram in zahtevajo približno 30 rubljev.
V maloprodaji se na kilograme redkokdaj ponudi, na tone sploh ne. Preučimo cenik lekarn, pri čemer bomo pozorni na amoniak.
Običajno se toči v stekleničke po 40 mililitrov. Takšna količina stane od 15 do 31 rubljev.
Zanimivo je, da če obstajajo steklenice 25 in 100 mililitrov, stanejo približno enako, od 13 do 55 rubljev.
Hkrati je vredno upoštevati, da je alkoholna raztopina 10 odstotkov. Utekočinjeni amoniak pri veleprodajnih dobavah je koncentriran.
Zato morajo industrijalci razmišljati o pravilnem prevozu blaga. Obstajajo posebni polpriklopniki s cisternami.
Starost posod ne sme presegati 30 let. Pomembna je tudi sestava za rezervoarje, saj amoniak raztopi veliko kovin.
Upoštevati je treba tudi tlak v rezervoarju, temperaturo. Zato so poleg oglasov za prodajo reagenta praviloma tudi ponudbe za prodajo in najem polprikolic. Brez njih ne gre.
Tekočina
amoniak- NH 3, vodikov nitrid, v normalnih pogojih - brezbarven plin z ostrim značilnim vonjem (vonj po amoniaku), skoraj dvakrat lažji od zraka, strupen. Topnost NH 3 v vodi je izjemno visoka - približno 1200 volumnov (pri 0 ° C) ali 700 volumnov (pri 20 ° C) v volumnu vode. AT hlajenje se imenuje R717, kjer je R hladilno sredstvo (hladilno sredstvo), 7 je vrsta hladilnega sredstva (anorganska spojina), 17 je molekulska masa.
Molekula amoniaka ima obliko trikotne piramide z atomom dušika na vrhu. Trije neparni p-elektroni atoma dušika sodelujejo pri tvorbi polarnih kovalentnih vezi z 1s-elektroni treh vodikovih atomov (vezi N-H), četrti par zunanjih elektronov je nedeljen, lahko tvori donorno-akceptorsko vez z vodikom ion, ki tvori amonijev ion NH 4 + . Zaradi dejstva, da je nevezni dvoelektronski oblak strogo orientiran v prostoru, ima molekula amoniaka visoko polarnost, kar vodi do njene dobre topnosti v vodi.
V tekočem amoniaku so molekule povezane z vodikovimi vezmi. Primerjava fizikalnih lastnosti tekočega amoniaka z vodo pokaže, da ima amoniak nižja vrelišča (t bale -33,35 °C) in tališče (t pl -77,70 °C), pa tudi več nizka gostota, viskoznost (viskoznost tekočega amoniaka je 7-krat manjša od viskoznosti vode), prevodnost in dielektrična konstanta. To je do neke mere pojasnjeno z dejstvom, da je moč teh vezi v tekočem amoniaku bistveno nižja kot v vodi, in tudi z dejstvom, da je v molekuli amoniaka samo en par nedeljenih elektronov, v nasprotju z dvema paroma v molekuli vode, kar ne omogoča tvorbe obsežne mreže vodikovih vezi med več molekulami. Amoniak zlahka prehaja v brezbarvno tekočino z gostoto 681,4 kg / m³, ki močno lomi svetlobo. Tako kot voda je tekoči amoniak močno povezan, predvsem s tvorbo vodikovih vezi. Tekoči amoniak praktično ne prevaja elektrika. Tekoči amoniak je dobro topilo za zelo veliko število organske, pa tudi za mnoge anorganske spojine. Trden amoniak so brezbarvni kubični kristali.
Kemijske lastnosti
- Zaradi prisotnosti osamljenega elektronskega para deluje amoniak kot nukleofil ali kompleksirno sredstvo v številnih reakcijah. Torej veže proton in tvori amonijev ion:
- Vodna raztopina amoniaka ("amoniak") ima rahlo alkalno reakcijo zaradi postopka:
- Medsebojno delovanje s kislinami daje ustrezne amonijeve soli:
- Tudi amoniak je zelo šibka kislina(10.000.000.000-krat šibkejši od vode), sposoben tvoriti soli s kovinami - amide. Spojine, ki vsebujejo ione NH 2 −, imenujemo amidi, NH 2− - imidi in N 3− - nitridi. Amide alkalijskih kovin dobimo z delovanjem nanje z amoniakom:
Amidi, imidi in nitridi številnih kovin nastanejo kot posledica določenih reakcij v tekočem amoniaku. Nitride lahko dobimo s segrevanjem kovin v atmosferi dušika.
Kovinski amidi so analogi hidroksidov. To analogijo potrjuje dejstvo, da so ioni OH - in NH 2 - ter molekule H 2 O in NH 3 izoelektronske. Amidi so močnejše baze kot hidroksidi, zato so v vodnih raztopinah podvrženi ireverzibilni hidrolizi:
NaNH 2 + H 2 O → NaOH + NH 3 CaNH + 2H 2 O → Ca(OH) 2 + NH 3 Zn 3 N 2 + 6H 2 O → 3Zn(OH) 2 + 2NH 3
in v alkoholih:
KNH 2 + C 2 H 5 OH → C 2 H 5 OK + NH 3
Tako kot vodne raztopine alkalij tudi amoniakove raztopine amidov dobro prevajajo električni tok, kar je posledica disociacije:
MNH 2 → M + + NH 2 -
Fenolftalein v teh raztopinah se obarva rdeče, z dodatkom kislin pa se nevtralizirajo. Topnost amidov se spreminja v enakem zaporedju kot topnost hidroksidov: LiNH 2 je netopen, NaNH 2 slabo topen, KNH 2, RbNH 2 in CsNH 2 so dobro topni.
- Pri segrevanju ima amoniak redukcijske lastnosti. Torej gori v atmosferi kisika in tvori vodo in dušik. Oksidacija amoniaka z zrakom na platinskem katalizatorju daje dušikove okside, ki se uporabljajo v industriji za proizvodnjo dušikove kisline:
Uporaba amoniaka NH 4 Cl za čiščenje kovinske površine pred oksidi med spajkanjem temelji na redukcijski sposobnosti NH 3:
3CuO + 2NH 4 Cl → 3Cu + 3H 2 O + 2HCl + N 2
Z oksidacijo amoniaka z natrijevim hipokloritom v prisotnosti želatine dobimo hidrazin:
2NH 3 + NaClO → N 2 H 4 + NaCl + H 2 O
- Halogeni (klor, jod) tvorijo z amoniakom nevarne eksplozive - dušikove halogenide (dušikov klorid, dušikov jodid).
- S haloalkani amoniak vstopi v nukleofilno adicijsko reakcijo in tvori substituiran amonijev ion (metoda za pridobivanje aminov):
- S karboksilnimi kislinami, njihovimi anhidridi, halogenidi, estri in drugimi derivati daje amide. Z aldehidi in ketoni - Schiffove baze, ki jih lahko reduciramo v ustrezne amine (reduktivna aminacija).
- Pri 1000 °C amoniak reagira s premogom, pri čemer nastane HCN in delno razpade na dušik in vodik. Reagira lahko tudi z metanom in tvori isto cianovodikovo kislino:
Zgodovina imen
Amoniak (v evropskih jezikih njegovo ime zveni kot "amoniak") svoje ime dolguje oazi Ammon v severni Afriki, ki se nahaja na križišču karavanskih poti. V vročem podnebju se sečnina (NH 2) 2 CO, ki jo vsebujejo živalski iztrebki, še posebej hitro razgradi. Eden od produktov razgradnje je amoniak. Po drugih virih je amoniak dobil ime po staroegipčanski besedi amonian. Tako imenovani ljudje, ki častijo boga Amona. Med obrednimi obredi so njuhali amoniak NH 4 Cl, ki pri segrevanju izhlapi amoniak.
Tekoči amoniak
Tekoči amoniak, čeprav v majhni meri, disociira na ione, v katerih se kaže njegova podobnost z vodo:
2NH 3 → NH 4 + + NH 2 -
Konstanta samoionizacije tekočega amoniaka pri –50 °C je približno 10 –33 (mol/l)².
Tekoči amoniak je tako kot voda močno ionizirajoče topilo, v katerem se raztopijo številne aktivne kovine: alkalijske, zemeljskoalkalijske, Mg, Al, pa tudi Eu in Yb. Topnost alkalijskih kovin v tekočem NH 3 je več deset odstotkov. Tekoči amoniak NH 3 raztaplja tudi nekatere intermetalne spojine, ki vsebujejo alkalijske kovine, kot je Na 4 Pb 9 .
Razredčene raztopine kovin v tekočem amoniaku so obarvane Modra barva, imajo koncentrirane raztopine kovinski lesk in so podobne bronu. Ko amoniak izhlapi, se sproščajo alkalijske kovine čista oblika, in alkalijske zemlje - v obliki kompleksov z amoniakom [E (NH 3) 6] s kovinsko prevodnostjo. Pri rahlem segrevanju ti kompleksi razpadejo na kovino in NH 3 .
Kovina, raztopljena v NH 3, postopoma reagira v amid:
2Na + 2NH 3 → 2NaNH 2 + H 2 -
Kovinski amidi, ki nastanejo pri reakciji z amoniakom, vsebujejo negativni ion NH 2 - , ki nastaja tudi pri samoionizaciji amoniaka. Tako so kovinski amidi analogi hidroksidov. Hitrost reakcije se poveča pri prehodu od Li do Cs. Reakcija se močno pospeši že v prisotnosti majhnih primesi H2O.
Raztopine kovina-amoniak imajo kovinsko električno prevodnost, v njih atomi kovin razpadejo na pozitivne ione in solvatirane elektrone, obdane z molekulami NH3. Raztopine kovine in amoniaka, ki vsebujejo proste elektrone, so najmočnejši reducenti.
kompleksiranje
Zaradi svojih elektrodonatorskih lastnosti lahko molekule NH 3 vstopijo v kompleksne spojine kot ligand. Tako vnos presežka amoniaka v raztopine soli d-kovin povzroči nastanek njihovih amino kompleksov:
CuSO 4 + 4NH 3 → SO 4 Ni(NO 3) 2 + 6NH 3 → (NO 3) 2
Kompleksiranje običajno spremlja sprememba barve raztopine, tako da se pri prvi reakciji modra barva (CuSO 4) spremeni v temno modro (barva kompleksa), pri drugi reakciji pa se barva spremeni iz zelene ( Ni (NO 3) 2) do modro-vijolične. Najmočnejši kompleksi z NH 3 tvorijo krom in kobalt v oksidacijskem stanju +3.
Biološka vloga
Amoniak je končni produkt presnove dušika pri ljudeh in živalih. Nastaja med presnovo beljakovin, aminokislin in drugih dušikovih spojin. Je zelo toksičen za telo, zato večino amoniaka med ornitinskim ciklom jetra pretvorijo v bolj neškodljivo in manj strupeno spojino – sečnino (sečnino). Sečnino nato izločijo ledvice, nekaj sečnine pa lahko jetra ali ledvice pretvorijo nazaj v amoniak.
Amoniak lahko jetra uporabijo tudi za obratni proces, ponovno sintezo aminokislin iz amoniaka in keto analogov aminokislin. Ta proces se imenuje "reduktivna aminacija". Torej iz kislice ocetna kislina izkaže se asparagin, iz α-ketoglutarnega - glutamin itd.
Fiziološko delovanje
Po fiziološkem delovanju na telo spada v skupino snovi z zadušljivim in nevrotropnim učinkom, ki lahko ob vdihavanju povzročijo toksični pljučni edem in hude okvare živčnega sistema. Amoniak ima lokalne in resorptivne učinke.
Hlapi amoniaka močno dražijo sluznico oči in dihalnih organov ter kožo. To je tisto, kar zaznavamo kot oster vonj. Hlapi amoniaka povzročajo obilno solzenje, bolečine v očeh, kemične opekline veznice in roženice, izgubo vida, napade kašlja, pordelost in srbenje kože. Ko utekočinjeni amoniak in njegove raztopine pridejo v stik s kožo, se pojavi pekoč občutek, možna je kemična opeklina z mehurji in razjedami. Poleg tega utekočinjeni amoniak med izhlapevanjem absorbira toploto in ob stiku s kožo nastanejo ozebline različnih stopenj. Vonj po amoniaku se čuti pri koncentraciji 37 mg/m³.
Konec koncev dovoljena koncentracija v zraku delovno območje proizvodni prostori je 20 mg/m³. Če torej čutite vonj po amoniaku, je že nevarno delati brez zaščitne opreme. Draženje žrela se kaže, ko je vsebnost amoniaka v zraku 280 mg / m³, oči - 490 mg / m³. Pri izpostavljenosti zelo visokim koncentracijam amoniak povzroči kožne lezije: 7-14 g/m³ - eritematozni, 21 g/m³ ali več - bulozni dermatitis. Toksični pljučni edem se razvije pri enourni izpostavljenosti amoniaku s koncentracijo 1,5 g / m³. Kratkotrajna izpostavljenost amoniaku v koncentraciji 3,5 g/m³ ali več hitro povzroči razvoj splošnih toksičnih učinkov. Največja dovoljena koncentracija amonijaka v atmosferski zrak naselja je enako: povprečno dnevno 0,04 mg/m³; največji enkratni odmerek 0,2 mg/m³.
V svetu je največja koncentracija amoniaka v ozračju (več kot 1 mg / m³) opažena v Indo-Gangski nižini, v osrednji dolini ZDA in v regiji Južni Kazahstan.
Aplikacija
Amoniak je eden najpomembnejših izdelkov kemične industrije, njegova letna svetovna proizvodnja doseže 150 milijonov ton. Uporablja se predvsem za proizvodnjo dušikovih gnojil (amonijev nitrat in sulfat, sečnina), eksplozivov in polimerov, dušikove kisline, sode (metoda amoniaka) in drugih kemičnih izdelkov. Kot topilo se uporablja tekoči amoniak.
V hlajenju se uporablja kot hladilno sredstvo (R717)
V medicini se 10% raztopina amoniaka, pogosto imenovana amoniak, uporablja za omedlevico (za spodbujanje dihanja), za spodbujanje bruhanja, pa tudi zunaj - nevralgija, miozitis, piki žuželk, zdravljenje kirurških rok. pri napačna uporaba lahko povzroči opekline požiralnika in želodca (v primeru jemanja nerazredčene raztopine), refleksni zastoj dihanja (pri vdihavanju v visokih koncentracijah).
Nanesite lokalno, vdihavanje in znotraj. Da bi vzbudili dihanje in preprečili omedlevico, previdno prinesite majhen kos gaze ali vate, navlaženega z amoniakom, k bolnikovemu nosu (za 0,5-1 s). Znotraj (samo v vzreji) za izzivanje bruhanja. Z ugrizi žuželk - v obliki losjonov; z nevralgijo in miozitisom - drgnjenje z amoniakom. V kirurški praksi se gojijo v topli vreli vodi in si umijejo roke.
Ker je šibka baza, med interakcijo nevtralizira kisline.
Fiziološki učinek amoniaka je posledica ostrega vonja amoniaka, ki draži specifične receptorje nosne sluznice in vzbuja dihalne in vazomotorne centre možganov, kar povzroča pospešeno dihanje in zvišanje krvnega tlaka.
potrdilo o prejemu
Industrijska metoda za proizvodnjo amoniaka temelji na neposredni interakciji vodika in dušika:
N 2 (g) + 3H 2 (g) ↔ 2NH 3 (g) + 45,9 kJ
To je tako imenovan Haberjev proces (nemški fizik, razvil fizikalno-kemijske temelje metode).
Reakcija poteka s sproščanjem toplote in zmanjšanjem prostornine. Zato je treba na podlagi Le Chatelierjevega načela reakcijo izvesti pri nizke temperature in pri visokih tlakih - takrat se bo ravnotežje premaknilo v desno. Vendar je hitrost reakcije pri nizkih temperaturah zanemarljiva, pri visokih temperaturah pa se hitrost povratne reakcije poveča. Izvajanje reakcije pri zelo visokih tlakih zahteva ustvarjanje posebnega vzdržljivega visok pritisk opremo, kar pomeni veliko investicijo. Poleg tega se ravnotežje reakcije tudi pri 700 °C vzpostavi prepočasi za njeno praktično uporabo.
Uporaba katalizatorja (porozno železo s primesmi Al 2 O 3 in K 2 O) je omogočila pospešitev doseganja ravnotežnega stanja. Zanimivo je, da so pri iskanju katalizatorja za to vlogo preizkusili več kot 20 tisoč različnih substanc.
Ob upoštevanju vseh zgoraj navedenih dejavnikov se postopek pridobivanja amoniaka izvaja pri naslednje pogoje: temperatura 500 °C, tlak 350 atmosfer, katalizator. Dobitek amoniaka v takih pogojih je približno 30%. AT industrijsko okolje uporablja se princip kroženja - amoniak se odstrani s hlajenjem, neizreagirana dušik in vodik pa se vrneta v sintezno kolono. To se izkaže za bolj ekonomično kot doseganje večjega izkoristka reakcije s povečanjem tlaka.
Za pridobivanje amoniaka v laboratoriju se uporablja delovanje močnih alkalij na amonijeve soli:
NH 4 Cl + NaOH = NH 3 + NaCl + H 2 O.
Običajno se pridobiva v laboratoriju, pridobiva se s šibkim segrevanjem mešanice amonijevega klorida z gašeno apno. 2NH 4 Cl + Ca(OH) 2 = CaCl 2 + 2NH 3 + 2H 2 O
Za sušenje amoniaka ga spustimo skozi mešanico apna in kavstične sode.
Zelo suh amoniak lahko dobite tako, da v njem raztopite kovinski natrij in ga nato destilirate. To je najbolje narediti v sistemu iz kovine pod vakuumom. Sistem mora biti sposoben prenesti visok pritisk sobna temperatura pritisk nasičenih hlapov amoniak približno 10 atmosfer). V industriji se amoniak suši v absorpcijskih kolonah.
Amoniak v medicini
Pri pikih žuželk se amoniak uporablja zunaj v obliki losjonov. Možno stranski učinki: Pri dolgotrajni izpostavljenosti (uporaba pri vdihavanju) lahko amoniak povzroči refleksni zastoj dihanja. Lokalna uporaba je kontraindicirana pri dermatitisu, ekcemu in drugih kožne bolezni, kot tudi z odprtimi travmatskimi poškodbami kože. Pri inhalacijski uporabi - refleksni zastoj dihanja, pri lokalni uporabi - draženje, dermatitis, ekcem na mestu aplikacije. Lokalna uporaba je možna samo na nepoškodovani koži. V primeru nenamerne poškodbe očesne sluznice izpirajte z vodo (15 minut vsakih 10 minut) ali s 5% raztopino. Borova kislina. Olja in mazila se ne uporabljajo. Pri poškodbah nosu in žrela - 0,5% raztopina citronska kislina ali naravnih sokov. V primeru zaužitja pijte vodo, sadni sok, mleko, najbolje 0,5 % raztopino citronske kisline ali 1 % raztopino ocetne kisline, dokler vsebina želodca ni popolnoma nevtralizirana. Interakcija z drugimi zdravila neznano. (Navodilo za uporabo)
V vodi
- Halogeni (klor, jod) tvorijo z amoniakom nevarne eksplozive - dušikove halogenide (dušikov klorid, dušikov jodid).
- S haloalkani amoniak vstopi v nukleofilno adicijsko reakcijo in tvori substituiran amonijev ion (metoda za pridobivanje aminov):
- S karboksilnimi kislinami, njihovimi anhidridi, kislinskimi halidi, estri in drugimi derivati tvori amide. Z aldehidi in ketoni - Schiffove baze, ki jih lahko reduciramo v ustrezne amine (reduktivna aminacija).
- Pri 1000 °C amoniak reagira s premogom, pri čemer nastane cianovodikova kislina HCN in delno razpade na dušik in vodik. Reagira lahko tudi z metanom in tvori isto cianovodikovo kislino:
Zgodovina imen
Amoniak (v evropskih jezikih njegovo ime zveni kot "amoniak") svoje ime dolguje oazi Ammon v severni Afriki, ki se nahaja na križišču karavanskih poti. V vročem podnebju se sečnina (NH 2) 2 CO, ki jo vsebujejo živalski iztrebki, še posebej hitro razgradi. Eden od produktov razgradnje je amoniak. Po drugih virih je amoniak dobil ime po staroegipčanski besedi amonian. Tako imenovani ljudje, ki častijo boga Amona. Med obrednimi obredi so njuhali amoniak NH 4 Cl, ki pri segrevanju izhlapi amoniak.
Tekoči amoniak
Tekoči amoniak, čeprav v majhni meri, disociira na ione (avtoprotoliza), v čemer se kaže njegova podobnost z vodo:
Konstanta samoionizacije tekočega amoniaka pri –50 °C je približno 10 –33 (mol/l)².
Kovinski amidi, ki nastanejo pri reakciji z amoniakom, vsebujejo negativni ion NH 2 −, ki prav tako nastane pri samoionizaciji amoniaka. Tako so kovinski amidi analogi hidroksidov. Hitrost reakcije se poveča pri prehodu od Li do Cs. Reakcija se močno pospeši že v prisotnosti majhnih primesi H2O.
Raztopine kovina-amoniak imajo kovinsko električno prevodnost, v njih atomi kovin razpadejo na pozitivne ione in solvatirane elektrone, obdane z molekulami NH3. Raztopine kovine in amoniaka, ki vsebujejo proste elektrone, so najmočnejši reducenti.
kompleksiranje
Zaradi svojih elektrodonatorskih lastnosti lahko molekule NH 3 vstopijo v kompleksne spojine kot ligand. Tako vnos presežka amoniaka v raztopine soli d-kovin povzroči nastanek njihovih amino kompleksov:
Kompleksiranje običajno spremlja sprememba barve raztopine. Tako se pri prvi reakciji modra barva (CuSO 4) spremeni v temno modro (barva kompleksa), pri drugi reakciji pa se barva spremeni iz zelene (Ni (NO 3) 2) v modro-vijolično. Najmočnejši kompleksi z NH 3 tvorijo krom in kobalt v oksidacijskem stanju +3.
Biološka vloga
Amoniak je končni produkt presnove dušika pri ljudeh in živalih. Nastaja med presnovo beljakovin, aminokislin in drugih dušikovih spojin. Je zelo toksičen za telo, zato večino amoniaka med ornitinskim ciklom jetra pretvorijo v bolj neškodljivo in manj strupeno spojino – sečnino (sečnino). Sečnino nato izločijo ledvice, nekaj sečnine pa lahko jetra ali ledvice pretvorijo nazaj v amoniak.
Amoniak lahko jetra uporabijo tudi za obratni proces – resintezo aminokislin iz amoniaka in keto analogov aminokislin. Ta proces se imenuje "reduktivna aminacija". Tako se asparaginska kislina pridobiva iz oksaloocetne kisline, glutaminska kislina se pridobiva iz α-ketoglutarne kisline itd.
Fiziološko delovanje
Po fiziološkem delovanju na telo spada v skupino snovi z zadušljivim in nevrotropnim učinkom, ki lahko ob vdihavanju povzročijo toksični pljučni edem in hude okvare živčnega sistema. Amoniak ima lokalne in resorptivne učinke.
Hlapi amoniaka močno dražijo sluznico oči in dihalnih organov ter kožo. To je oseba in zaznava kot oster vonj. Hlapi amoniaka povzročajo obilno solzenje, bolečine v očeh, kemične opekline veznice in roženice, izgubo vida, napade kašlja, pordelost in srbenje kože. Ko utekočinjeni amoniak in njegove raztopine pridejo v stik s kožo, se pojavi pekoč občutek, možna je kemična opeklina z mehurji in razjedami. Poleg tega utekočinjeni amoniak med izhlapevanjem absorbira toploto in ob stiku s kožo nastanejo ozebline različnih stopenj. Vonj po amoniaku se čuti pri koncentraciji 37 mg/m³.
Aplikacija
Amoniak je eden najpomembnejših izdelkov kemične industrije, njegova letna svetovna proizvodnja doseže 150 milijonov ton. Uporablja se predvsem za proizvodnjo dušikovih gnojil (amonijev nitrat in sulfat, sečnina), eksplozivov in polimerov, dušikove kisline, sode (metoda amoniaka) in drugih kemičnih izdelkov. Kot topilo se uporablja tekoči amoniak.
Stopnje porabe na tono amoniaka
Za proizvodnjo ene tone amoniaka v Rusiji se v povprečju porabi 1200 nm³ zemeljski plin, v Evropi - 900 nm³.
Beloruski "Grodno Azot" porabi 1200 Nm³ zemeljskega plina na tono amoniaka, po posodobitvi naj bi se poraba zmanjšala na 876 Nm³.
Ukrajinski proizvajalci porabijo od 750 Nm³ do 1170 Nm³ zemeljskega plina na tono amoniaka.
Tehnologija UHDE navaja porabo 6,7 - 7,4 Gcal energetskih virov na tono amoniaka.
Amoniak v medicini
Pri pikih žuželk se amoniak uporablja zunaj v obliki losjonov. 10% vodna raztopina amoniaka je znana kot amoniak.
Možni so neželeni učinki: pri dolgotrajni izpostavljenosti (uporaba pri vdihavanju) lahko amoniak povzroči refleksni zastoj dihanja.
Lokalna uporaba je kontraindicirana pri dermatitisu, ekcemu, drugih kožnih boleznih, pa tudi pri odprtih travmatičnih poškodbah kože.
V primeru nenamerne poškodbe očesne sluznice sperite z vodo (15 minut vsakih 10 minut) ali 5% raztopino borove kisline. Olja in mazila se ne uporabljajo. S porazom nosu in žrela - 0,5% raztopina citronske kisline ali naravnih sokov. V primeru zaužitja pijte vodo, sadni sok, mleko, najbolje 0,5 % raztopino citronske kisline ali 1 % raztopino ocetne kisline, dokler vsebina želodca ni popolnoma nevtralizirana.
Medsebojno delovanje z drugimi zdravili ni znano.
Proizvajalci amoniaka
Proizvajalci amoniaka v Rusiji
| Podjetje | 2006, tisoč ton | 2007, tisoč ton |
|---|---|---|
| JSC "Togliattiazot"]] | 2 635 | 2 403,3 |
| OAO NAK Azot | 1 526 | 1 514,8 |
| JSC "Akron" | 1 526 | 1 114,2 |
| OAO Nevinnomyssky Azot, Nevinnomyssk | 1 065 | 1 087,2 |
| Minudobreniya JSC (Rossosh) | 959 | 986,2 |
| JSC "AZOT" | 854 | 957,3 |
| OJSC "Azot" | 869 | 920,1 |
| OJSC "Kirovo-Chepetsky Khim. združiti" | 956 | 881,1 |
| OJSC Cherepovets Azot | 936,1 | 790,6 |
| ZAO Kuibyshevazot | 506 | 570,4 |
| Gazprom Salavat Neftekhim" | 492 | 512,8 |
| "Mineralna gnojila" (Perm) | 437 | 474,6 |
| OJSC Dorogobuzh | 444 | 473,9 |
| OAO Voskresensk mineralna gnojila | 175 | 205,3 |
| OJSC Shchekinoazot | 58 | 61,1 |
| OOO MendeleevskAzot | - | - |
| Skupaj | 13 321,1 | 12 952,9 |
Rusija predstavlja približno 9% svetovne proizvodnje amoniaka. Rusija je ena največjih svetovnih izvoznic amoniaka. Približno 25 % celotne proizvodnje amoniaka se izvozi, kar je približno 16 % svetovnega izvoza.
Proizvajalci amoniaka v Ukrajini
- Jupitrovi oblaki so sestavljeni iz amoniaka.
Poglej tudi
Opombe
Povezave
- //
- // Enciklopedični slovar Brockhausa in Efrona: v 86 zvezkih (82 zvezkov in 4 dodatni). - St. Petersburg. , 1890-1907.
- // Enciklopedični slovar Brockhausa in Efrona: v 86 zvezkih (82 zvezkov in 4 dodatni). - St. Petersburg. , 1890-1907.
amoniak. Molekule tega plina imajo obliko piramide, na enem od vrhov katere je atom dušika. Tvorijo jih vodikove vezi in zanje je značilna močna polarnost. To pojasnjuje nenavadne fizikalne lastnosti amoniaka: njegovo tališče je približno -80 stopinj. Je dobro topen v vodi, alkoholih in drugih organska topila.
Uporaba amoniaka
Igra amoniak pomembno vlogo v industriji. Z njeno pomočjo dobite dušikova gnojila uporabljeno v kmetijstvo, dušikova kislina in celo eksplozivi. Amoniak, ki ga pogosto uporabljajo zdravniki, se proizvaja tudi z amoniakom. Oster vonj tega plina draži nosno sluznico in spodbuja dihalne funkcije. amoniak uporablja za omedlevico ali zastrupitev z alkoholom. Obstaja tudi zunanja uporaba amoniaka v medicini. Je odličen antiseptik, s katerim si kirurgi zdravijo roke pred operacijo.
Amoniak, kot produkt razgradnje amoniaka, se uporablja pri spajkanju kovin. pri visoka temperatura amoniak se pridobiva iz amoniaka, ki ščiti kovino pred nastankom oksidnega filma.
Zastrupitev z amoniakom
Amoniak je strupena snov. Pogosto pri delu pride do zastrupitve s tem plinom, ki jo spremljajo zadušitev, delirij in močno razburjenje. Kako lahko pomagate nekomu, ki je v tej situaciji? Najprej morate oči sprati z vodo in nadeti povoj iz gaze, ki ste ga predhodno navlažili s šibko raztopino citronske kisline. Nato ga je treba odstraniti iz območja, kjer je opaziti visoko koncentracijo amoniaka. Zastrupitev je možna že pri koncentraciji okoli 350 mg/m³.
Če amoniak pride v stik s kožo, prizadeta mesta takoj sperite z vodo. Odvisno od količine amoniaka na koži je lahko huda rdečica ali kemične opekline z mehurji.
V obratih, kjer proizvajajo amoniak, so uvedli stroge ukrepe požarna varnost. Dejstvo je, da je mešanica amoniaka in zraka zelo vnetljiva. Posode, v katerih je shranjen, lahko ob segrevanju zlahka eksplodirajo.
Kemične lastnosti amoniaka
Amoniak reagira s številnimi kislinami. Kot rezultat te interakcije dobimo različne amonijeve soli. Pri reakciji s polibazičnimi kislinami dobimo dve vrsti soli (odvisno od števila molov amoniaka).
