Največje dovoljene koncentracije škodljivih snovi v vodnih telesih. MPC v vodnem okolju
Veljavnost in neveljavnost uporabe različnih seznamov MPC za odpadne vode proizvodnja galvanizacije
AT Zadnja leta v Rusiji je nekaj rasti industrijska proizvodnja, ki po eni strani vodi v oživitev galvanske proizvodnje, po drugi strani pa ga omejuje visoka okoljska nevarnost. Čistilne naprave podjetij bi morale služiti zmanjšanju nevarnosti galvanske proizvodnje za okolje. Vendar pa poleg objektivnih razlogov (zastarele tehnologije čiščenja, slabo stanje opreme ipd.) obstajajo subjektivni razlogi za neučinkovitost ukrepov varstva okolja, med katerimi sta glavni nerazumna uporaba različnih seznamov MPC in nerazumna regionalna vladavina. -izdelava.
Glede na razliko v namenih porabe vode in v zahtevah različnih porabnikov vode po kakovosti vodnih teles obstajajo tako higienski kot okoljski standardi za ista kemična onesnaževala vode.
Higienske MPC so največje koncentracije snovi, pri katerih še nimajo neposrednega ali posrednega vpliva na zdravje prebivalstva (če so izpostavljene človeškemu telesu skozi vse življenje), higienske razmere za rabo vode pa se ne poslabšajo. Higienski standardi urejajo vsebnost onesnaževal le v tistih vodnih telesih, ki se uporabljajo za gospodinjske in pitne ter kulturne in gospodinjske namene, vključno z rekreacijsko rabo vode, in ne po celotnem rezervoarju ali na mestih odvajanja odpadnih voda, temveč le na mestih porabe vode. prebivalstvo, ki je najbližje iztočnim odtokom. Obstajata dve kategoriji gospodinjstva in pitja in kulturna in skupnostna raba vode: prva kategorija vključuje uporabo vodnega telesa kot vira za oskrbo s pitno vodo, pa tudi za oskrbo z vodo podjetij pitne industrije; v drugo kategorijo - uporaba vodna telesa za kulturne in vsakdanje namene prebivalstva, rekreacijo in šport.
Pojav novih virov onesnaževanja in širitev njihove geografije sta privedla do razvoja neodvisen sistem ribiški (okoljski) MPC, namenjeni varovanju vodnih teles kot osnove za organizirano ribogojstvo in ribolov. Obstajata dve kategoriji rabe ribiške vode: prva kategorija vključuje uporabo vodnega telesa za ohranjanje in razmnoževanje dragocenih ribjih vrst, ki so zelo občutljive na kisik; do drugega - uporaba vodnega telesa za komercialno proizvodnjo rib ter drugih vodnih živali in rastlin.
Če se rezervoar uporablja za ribiške namene in oskrbo prebivalstva z vodo, jih vodijo najstrožji standardi.
Pri dodelitvi vodnega telesa v določeno kategorijo se organi Državnega komiteja za ribištvo vodijo po Odloku Sveta ministrov ZSSR št. 1045 z dne 15. septembra 1958, v skladu s katerim: "Vsi rezervoarji in njihova dodatna oprema vode, ki se uporabljajo ali se lahko uporabljajo za komercialno pridelavo rib in drugih vodnih živali in rastlin ali so pomembne za razmnoževanje komercialnih ribjih staležev, se štejejo za ribiške rezervoarje. Tako so v skladu s tako neupravičeno široko definicijo vsa površinska vodna telesa tako velike države, kot je Rusija, razvrščena kot ribiška vodna telesa, torej naj bi v vseh površinska voda izdelki Rusije so ohranjeni in reproducirani dragocene vrste ribe z visoko občutljivostjo na kisik ali pa se uporabljajo za komercialno pridelavo rib in drugih vodnih živali in rastlin. Izkazalo se je, da je treba površinsko vodo v vseh primerih nadzorovati v skladu z MAC za ribiška vodna telesa (MAC RH).
Poleg tega, ker se skoraj vsi odtoki odpadne vode nahajajo v mejah naselja, v skladu s pravili in normativi za varstvo površinskih voda veljajo standardi za največjo onesnaženost vodnih teles za same odvajane vode, tj. redčenje odplak v vodi rezervoarja in asimilacijska sposobnost rezervoarjev se ne upoštevata. Tako je kakovost odpadne vode, ki se odvaja v vodna telesa, povsod predmet zahtev seznama MPC RH.
Poleg tega takšne zahteve veljajo ne le za mestne odplake, ki se odvajajo v vodna telesa, temveč tudi za odplake, ki vstopajo v mestno kanalizacijo iz podjetij. Tako ni samo redčenje industrijske odpadne vode z urbano gospodinjski odpadki, temveč prelaga tudi neučinkovitost delovanja mestnih čistilnih naprav na ramena podjetij. To nerazumno in po nepotrebnem zaostruje zahteve po kakovosti odpadne vode iz podjetij in jih zapelje v slepo ulico zaradi očitno nemogočega doseganja takšnih MPC z uporabo standardnih tehnologij čiščenja odpadne vode za galvansko proizvodnjo.
Utemeljimo to trditev.
Praktično na vseh čistilnih napravah galvanske proizvodnje se uporablja reagentna metoda. Glavni onesnaževalci tovrstne odpadne vode so ioni težkih kovin. Preostala koncentracija ionov težkih kovin, izračunana iz produkta topnosti ustreznih hidroksidov in opažena v praksi, je predstavljena v tabeli 1.
Tabela 1. Učinkovitost reagentne metode za čiščenje odpadne vode iz težkih kovin
| ion težke kovine | Koncentracija preostalih kovinskih ionov, izračunana iz produkta topnosti, mg/l | Koncentracija preostalih kovinskih ionov, opažena v praksi pri pH 8,5-9,0, mg/l | MPC RH, mg/l |
| Fe2+ | 0,44 | 0,3 - 1 | 0,1 |
| Fe3+ | 0,21 10 -4 | 0,3 - 0,5 | 0,1 |
| * Cr3+ | 0,13 10 -2 | 0,05 - 0,1 | 0,07 |
| Cu2+ | 0,024 | 0,1 - 0,15 | 0,001 |
| Ni2+ | 1,47 | 0,25 - 0,75 | 0,01 |
| Zn2+ | 0,17 | 0,05 - 0,1 | 0,01 |
| CD 2+ | 2,62 | 2,5 | 0,005 |
| Al 3+ | 0,23 10 -3 | 0,1 - 0,5 | 0,04 |
* - podatki o Cr 6+ niso podani, ker v fazi nevtralizacije iztokov, ki vsebujejo krom, reakcija kemične redukcije Cr 6+ v Cr 3+ poteka v celoti.
riž. 1. Shema uporabe različnih seznamov MPC v odpadnih vodah
Posledično obstajajo tri točke vzdolž celotne dolžine domačega kanalizacijskega sistema v katerem koli mestu, kjer je treba za odpadno vodo uporabiti različne sezname MPC (slika 1), kot je to storjeno v Moskvi (opisano spodaj):
1 - ob izstopu iz podjetja - največja koncentracija škodljive snovi v odpadnih vodah, sprejetih v mestni kanalizacijski sistem;
2 - pred vstopom na mestne postaje biološko zdravljenje- dovoljena koncentracija škodljivih snovi v odpadni vodi, sprejeti za biološko čiščenje;
3 - na mestu izpusta odpadne vode v naravni rezervoar v skladu z njegovo kategorijo - bodisi MPC škodljivih snovi v vodi vodnih teles za pitne in kulturne namene bodisi MPC v vodah vodnih teles za ribiške namene (MAC RH).
Razmislimo o uporabi različnih seznamov MPC za težke kovine v odpadnih vodah na primeru Moskve (slika 2).
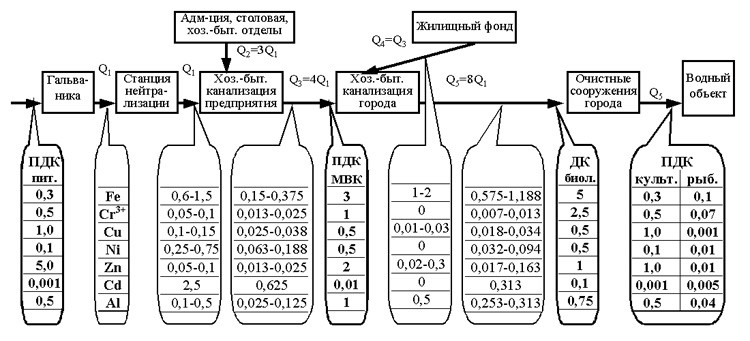
riž. Slika 2. Shema sprememb koncentracije ionov težkih kovin v odpadni vodi od galvanizacije do vodnega telesa
(Q je prostornina odpadne vode)
V podjetju se odpadna voda iz galvanske proizvodnje (Q 1), ki vsebuje ione težkih kovin, kemično obdela na nevtralizacijski postaji, zaradi česar koncentracija ionov težkih kovin doseže vrednosti, navedene v tabeli.1. Po čiščenju se odpadne vode iz galvanske proizvodnje (Q 1) razredčijo z gospodinjskimi odpadnimi vodami (Q 2) iz upravnih, gospodinjskih in drugih oddelkov podjetja, ki ne onesnažujejo odpadne vode z ioni težkih kovin. Obseg porabe vode (odvajanje vode) za galvanizacijo je praviloma približno 25 % celotne porabe vode (odvajanje vode) v podjetju (Q 3). Posledično je koncentracija ionov težkih kovin na izstopu iz podjetja 4-krat nižja od njihove koncentracije v galvanskih odpadnih vodah, ki so prešle skozi čistilne naprave. Pri normalni (načrtovani) učinkovitosti čistilnih naprav bo dejanska koncentracija težkih kovin v gospodinjski kanalizaciji na izstopu iz podjetja (Q 3) znašala: Fe 2+ 0,075-0,250 mg / l, Fe 3+ 0,075- 0,125 mg/l, (Fetotal 0,150-0,375 mg/l), Cr 3+ 0,013-0,025 mg/l, Cu 2+ 0,025-0,038 mg/l, Ni 2+ 0,063-0,188 mg/l, Zn 013- 0,025 mg/l, Cd 2+ 0,625 mg/l, Al 3+ 0,025-0,125 mg/l.
V skladu s "Pravili za sprejem industrijske odpadne vode v moskovsko mestno kanalizacijo (začasno)" št. 127, ki je bila odobrena s sklepom izvršnega odbora Moskovskega sveta z dne 20. januarja 1984, Mosvodokanal določa naslednje najvišje koncentracije težkih kovin v odpadnih vodah, sprejetih v mestno kanalizacijo (na sl. 2 MPC MVK): Fetot. 3,0 mg/l; Cr 3+ 1,0 mg/l; Cu 2+ 0,5 mg/l; Ni 2+ 0,5 mg/l; Zn 2+ 2,0 mg/l; Cd 2+ 0,01 mg/l; Al 3+ 1,0 mg/l.
Tako v Moskvi odpadna voda, ki prihaja iz podjetij v komunalni kanalizacijski sistem, z normalno (projektno) učinkovitostjo delovanja čistilnih naprav za čiščenje odpadne vode iz galvanske proizvodnje izpolnjuje zahteve MPC (z izjemo kadmija), ki jih je določil Mosvodokanal. . Zmanjšanje koncentracije kadmija v odpadnih vodah podjetij v Moskvi se doseže z omejevanjem uporabe kadmija v skladu z Uredbo vlade Moskve št. 893 z dne 05.11.96.
V kanalizaciji mestnih gospodinjstev se odpadna voda iz podjetij (Q 3) meša z gospodinjsko odpadno vodo iz mestnega stanovanjskega fonda (Q 4), v kateri so možne koncentracije težkih kovin: Fetot. 1-2 mg/l; Cr 3+ 0 mg/l; Cu 2+ 0,01-0,03 mg/l; Ni 2+ 0 mg/l; Zn 2+ 0,02-0,3 mg/l; Cd 2+ 0 mg/l; Al 3+ 0,5 mg/l. Pod pogojem, da lahko dnevna količina industrijske odpadne vode doseže največ 50 % celotnega pretoka odpadne vode mesta, je koncentracija težkih kovin v mešanih odpadnih vodah ![]() ni več kot: Fegen. - 0,575-1,188 mg / l; Cr 3+ - 0,007-0,013 mg / l; Cu 2+ - 0,018-0,034 mg / l; Ni 2+ - 0,032-0,094 mg / l; Zn 2+ - 0,017-0,163 mg / l; Cd 2+ - 0,313 mg / l; Al 3+ - 0,253-0,313 mg / l.
ni več kot: Fegen. - 0,575-1,188 mg / l; Cr 3+ - 0,007-0,013 mg / l; Cu 2+ - 0,018-0,034 mg / l; Ni 2+ - 0,032-0,094 mg / l; Zn 2+ - 0,017-0,163 mg / l; Cd 2+ - 0,313 mg / l; Al 3+ - 0,253-0,313 mg / l.
Mešane odpadne vode (Q5) s to koncentracijo težkih kovin se pošljejo v komunalne biološke čistilne naprave. Po pravilih za sprejem industrijska voda v kanalizacijske sisteme naselja"Dovoljena koncentracija težkih kovin v odpadni vodi, sprejeti za biološko čiščenje, je: Fetotal 5,0 mg/l; Cr 3+ 2,5 mg/l; Cu 2+ 0,5 mg/l; Ni 2+ 0,5 mg/l, Zn 2+ 1,0 mg/l, Cd 2+ 0,1 mg/l, Al 3+ 0,75 mg/l in gospodinjske odpadne vode izpolnjujejo seznam dovoljenih koncentracij težkih kovin (razen kadmija) za biološko čiščenje.
Praksa je pokazala, da se v procesu biološkega čiščenja odpadne vode znatno zmanjša koncentracija ionov težkih kovin (za 40-80%) zaradi njihove adsorpcije z aktivnim blatom. A tudi brez upoštevanja tega, mestne odplake (Q 5), ki vsebujejo industrijske in gospodinjske odpadne vode, glede na koncentracijo ionov težkih kovin izpolnjujejo zahteve seznama MPC škodljivih snovi (razen železa in kadmija) pri pitju. vodne ter kulturne in gospodinjske namene. Presežek vsebnosti železa v odplakah nad MPC za kulturne in gospodinjske namene je določen s prevladujočim prispevkom k temu presežku kontaminacije gospodinjskih odplak z železom.
Uporaba zahtev seznama MPC za kulturne in komunalne namene za komunalno odpadno vodo je logično pravilna, saj temelji na tezi: »odpadke je treba nadzorovati po istem seznamu MPC, po katerem se voda oskrbuje podjetja in stanovanjski sektor. je pod nadzorom«. Poleg tega MPC ITM v pitni vodi (MPCp.) praktično sovpada z njihovim MPC v vodi za gospodinjske in pitne ter kulturne namene
Ob upoštevanju dejstva, da niti reke Moskva, niti Jauze niti drugih moskovskih rek z vso željo ne moremo pripisati ribiškim vodnim telesom, so zahteve pravil in predpisov za zaščito površinskih voda pred onesnaženjem z odpadne vode iz galvanske proizvodnje v Moskvi so precej dosegljive. Za to je potrebno zagotoviti normalno delo nevtralizacijske postaje. Če količina galvanskih odpadnih voda presega 25% celotne porabe vode v podjetju, je za izpolnjevanje teh zahtev potrebno zmanjšati porabo vode za pranje v cinkarnicah in / ali uvesti lokalne naprave za čiščenje. pralna voda.
Vendar pa se zahteve seznama MPC za ribiške rezervoarje univerzalno uporabljajo za odpadno vodo, ki se odvaja v vodna telesa, in celo za odpadne vode podjetij, ki vstopajo v mestno kanalizacijo, kar dejansko onemogoča odvajanje pitne vode v odpadno vodo brez obdelave. Absurdnost zahtev za čiščenje odpadne vode iz podjetij do čistosti, globlje od čistosti pitna voda, skoraj ne more biti v dvomih. Vendar so danes vse zahteve za podjetja glede čistosti odplak dejansko (čeprav v nekoliko prikriti obliki) zmanjšane na dejstvo, da so odpadne vode veliko čistejše od vode, ki se dovaja podjetju. Drug pomemben protiargument uporabi MPC za ribiške rezervoarje za industrijsko odpadno vodo je praktična nezmožnost doseganja takšne čistosti odpadne vode s katero koli od znanih metod. "Praktičen" v smislu, da uporaba številnih metod naknadnega čiščenja odpadne vode naredi delovanje industrijskih podjetij ekonomsko neupravičeno. Tako že samo dejstvo, da je galvanska proizvodnja del podjetja, krši okoljsko zakonodajo.
To stanje še poslabša prostovoljno regionalno oblikovanje pravil. V mnogih regijah so zahteve za odpadno vodo iz podjetij veliko strožje kot celo MPC za ribiška vodna telesa. Na primer, v skladu z določbo "Navodila za urejanje emisij (izpustov) onesnaževal v ozračje in vodna telesa", ki jih je odobril namestnik predsednika Goskompriroda ZSSR 11. septembra 1989, če je dejansko izpust snovi z odpadno vodo manjša od izračunanega največjega dovoljenega izpusta (MPD), potem se za PDS vzame dejanski izpust (točka 3.4). Regionalni okoljski organi to določbo razlagajo na preprost način, ne da bi upoštevali glavni namen vzpostavitve standardov MPD – nedopustnost preseganja ugotovljene MPC. normativni dokumenti zvezni ravni ali če so preseženi pod vplivom naravnih dejavnikov ohranjanja (ne poslabšanja) sestave in lastnosti vode naravnega rezervoarja. Zato si regionalne oblasti dovolijo vzpostaviti standarde kakovosti za odpadne vode podjetij na ravni praktično čisto vodo, na primer, če med vzorčenjem v podjetju iz nekega razloga (izpad proizvodnje, popravilo opreme itd.) niso nastale onesnažene odplake. Takšni ukrepi regionalnih okoljskih organov za vzpostavitev MPD, vključno s tistimi, ki temeljijo na načelu "od dosežene ravni" (na primer zaradi povečanja učinkovitosti čistilnih naprav), negativno vplivajo na interes podjetij za izboljšanje kakovosti odpadne vode. zdravljenje.
Regionalna pobuda pri postavljanju standardov kakovosti odpadne vode pogosto doseže točko absurda. Tako je na primer v mestu Kaluga MPC cinka v odpadni vodi, poslani v gospodinjsko kanalizacijo, 3-krat manjša od MPC cinka v odpadni vodi. nevihtna kanalizacija. In to glede na dejstvo, da nevihtni odtoki se odvajajo neposredno v reko Oko, pred izpustom v naravni zbiralnik pa se gospodinjska odpadna voda razredči z gospodinjsko odpadno vodo iz mestnih stanovanjskih stavb in se očisti v mestnih čistilne naprave.
Kot primer so v tabeli 2 prikazani primerjalni podatki o MPC ionov težkih kovin v odplakah, ki jih podjetja odvajajo v mestno kanalizacijo, ki se uporabljajo v različnih državah in mestih.
Predstavljena tabela kaže, da ne samo naši zgoraj opisani premisleki, ampak tudi praksa drugih držav kažejo na izjemno nerazumno togost zahtev za kakovost odpadne vode iz ruskih podjetij. In to kljub dejstvu, da kljub tisočkrat manj strogim zahtevam v Evropi in ZDA (tabela 2) v zadnjih desetletjih prišlo je do oživitve reke Ren in do močnega zmanjšanja onesnaženosti Velikih ameriških jezer, kjer je gospodarski ribolov že dovoljen, pri nas pa tudi ob upoštevanju upada industrijske proizvodnje ni bistvenega napredka pri izboljšanju stanje vodnih virov.
Tabela 2. MPC težkih kovin v odpadnih vodah, ki jih podjetja odvajajo v mestno kanalizacijo, ki se uporabljajo v različnih državah in mestih
| Podeželsko mesto | Cu2+ | Zn2+ | Ni2+ | Cr3+ | Fe (skupaj) |
| ZDA | 2,07 | 1,48 | 2,38 | - | - |
| Nemčija | 0,5 | 2 | 0,5 | - | 3 |
| Avstrija | 0,5 | 2 | 0,5 | 0,5 | - |
| Evropska unija, EU | 0,5 | 0,5 | 0,5 | 0,5 | - |
| Litva | 1 | 1 | 0,5 | 1 | - |
| Belorusija, Minsk | 1 | 5 | 0,44 | 2,5 | 3,3 |
| Ruska federacija | |||||
| Kirzhach | 0,0001 | 0,001 | 0,001 | 0,014 | 0,006 |
| Kaluga | 0,0026 | 0,0036 | 0,012 | 0,029 | 1,98 |
| Mtsensk | 0,0009 | 0,04 | 0,028 | 0,01 | 0,1 |
| Tula | 0,0125 | 0,06 | 0,04 | 0,1 | 3,0 |
| Kazan | 0,08 | 0,066 | 0,01 | 0,4 | 0,6 |
| Eagle | 0,01 | 0,08 | 0,06 | 3,6 | 1 |
| Izhevsk | 0,23 | 0,21 | 0,04 | 1,35 | 0,4 |
| Sergijev Posad | 0,73 | 0,11 | 0,14 | 2,4 | 1,2 |
| Moskva | 0,5 | 2 | 0,5 | 1 | 3 |
| MPC za pitno vodo | 1 | 5 | 0,1 | 0,5 | 0,3 |
| MPC za zbiralnike gospodinjske in pitne ter kulturne in gospodinjske vode | 1 | 1 | 0,1 | 0,5 | 0,3 |
| MPC za ribiške rezervoarje | 0,001 | 0,01 | 0,01 | 0,07 | 0,1 |
Posledično ne gre za dejansko zmanjšanje MPC v industrijskih odpadnih vodah, ampak v drugačnem pristopu k ohranjanju kakovosti. okolje. V večini industrializiranih držav je podjetje uporabnik vode vzpostavilo takšne standarde kakovosti odpadne vode, ki jih lahko izpolni na obstoječih čistilnih napravah, ti standardi pa so enaki za vse objekte določene vrste in zmogljivosti. zato uveljavljenih standardov so dokaj dosegljive in usmerjene k temu, da vsi (brez izjeme) uporabniki vode ne presegajo uveljavljenih norm in nosijo odgovornost za svoje kršitve. Poleg tega pri prodaji na čistilnih napravah več kot učinkovite tehnologije podjetja za čiščenje so podvržena spodbudam in davčnim olajšavam, zaradi česar je podjetje deležnik okoljskih ukrepov.
Temeljna nezmožnost izvedbe regulativne zahteve na kakovost odpadne vode v regijah Ruske federacije, tudi če se izvaja največ sodobne tehnologiječiščenje skoraj 100 % podjetij spremeni v kršitelje naravnega prava in jim popolnoma odvzame spodbudo za izboljšanje okoljskih razmer. Nerazumno ostre in nerealne zahteve, nepravične pristojbine za onesnaževanje, globe in sankcije postavljajo podjetja na rob bankrota.
Vse to nakazuje, da je treba bistveno spremeniti sistem kakovosti vode in upravljanja z vodnimi viri na zvezni in regionalni ravni ter vodno zakonodajo. To vprašanje je bilo večkrat izpostavljeno v tisku, tudi na straneh revij "Oskrba z vodo in sanitarni inženiring" in
Škodljivi elementi so standard sanitarnih in higienskih pravil, določen z državnimi akti. Neupoštevanje mejnih vrednosti, ki so v njem določene, je prekršek, za katerega kršitelji odgovarjajo v skladu z zakonom. Standard MPC v vodi daje navodila o tistih mejnih vrednostih onesnaževal, katerih vsebnost ne škoduje zdravju ali življenju ljudi.
Glavni viri strupenih elementov so številna delujoča podjetja industrijskega kompleksa. Njihove emisije so dovolj močne za zemljo in vodo. Kemični elementi, ki imajo negativni vpliv v okolju okoli nas je običajno, da se delimo v skupine glede na stopnjo njihove nevarnosti za človeka. Sem spadajo nevarne snovi:
nujni primeri;
visoko;
zmerno.
Obstaja tudi skupina nevarnih elementov.
MPC v različnih vodah se odražajo v posebej oblikovanih tabelah. Obstajajo tudi različne formule, katerih uporaba vam omogoča izračun omejiti toleranco toksini. Strokovnjaki jih uporabljajo za izvajanje nadzornih ukrepov za vodo, ki jo uporabljajo ljudje. Takšna dejanja lahko izvede vsak od nas. Če želite to narediti, je dovolj, da analizirate stanje pitne vode v vašem domu in ga primerjate z njim sprejemljivi standardi biti v njem različni elementi. Na primer, vsebnost v miligramih na liter ne sme biti višja od:
Suhi ostanek - 1000;
Sulfati - 500;
Kloridi - 350;
Cink - 5;
Železo - 0,3;
Mangan - 0,1;
Preostali polifosfati - 3,5.
Skupna količina ne sme presegati sedem miligramov na liter.
Velik pomen ima tudi nadzor nad stanjem tal. To je zemlja, ki služi kot akumulator in filter za različne povezave. MPC, ki se nenehno izpuščajo v tla, morajo ustrezati tudi standardom, saj stalna migracija vanj zgornje plasti močno onesnažuje celotno okolje.
Glede na tla ne sme biti več kot:
0,02 mg/kg benzapirena;
3 mg/kg bakra;
130 mg/kg nitratov;
0,3 mg/kg toluena;
23 mg/kg cinka.
V primeru prekoračitve MPC v vodi bodo pristojni organi, ki spremljajo stanje okolja, ugotovili vzrok tega pojava. Precej pogosto ob povečanju količine v naravi kemične snovi na katere vplivajo navadni gospodinjski odpadki. Trenutno je še posebej pereč problem čiščenja vodnih teles iz fosfatnih in dušikovih spojin. Za rešitev tega problema je mogoče uporabiti tri različne pristope:
kemični;
biološki;
Kombinacija prvih dveh metod.
Dovajanje na standardno vrednost MPC v uporabi vode kemično čiščenje vključuje tvorbo kovinskih fosfatov, ki se, ker so netopni, usedejo na dno posebna posoda. Ta postopek poteka s pomočjo reagentov. Z uporabo kemične metode čiščenja najde široka uporaba na industrijska podjetja. To delo lahko izvaja samo posebej usposobljeno osebje.
Če se pri čiščenju vode uporabljajo fosfor ali P-bakterije, je ta metoda biološka. To je sodoben naravni pristop k preprečevanju presežka MPC. Posebna območja čistilnih rezervoarjev se izmenično oskrbujejo z aerobnimi in anaerobne bakterije. Ta metoda se uporablja v biofiltrih, greznicah in prezračevalnih rezervoarjih.
Kombinacija bioloških in kemične metode uporablja se v čistilnih sistemih, kjer je treba pospešiti in okrepiti reakcije razgradnje odplak.
Zelo nevarne strupene snovi. Dandanes je spremljanje ravni različnih tovrstnih snovi še posebej pomembno v industrijskih in urbanih območjih.
Čeprav vsi vedo, kaj so težke kovine, vsi ne vedo, kateri kemični elementi še spadajo v to kategorijo. Obstaja veliko meril, po katerih različni znanstveniki opredeljujejo težke kovine: strupenost, gostota, atomska masa, biokemični in geokemični cikli, razširjenost v naravi. Po enem merilu težke kovine vključujejo arzen (metaloid) in bizmut (krhka kovina).
Splošna dejstva o težkih kovinah
Znanih je več kot 40 elementov, ki jih uvrščamo med težke kovine. Imajo atomsko maso večjo od 50 a.u. Čeprav se zdi čudno, so ti elementi zelo strupeni tudi pri nizki kumulaciji za žive organizme. V, Cr, Mn, Fe, Co, Ni, Cu, Zn, Mo...Pb, Hg, U, Th... vsi spadajo v to kategorijo. Kljub svoji strupenosti so mnogi od njih pomembni, razen kadmija, živega srebra, svinca in bizmuta, za katere ni bila ugotovljena biološka vloga.
Po drugi klasifikaciji (in sicer N. Reimers) so težke kovine elementi, ki imajo gostoto večjo od 8 g / cm 3. Tako bo teh elementov manj: Pb, Zn, Bi, Sn, Cd, Cu, Ni, Co, Sb.
Teoretično lahko težke kovine imenujemo celoten periodni sistem elementov, ki se začne z vanadijem, vendar nam raziskovalci dokazujejo, da to ni povsem res. Takšna teorija je posledica dejstva, da niso vsi prisotni v naravi v mejah strupenosti, zmeda v bioloških procesih pa je za mnoge minimalna. Zato mnogi v to kategorijo vključujejo le svinec, živo srebro, kadmij in arzen. Ekonomska komisija Združenih narodov za Evropo se s tem mnenjem ne strinja in meni, da so težke kovine cink, arzen, selen in antimon. Isti N. Reimers meni, da z odstranitvijo redkih in plemenitih elementov iz periodnega sistema ostanejo težke kovine. A tudi to ni pravilo, drugi v ta razred dodajajo zlato, platino, srebro, volfram, železo, mangan. Zato ti pravim, da na tej temi še vedno ni jasno...
Razprava o ravnovesju ionov različne snovi v raztopini bomo ugotovili, da je topnost takšnih delcev povezana s številnimi dejavniki. Glavni faktorji solubilizacije so pH, prisotnost ligandov v raztopini in redoks potencial. Sodelujejo v procesih oksidacije teh elementov iz enega oksidacijskega stanja v drugo, pri katerem je topnost iona v raztopini večja.
Glede na naravo ionov se lahko v raztopini pojavijo različni procesi:
- hidroliza,
- kompleksiranje z različnimi ligandi;
- hidrolitična polimerizacija.
Zaradi teh procesov se lahko ioni oborijo ali ostanejo stabilni v raztopini. Od tega so odvisne katalitične lastnosti določenega elementa in njegova razpoložljivost za žive organizme.
Mnoge težke kovine tvorijo dokaj stabilne komplekse z organskimi snovmi. Ti kompleksi so del mehanizma migracije teh elementov v ribnikih. Skoraj vsi kelati težkih kovin so stabilni v raztopini. Tudi kompleksi talnih kislin s solmi različne kovine(molibden, baker, uran, aluminij, železo, titan, vanadij) imajo dobro topnost v nevtralnem, rahlo alkalnem in rahlo kislem okolju. To dejstvo je zelo pomembno, saj se takšni kompleksi lahko premikajo v raztopljenem stanju dolge razdalje. Najbolj ranljivi vodni viri so nizkomineralizirana in površinska vodna telesa, kjer ne prihaja do tvorbe drugih tovrstnih kompleksov. Za razumevanje dejavnikov, ki uravnavajo raven kemičnega elementa v rekah in jezerih, njihovo kemično reaktivnost, biološko uporabnost in strupenost, je treba poznati ne le celotno vsebnost, temveč tudi delež prostih in vezanih oblik kovine.
Zaradi migracije težkih kovin v kovinske komplekse v raztopini se lahko pojavijo naslednje posledice:
- Prvič, kopičenje ionov kemičnega elementa se poveča zaradi prehoda le-teh iz pridnenih sedimentov v naravne raztopine;
- Drugič, obstaja možnost spremembe prepustnosti membrane nastalih kompleksov, v nasprotju z običajnimi ioni;
- Tudi strupenost elementa v kompleksni obliki se lahko razlikuje od običajne ionske oblike.
Na primer, kadmij, živo srebro in baker v keliranih oblikah imajo manjšo toksičnost kot prosti ioni. Zato je napačno govoriti o strupenosti, biološka uporabnost, kemična reaktivnost le s celotno vsebnostjo določenega elementa, pri čemer se ne upošteva delež prostih in vezanih oblik kemičnega elementa.
Od kod prihajajo težke kovine v našem okolju? Razlogi za prisotnost takšnih elementov so lahko odpadne vode iz različnih industrijskih objektov se ukvarja s črno in barvno metalurgijo, strojništvom, galvanizacijo. Nekatere kemikalije najdemo v pesticidih in gnojilih, zato so lahko vir onesnaženja za lokalne ribnike.
In če vstopite v skrivnosti kemije, potem je glavni krivec za povečanje ravni topnih soli težkih kovin kislinski dež (kisanje). Zmanjšanje kislosti okolja (zmanjšanje pH) povzroči prehod težkih kovin iz slabo topnih spojin (hidroksidi, karbonati, sulfati) v lažje topne (nitrati, hidrosulfati, nitriti, bikarbonati, kloridi) v tleh. rešitev.
vanadij (V)
Najprej je treba opozoriti, da je kontaminacija s tem elementom po naravni poti malo verjetna, ker je ta element zelo razpršen v Zemljina skorja. V naravi ga najdemo v asfaltih, bitumnih, premogu, železovi rudi. Nafta je pomemben vir onesnaževanja.
Vsebnost vanadija v naravnih rezervoarjih
Naravni rezervoarji vsebujejo nepomembno količino vanadija:
- v rekah - 0,2 - 4,5 mcg / l,
- v morjih (v povprečju) - 2 µg/l.
Anionski kompleksi (V 10 O 26) 6- in (V 4 O 12) 4- so zelo pomembni v procesih prehoda vanadija v raztopljeno stanje. Zelo pomembni so tudi topni vanadijevi kompleksi z organskimi snovmi, kot so huminske kisline.
Največja dovoljena koncentracija vanadija za vodno okolje
Vanadij v velikih odmerkih je zelo škodljiv za ljudi. Najvišja dovoljena koncentracija za vodno okolje (MPC) je 0,1 mg/l, v ribnikih pa je MPC ribogojnice še nižja - 0,001 mg/l.
bizmut (Bi)
V glavnem lahko bizmut vstopi v reke in jezera zaradi izpiranja mineralov, ki vsebujejo bizmut. Obstajajo tudi umetni viri onesnaženja s tem elementom. To so lahko tovarne stekla, parfumov in farmacevtskih izdelkov.
Vsebnost bizmuta v naravnih rezervoarjih
- Reke in jezera vsebujejo manj kot mikrogram bizmuta na liter.
- In tukaj Podtalnica lahko vsebuje celo 20 µg/l.
- V morjih bizmut praviloma ne presega 0,02 µg/l.
Največja dovoljena koncentracija bizmuta za vodno okolje
Največja dovoljena koncentracija bizmuta za vodno okolje je 0,1 mg/l.
železo (Fe)
železo - kemični element ni redek, vsebuje ga veliko mineralov in kamnin, zato je v naravnih rezervoarjih raven tega elementa višja od drugih kovin. Lahko se pojavi kot posledica vremenskih procesov. skale, uničenje teh kamnin in raztapljanje. Pri tvorbi različnih kompleksov z organskimi snovmi iz raztopine je železo lahko v koloidnem, raztopljenem in suspendiranem stanju. Nemogoče je ne omeniti antropogenih virov onesnaženja z železom. Odpadne vode iz metalurških, kovinarskih, tovarn barv in lakov ter tekstilnih tovarn včasih zaradi presežka železa presežejo obseg.
Količina železa v rekah in jezerih je odvisna od kemična sestava raztopino, pH in delno na temperaturo. Utežene oblike železovih spojin imajo velikost več kot 0,45 μg. Glavne snovi, ki so del teh delcev, so suspenzije s sorbiranimi železovimi spojinami, hidratom železovega oksida in drugimi minerali, ki vsebujejo železo. Manjše delce, torej koloidne oblike železa, obravnavamo skupaj z raztopljenimi železovimi spojinami. Železo v raztopljenem stanju sestavljajo ioni, hidroksokopleksi in kompleksi. Glede na valenco opazimo, da Fe(II) migrira v ionski obliki, medtem ko Fe(III) ostane v raztopljenem stanju brez različnih kompleksov.
V ravnovesju železovih spojin v vodni raztopini je zelo pomembna tudi vloga oksidacijskih procesov, tako kemičnih kot biokemičnih (železove bakterije). Te bakterije so odgovorne za prehod železovih ionov Fe(II) v stanje Fe(III). Železove spojine nagibajo k hidrolizaciji in oborini Fe(OH) 3 . Tako Fe(II) kot Fe(III) tvorita hidrokso komplekse tipa -, +, 3+, 4+, +, odvisno od kislosti raztopine. AT normalnih razmerah v rekah in jezerih je Fe(III) povezan z različnimi raztopljenimi anorganskimi in organskimi snovmi. Pri pH, večjem od 8, se Fe(III) pretvori v Fe(OH) 3 . Koloidne oblike železovih spojin so najmanj raziskane.
Vsebnost železa v naravnih vodah
V rekah in jezerih raven železa niha na ravni n * 0,1 mg/l, vendar se lahko v bližini močvirja dvigne na nekaj mg/l. V močvirjih je železo koncentrirano v obliki humatnih soli (soli huminskih kislin).
Podzemni rezervoarji z nizkim pH vsebujejo rekordne količine železa - do nekaj sto miligramov na liter.
Železo je pomemben element v sledovih in od njega so odvisni različni pomembni biološki procesi. Vpliva na intenzivnost razvoja fitoplanktona in od tega je odvisna kakovost mikroflore v vodnih telesih.
Raven železa v rekah in jezerih je sezonska. Najvišje koncentracije v vodnih telesih so opažene pozimi in poleti zaradi stagnacije vode, spomladi in jeseni pa se raven tega elementa opazno zmanjša zaradi mešanja vodnih mas.
Tako velika količina kisika vodi do oksidacije železa iz dvovalentne oblike v trivalentno obliko, pri čemer nastane železov hidroksid, ki se obori.
Največja dovoljena koncentracija železa za vodno okolje
Za vodo z veliko količino železa (več kot 1-2 mg / l) je značilna slaba okusnost. Je neprijetnega adstrigentnega okusa in ni primeren za industrijske namene.
MPC železa za vodno okolje je 0,3 mg/l, v ribnikih pa je MPC ribogojnic 0,1 mg/l.
kadmij (Cd)
Do onesnaženja s kadmijem lahko pride med izpiranjem tal, med razgradnjo različnih mikroorganizmov, ki ga kopičijo, pa tudi zaradi selitve iz bakrovih in polikovinskih rud.
Za kontaminacijo s to kovino je kriv tudi človek. Odpadne vode iz različnih podjetij, ki se ukvarjajo s pridobivanjem rude, galvansko, kemično, metalurško proizvodnjo, lahko vsebujejo velike količine kadmijevih spojin.
Naravni procesi za zniževanje ravni kadmijevih spojin so sorpcija, njena poraba s strani mikroorganizmov in obarjanje slabo topnega kadmijevega karbonata.
V raztopini je kadmij praviloma v obliki organo-mineralnih in mineralnih kompleksov. Sorbirane snovi na osnovi kadmija so najpomembnejše suspendirane oblike tega elementa. Zelo pomembna je migracija kadmija v živih organizmih (hidrobionitih).
Vsebnost kadmija v naravnih vodnih telesih
Raven kadmija v čistih rekah in jezerih niha na ravni manj kot mikrogram na liter, v onesnaženih vodah raven tega elementa doseže nekaj mikrogramov na liter.
Nekateri raziskovalci verjamejo, da je kadmij v majhnih količinah lahko pomemben za normalen razvoj živali in ljudi. Povišane koncentracije kadmija so zelo nevarne za žive organizme.
Največja dovoljena koncentracija kadmija za vodno okolje
MPC za vodno okolje ne presega 1 μg/l, v ribnikih pa je MPC za ribogojnice nižja od 0,5 μg/l.
kobalt (Co)
Reke in jezera se lahko onesnažijo s kobaltom zaradi izpiranja bakrovih in drugih rud, iz tal med razgradnjo izumrlih organizmov (živali in rastlin) ter seveda zaradi dejavnosti kemičnih, metalurških in kovinskopredelovalnih podjetij. .
Glavne oblike kobaltovih spojin so v raztopljenem in suspendiranem stanju. Razlike med tema dvema stanjema se lahko pojavijo zaradi sprememb pH, temperature in sestave raztopine. V raztopljenem stanju se kobalt nahaja v obliki organskih kompleksov. Reke in jezera imajo značilnost, da je kobalt predstavljen z dvovalentnim kationom. V prisotnosti veliko število oksidanti v raztopini, kobalt lahko oksidiramo v trivalentni kation.
Je del rastlin in živali, ker se igra pomembno vlogo v njihovem razvoju. Je eden glavnih elementov v sledovih. Če v tleh primanjkuje kobalta, bo njegova raven v rastlinah manjša kot običajno in posledično se lahko pojavijo zdravstvene težave pri živalih (obstaja nevarnost anemije). To dejstvo opazimo zlasti v nečernozemskem območju tajge in gozda. Je del B 12, uravnava absorpcijo dušikovih snovi, povečuje raven klorofila in askorbinske kisline. Brez tega rastline ne morejo rasti zahtevani znesek veverica. Kot vse težke kovine je lahko strupen velike količine.
Vsebnost kobalta v naravnih vodah
- Ravni kobalta v rekah se gibljejo od nekaj mikrogramov do miligramov na liter.
- V morjih je povprečna raven kadmija 0,5 µg/l.
Največja dovoljena koncentracija kobalta za vodno okolje
MPC za kobalt za vodno okolje je 0,1 mg/l, v ribnikih pa je MPC za ribogojnice 0,01 mg/l.
mangan (Mn)
Mangan vstopa v reke in jezera po enakih mehanizmih kot železo. Predvsem se sproščanje tega elementa v raztopini pojavi pri izpiranju mineralov in rud, ki vsebujejo mangan (črni oker, brownit, piroluzit, psilomelan). Mangan lahko nastane tudi pri razgradnji različnih organizmov. Mislim, da ima industrija največjo vlogo pri onesnaževanju z manganom (odplake iz rudnikov, kemična industrija, metalurgija).
Pojavi se zmanjšanje količine asimilirane kovine v raztopini, tako kot pri drugih kovinah v aerobnih pogojih. Mn(II) se oksidira v Mn(IV), zaradi česar se obori v obliki MnO 2 . Pomembni dejavniki pri takih procesih se upoštevajo temperatura, količina raztopljenega kisika v raztopini in pH. Zmanjšanje raztopljenega mangana v raztopini se lahko pojavi, ko ga zaužijejo alge.
Mangan migrira predvsem v obliki suspenzij, ki praviloma kažejo na sestavo okoliških kamnin. Vsebujejo ga kot mešanico z drugimi kovinami v obliki hidroksidov. Prevlada mangana v koloidni in raztopljeni obliki kaže, da je povezan z organske spojine tvorijo komplekse. Stabilne komplekse vidimo pri sulfatih in bikarbonatih. S klorom mangan redkeje tvori komplekse. Za razliko od drugih kovin je v kompleksih šibkeje zadržan. Trivalentni mangan tvori takšne spojine le v prisotnosti agresivnih ligandov. Druge ionske oblike (Mn 4+, Mn 7+) so manj redke ali pa jih v normalnih razmerah v rekah in jezerih sploh ne najdemo.
Vsebnost mangana v naravnih vodnih telesih
Morja veljajo za najrevnejše v manganu - 2 μg / l, v rekah je njegova vsebnost višja - do 160 μg / l, vendar so tokrat prvaki podzemni rezervoarji - od 100 μg do nekaj mg / l.
Za mangan so značilna sezonska nihanja koncentracije, kot za železo.
Ugotovljeno je bilo veliko dejavnikov, ki vplivajo na raven prostega mangana v raztopini: povezava rek in jezer s podzemnimi rezervoarji, prisotnost fotosintetskih organizmov, aerobne razmere, razgradnja biomase (mrtvi organizmi in rastline).
Pomembna biokemična vloga tega elementa, saj je vključen v skupino mikroelementov. Pri pomanjkanju mangana se zavirajo številni procesi. Poveča intenzivnost fotosinteze, sodeluje pri presnovi dušika, ščiti celice pred negativni vpliv Fe(II), medtem ko ga oksidira v trivalentno obliko.
Največja dovoljena koncentracija mangana za vodno okolje
MPC za mangan za rezervoarje - 0,1 mg/l.
baker (Cu)
Noben mikroelement nima tako pomembne vloge za žive organizme! Baker je eden najbolj iskanih elementov v sledovih. Je del številnih encimov. Brez tega v živem organizmu skoraj nič ne deluje: motena je sinteza beljakovin, vitaminov in. Brez tega se rastline ne morejo razmnoževati. Vseeno pa presežna količina bakra povzroča veliko zastrupitev pri vseh vrstah živih organizmov.
Raven bakra v naravnih vodah
Čeprav ima baker dve ionski obliki, se Cu(II) najpogosteje pojavlja v raztopini. Običajno so spojine Cu(I) težko topne v raztopini (Cu 2 S, CuCl, Cu 2 O). V prisotnosti kakršnih koli ligandov lahko nastanejo različni akvaionski bakri.
Z današnjo veliko uporabo bakra v industriji in kmetijstvo, lahko ta kovina povzroči onesnaževanje okolja. Kemični, metalurški obrati, rudniki so lahko viri odpadne vode z visoko vsebnostjo bakra. K kontaminaciji z bakrom prispevajo tudi procesi erozije cevovodov. Najpomembnejši minerali z visoko vsebnostjo bakra so malahit, bornit, halkopirit, halkocit, azurit, brontantin.
Največja dovoljena koncentracija bakra za vodno okolje
MPC bakra za vodno okolje se šteje za 0,1 mg/l, v ribnikih pa je MPC bakra v ribogojnici zmanjšan na 0,001 mg/l.
molibden (Mo)
Med izpiranjem mineralov z visoko vsebnostjo molibdena, različne povezave molibden. Visoka stopnja molibden je mogoče videti v rekah in jezerih, ki so blizu tovarn za beneficijacijo in podjetij barvne metalurgije. Zaradi različnih procesov obarjanja težko topnih spojin, adsorpcije na površini različne pasme, kot tudi uporaba vodnih alg in rastlin, se lahko njegova količina opazno zmanjša.
Večinoma v raztopini je molibden lahko v obliki aniona MoO 4 2-. Obstaja možnost prisotnosti molibden-organskih kompleksov. Zaradi dejstva, da med oksidacijo molibdenita nastanejo ohlapne fino dispergirane spojine, se raven koloidnega molibdena poveča.
Vsebnost molibdena v naravnih rezervoarjih
Ravni molibdena v rekah se gibljejo med 2,1 in 10,6 µg/l. V morjih in oceanih je njegova vsebnost 10 mcg / l.
V nizkih koncentracijah molibden pomaga pri normalnem razvoju organizma (tako rastlinskega kot živalskega), saj je vključen v kategorijo mikroelementov. Tudi on je sestavni del različni encimi, kot je ksantin oksilaza. Ob pomanjkanju molibdena pride do pomanjkanja tega encima in tako lahko pride do negativnih učinkov. Presežek tega elementa tudi ni dobrodošel, ker je moten normalen metabolizem.
Največja dovoljena koncentracija molibdena za vodno okolje
MPC za molibden v površinskih vodnih telesih ne sme presegati 0,25 mg/l.
arzen (as)
Z arzenom so onesnažena predvsem območja, ki so blizu rudnikov mineralov z visoko vsebnostjo tega elementa (volfram, baker-kobalt, polimetalne rude). Pri razgradnji živih organizmov lahko nastane zelo majhna količina arzena. Zahvaljujoč vodnim organizmom ga ti lahko absorbirajo. V obdobju hitrega razvoja planktona opazimo intenzivno asimilacijo arzena iz raztopine.
Najpomembnejša onesnaževala z arzenom so industrija za obogatitev, podjetja za proizvodnjo barvil, pa tudi kmetijstvo.
Jezera in reke vsebujejo arzen v dveh stanjih: suspendiranem in raztopljenem. Razmerja med temi oblikami se lahko razlikujejo glede na pH raztopine in kemično sestavo raztopine. V raztopljenem stanju je arzen lahko trivalenten ali petovalenten, prehaja v anionske oblike.
Raven arzena v naravnih vodah
V rekah je vsebnost arzena praviloma zelo nizka (na ravni µg/l), v morjih pa povprečno 3 µg/l. nekaj mineralna voda lahko vsebuje velike količine arzena (do nekaj miligramov na liter).
Večina arzena lahko vsebuje podzemne rezervoarje - do nekaj deset miligramov na liter.
Njegove spojine so zelo strupene za vse živali in ljudi. V velikih količinah so moteni procesi oksidacije in prenosa kisika v celice.
Največja dovoljena koncentracija arzena za vodno okolje
MPC za arzen za vodno okolje je 50 µg/l, v ribnikih pa je MPC za ribogojnice tudi 50 µg/l.
nikelj (Ni)
Na vsebnost niklja v jezerih in rekah vplivajo lokalne kamnine. Če so v bližini rezervoarja nahajališča nikljevih in železo-nikljevih rud, je koncentracija lahko celo višja od običajne. Nikelj lahko vstopi v jezera in reke, ko se rastline in živali razgradijo. Modrozelene alge vsebujejo rekordne količine niklja v primerjavi z drugimi rastlinskimi organizmi. Pomembne odpadne vode z visoko vsebnostjo niklja se sproščajo med proizvodnjo sintetičnega kavčuka, med procesi ponikljanja. Nikelj se v velikih količinah sprošča tudi pri zgorevanju premoga in nafte.
Visok pH lahko povzroči oborino niklja v obliki sulfatov, cianidov, karbonatov ali hidroksidov. Živi organizmi lahko z zaužitjem znižajo raven mobilnega niklja. Pomembni so tudi procesi adsorpcije na površini kamnin.
Voda lahko vsebuje nikelj v raztopljeni, koloidni in suspendirani obliki (ravnotežje med temi stanji je odvisno od pH medija, temperature in sestave vode). Železov hidroksid, kalcijev karbonat, glina dobro adsorbirajo spojine, ki vsebujejo nikelj. Raztopljeni nikelj je v obliki kompleksov s fulvičnimi in huminskimi kislinami, pa tudi z aminokislinami in cianidi. Ni 2+ velja za najbolj stabilno ionsko obliko. Ni 3+ običajno nastane pri visokem pH.
Sredi petdesetih let prejšnjega stoletja je bil nikelj dodan na seznam elementov v sledovih, ker igra pomembno vlogo pri različne procese kot katalizator. V majhnih odmerkih ima pozitiven učinek na hematopoetske procese. Veliki odmerki so še vedno zelo nevarni za zdravje, saj je nikelj rakotvoren kemični element in lahko izzove različne bolezni dihal. Prosti Ni 2+ je bolj strupen kot v obliki kompleksov (približno 2-krat).
Nivo niklja v naravnih vodah
Največja dovoljena koncentracija niklja za vodno okolje
MPC za nikelj za vodno okolje je 0,1 mg/l, v ribnikih pa je MPC za ribogojnice 0,01 mg/l.
kositer (Sn)
Naravni viri kositra so minerali, ki vsebujejo ta element (stanin, kasiterit). Antropogeni viri so obrati in tovarne za proizvodnjo različnih organskih barv ter metalurška industrija, ki delajo z dodatkom kositra.
Kositer je nizko strupena kovina, zato z uživanjem hrane iz pločevinke ne tvegamo svojega zdravja.
Jezera in reke vsebujejo manj kot mikrogram kositra na liter vode. Podzemni rezervoarji lahko vsebujejo več mikrogramov kositra na liter.
Največja dovoljena koncentracija kositra za vodno okolje
MPC kositra za vodno okolje - 2 mg/l.
živo srebro (Hg)
predvsem povišana ravenživo srebro v vodi vidimo na območjih, kjer so nahajališča živega srebra. Najpogostejši minerali so živi kamen, cinabarit, metacinabarit. Odpadne vode iz tovarn farmacevtskih izdelkov, pesticidov in barvil lahko vsebujejo pomembne količine živega srebra. Drug pomemben vir onesnaženja z živim srebrom je termoelektrarne(ki uporabljajo premog kot gorivo).
Njegova raven v raztopini se zmanjšuje predvsem zaradi morskih živali in rastlin, ki kopičijo in celo koncentrirajo živo srebro! Včasih je vsebnost živega srebra v morskem življenju nekajkrat višja kot v morskem okolju.
Naravna voda vsebuje živo srebro v dveh oblikah: suspendirani (v obliki sorbiranih spojin) in raztopljeni (kompleksne, mineralne spojine živega srebra). Na nekaterih območjih oceanov se živo srebro lahko pojavi kot kompleksi metil živega srebra.
Živo srebro in njegove spojine so zelo strupene. Pri visokih koncentracijah negativno vpliva na živčni sistem, izzove spremembe v krvi, vpliva na izločanje prebavnega trakta in motorično delovanje. Produkti predelave živega srebra z bakterijami so zelo nevarni. Na osnovi živega srebra lahko sintetizirajo organske snovi, ki so večkrat bolj strupene od anorganskih spojin. Pri uživanju rib lahko spojine živega srebra vstopijo v naše telo.
Največja dovoljena koncentracija živega srebra za vodno okolje
MPC živega srebra v navadna voda- 0,5 µg/l, v ribnikih pa je MPC za ribogojnice manj kot 0,1 µg/l.
svinec (Pb)
Reke in jezera se lahko onesnažijo s svincem na naraven način, ko se svinčevi minerali izpirajo (galen, anglizit, cerusit), in na antropogen način (kurjenje premoga, uporaba tetraetil svinca v gorivu, izpusti iz rudarskih tovarn, odpadne vode iz rudnikov in metalurških obratov). Obarjanje svinčevih spojin in adsorpcija teh snovi na površini različnih kamnin sta najpomembnejši naravni metodi za zniževanje njegove ravni v raztopini. Od bioloških dejavnikov hidrobionti vodijo do znižanja ravni svinca v raztopini.
Svinec v rekah in jezerih je v suspendirani in raztopljeni obliki (mineralni in organo-mineralni kompleksi). Tudi svinec je v obliki netopnih snovi: sulfati, karbonati, sulfidi.
Vsebnost svinca v naravnih vodnih telesih
Veliko smo slišali o strupenosti te težke kovine. Že v majhnih količinah je zelo nevaren in lahko povzroči zastrupitev. Svinec vstopi v telo skozi dihala in prebavni sistem. Njegovo izločanje iz telesa je zelo počasno, kopiči pa se lahko v ledvicah, kosteh in jetrih.
Največja dovoljena koncentracija svinca za vodno okolje
MPC svinca za vodno okolje je 0,03 mg/l, v ribnikih pa je MPC ribogojnic 0,1 mg/l.
Tetraetil svinec
Služi kot sredstvo proti detonaciji v motornih gorivih. Tako so glavni viri onesnaženja s to snovjo vozila.
Ta spojina je zelo strupena in se lahko kopiči v telesu.
Največja dovoljena koncentracija tetraetil svinca za vodno okoljeNajvišja dovoljena raven te snovi se približuje ničli.
Tetraetil svinec na splošno ni dovoljen v sestavi voda.
srebro (AG)
Srebro prihaja v reke in jezera predvsem iz podzemnih rezervoarjev in kot posledica odvajanja odpadne vode iz podjetij (fotografska podjetja, tovarne za obogatitev) in rudnikov. Drug vir srebra so lahko algicidna in baktericidna sredstva.
V raztopini so najpomembnejše spojine srebrove halogenidne soli.
Vsebnost srebra v naravnih vodah
V čistih rekah in jezerih je vsebnost srebra manjša od mikrograma na liter, v morjih - 0,3 µg/l. Podzemni rezervoarji vsebujejo do nekaj deset mikrogramov na liter.
Srebro v ionski obliki (v določenih koncentracijah) ima bakteriostatski in baktericidni učinek. Da bi lahko sterilizirali vodo s srebrom, mora biti njegova koncentracija večja od 2 * 10 -11 mol / l. Biološka vloga srebro v telesu še vedno ni dobro poznano.
Največja dovoljena koncentracija srebra za vodno okolje
Največja dovoljena vsebnost srebra za vodno okolje je 0,05 mg / l.
PEEP - največja dovoljena koncentracija snovi v vodi rezervoarja za pitno in gospodinjsko vodo, mg / l. Ta koncentracija ne sme neposredno ali posredno vplivati na človeško telo skozi vse življenje, pa tudi na zdravje naslednjih generacij in ne sme poslabšati higienskih pogojev za uporabo vode. PEEP.r. - Največja dovoljena koncentracija snovi v vodi rezervoarja, ki se uporablja za ribiške namene, mg/l.
Ocena kakovosti vodnih ekosistemov temelji na normativnih in direktivnih dokumentih z uporabo neposrednih hidrogeokemijskih ocen. V tabeli. 2.4 so kot primer podana merila za ocenjevanje kemične onesnaženosti površinskih voda.
Določene so omejitve za vodo dovoljene koncentracije več kot 960 kemične spojine, ki so združeni v tri skupine po naslednjih omejevalnih kazalnikih škodljivosti (LPV): sanitarno-toksikološki (s.-t.); splošni sanitarni (gen.); organoleptični (org.).
MPC nekaterih škodljivih snovi v vodno okolje so predstavljeni v tabeli. 2.1.4.
Večina visoke zahteve nanašajo na pitno vodo. Državni standard na vodi, ki se uporablja za pitje in Prehrambena industrija(SanPiN 2.1.4.1074-01), določa organoleptične kazalnike vode, ki so ugodni za človeka: okus, vonj, barva, prosojnost, pa tudi neškodljivost njene kemične sestave in epidemiološko varnost.
Tabela 2.1.4
MPC škodljivih snovi v vodnih telesih za gospodinjstvo in pitje
kulturna in gospodinjska raba vode, mg/l
(GN 2.1.5.689-98)
| Snovi | LPV | MPC |
| 1 | 2 | 3 |
| />Bor | S.-t. | 0,5 |
| brom | S.-t. | 0,2 |
| bizmut | S.-t. | 0,1 |
| heksaklorobenzen | S.-t. | 0,05 |
| dimetilamin | S.-t. | 0,1 |
| Difluorodiklorometan (freon) | S.-t. | 10 |
| dietil eter | Org. | 0,3 |
| železo | Org. | 0,3 |
| izopren | Org. | 0,005 |
| kadmij | S.-t. | 0,001 |
| Karbofos | Org. | 0,05 |
| kerozin: | | |
| oksidirano | Org. | 0,01 |
| Razsvetljava (GOST 4753-68) | Org. | 0,05 |
| Tehnični | Org. | 0,001 |
| kislina: | | |
| benzojska | Tot. | 0,6 |
| Difenilocetna kislina | Tot. | 0,5 |
| mastna | Tot. | 0,7 |
| Formic | Tot. | 3,5 |
| Ocetna | Tot. | 1,2 |
| Sintetične maščobne kisline | Tot. | 0,1 |
| C5-C20 | | |
| mangan | Org. | 0,1 |
| baker | Org. | 1 |
| metanol | sv. | 3 |
| molibden | sv. | 0,25 |
| Urea | Tot. | 1 |
| Naftalin | Org. | 0,01 |
| olje: | | |
| poližvepla | Org. | 0,1 |
| vzdržljiv | Org. | 0,3 |
| Nitrati za: | | |
| NO3- | sv. | 45 |
| NO2- | sv. | 3,3 |
| Polietilenamin | sv. | 0,1 |
| Tiocianati | sv. | 0,1 |
| Merkur | sv. | 0,0005 |
| Svinec | sv. | 0,03 |
| ogljikov disulfid | Org. | 1 |
| terpentin | Org. | 0,2 |
| Sulfidi | Tot. | Odsotnost |
| Tetraetil svinec | sv. | Odsotnost |
| Tributil fosfat | Tot. | 0,01 |
Pitna voda v katerem koli letnem času ne sme vsebovati manj kot 4 g / m kisika, prisotnost mineralnih nečistoč (mg / l) v njej pa ne sme presegati: sulfatov (SO4 -) - 500; kloridi (Cl-) - 350; železo (Fe2+ + Fe3+) - 0,3; mangan (Mn2+) - 0,1; baker (Cu2+) - 1,0; cink (Zn2+) - 5,0; aluminij (Al) - 0,5; metafosfati (PO3") - 3,5; fosfati (PO4
3") - 3,5; suhi ostanek - 1000. Tako je voda primerna za pitje, če njena skupna vsebnost mineralov ne presega 1000 mg / l. Zelo nizka vsebnost mineralov v vodi (pod 1000 mg / l) tudi poslabša njen okus in voda, praviloma brez soli (destilirana), je zdravju škodljiva, saj njena uporaba moti prebavo in delovanje žlez z notranjim izločanjem. Včasih je v dogovoru s sanitarno epidemiološko službo vsebnost suhega ostanka do 1500 mg/l. dovoljeno.
Kazalniki, ki označujejo onesnaženost rezervoarjev in pitne vode s snovmi, uvrščenimi v 3. in 4. razred nevarnosti, ter fizikalno-kemijske lastnosti in organoleptične lastnosti vode so dodatne. Uporabljajo se za potrditev stopnje intenzivnosti antropogenega onesnaženja vodnih virov, ugotovljene s prednostnimi kazalniki.
Uporaba različnih meril za ocenjevanje kakovosti vode bi morala temeljiti na prednostih zahtev za rabo vode, katere merila so strožja. Na primer, če vodno telo hkrati služi pitju in ribištvu, se lahko za oceno kakovosti vode naložijo strožje zahteve (okoljske in ribiške).
PCP-10 (indikator kemične onesnaženosti). Ta kazalnik je še posebej pomemben za območja, kjer opazimo kemično onesnaženje za več snovi hkrati, od katerih vsaka večkrat presega MPC. Izračuna se le pri določanju območij izrednih okoljskih razmer in območij okoljske katastrofe.
Izračun se izvede za deset spojin, ki maksimalno presegajo MPC, po formuli:
PKhZ-10 = C1 / MPC1 + C2 / MPC2 + C3 / MPC3 + ... C10 / MPC10,
kjer je Cb C2, C3 ... Cb - koncentracija kemikalij v vodi: MPC - ribištvo.
Pri določanju PCP-10 za kemikalije, za katere ni relativno zadovoljive vrednosti onesnaženosti vode, se razmerje C/MAC pogojno vzame enako 1.
Za določitev PCP-10 je priporočljivo analizirati vodo glede na največje možno število indikatorjev.
Dodatni kazalniki vključujejo splošno sprejete fizikalno-kemijske in biološke značilnosti dajanje splošna ideja o sestavi in kakovosti vode. Ti kazalniki se uporabljajo za dodatno karakterizacijo procesov, ki se pojavljajo v vodnih telesih. Poleg tega v dodatne značilnosti vključujejo kazalnike, ki upoštevajo sposobnost kopičenja onesnaževal v pridnenih sedimentih in hidrobiontih.
Koeficient akumulacije dna CDA se izračuna po formuli:
KDA \u003d Sd.o. / Sv,
kjer je Sd. približno in Sv - koncentracija onesnaževal v pridnenih sedimentih in v vodi.
Koeficient kopičenja v hidrobiontih:
Kn \u003d Sg / Sv,
kjer je Cr koncentracija onesnaževal v hidrobiontih.
Kritične koncentracije kemikalij (CC) se določijo po metodi za določanje kritičnih koncentracij onesnaževal, ki jo je leta 1983 razvil Državni komite za hidrometeorologijo.
Povprečne vrednosti CC nekaterih onesnaževal so, mg/l: baker - 0,001 ... 0,003; kadmij - 0,008 ... 0,020; cink - 0,05...0,10; PCB - 0,005; benzo(a)piren - 0,005.
Pri ocenjevanju stanja vodnih ekosistemov so dovolj zanesljivi kazalniki značilnosti stanja in razvoja vseh okoljske skupine vodna skupnost.
Pri določanju obravnavanih območij se uporabljajo indikatorji za bakterio-, fito- in zooplankton ter za ihtiofavno. Poleg tega se za določitev stopnje strupenosti vode uporablja integralni indikator - biotestiranje (za nižje rake). V tem primeru je treba upoštevati ustrezno strupenost vodne mase v vseh glavnih fazah hidrološkega cikla.
Glavni kazalniki za fito- in zooplankton ter za zoobentos so bili sprejeti na podlagi podatkov regionalnih hidrobioloških nadzornih služb, ki označujejo stopnjo ekološke degradacije sladkovodnih ekosistemov.
Predlagane parametre kazalnikov za dodelitev con na določenem ozemlju je treba oblikovati na podlagi dovolj dolgotrajnih opazovanj (vsaj tri leta).
Upoštevati je treba, da so vrednosti kazalnikov vrst lahko različne klimatske cone.
Pri ocenjevanju stanja vodnih ekosistemov so pomembni kazalniki ihtiofavne, zlasti za edinstvena, posebej zaščitena vodna telesa in rezervoarje prve in najvišje ribiške kategorije.
BPK - biološka potreba po kisiku - količina kisika, uporabljenega v biokemičnih procesih oksidacije organskih snovi (razen procesov nitrifikacije) za določen čas inkubacije vzorca (2, 5, 20, 120 dni), mg O2 / l vode (BPKp - 20 dni, BPK5 - 5 dni).
Oksidativni proces v teh pogojih izvajajo mikroorganizmi, ki uporabljajo organske sestavine kot hrano. Metoda BOD je naslednja. Po dvournem usedanju preiskovano odpadno vodo razredčimo s čisto vodo, odvzeto v takšni količini, da kisik, ki je v njej, zadostuje za popolno oksidacijo vseh organskih snovi v odpadni vodi. Ko določimo vsebnost raztopljenega kisika v nastali zmesi, jo pustimo v zaprti steklenici 2, 3, 5, 10, 15 dni, pri čemer določimo vsebnost kisika po vsakem od navedenih časovnih obdobij (inkubacijsko obdobje). Zmanjšanje količine kisika v vodi kaže, koliko ga je bilo v tem času porabljenega za oksidacijo organskih snovi v odpadni vodi. Ta količina, ki se nanaša na 1 liter odpadne vode, je pokazatelj biokemične porabe kisika v odpadni vodi za dano časovno obdobje (BPK2, BPKz, BPK5, BPKw, BPK15).
Treba je opozoriti, da biokemična poraba kisika ne vključuje njegove porabe za nitrifikacijo. Zato je treba opraviti popolno BPK pred začetkom nitrifikacije, ki se običajno začne po 15-20 dneh. BPK odpadne vode se izračuna po formuli:
BOD = [(a1 ~ b1) ~ (a2 ~ b2)] X 1000
V'
pri čemer je ai koncentracija kisika v vzorcu, pripravljenem za določanje na začetku inkubacije (na »ničelni dan«), mg/l; а2 - koncentracija kisika v vodi za redčenje na začetku inkubacije, mg/l; b1 - koncentracija kisika v vzorcu ob koncu inkubacije, mg/l; b2 koncentracija kisika v vodi za redčenje na koncu inkubacije, mg/l; V je prostornina odpadne vode v 1 litru vzorca po vseh razredčenjih, ml.
COD - kemična potreba v kisiku, določeno z bikromatno metodo, t.j. količina kisika, ki ustreza količini porabljenega oksidanta, potrebnega za oksidacijo vseh redukcijskih sredstev, ki jih vsebuje voda, mg O2/l vode.
Kemična poraba kisika, izražena kot število miligramov kisika na 1 liter odpadne vode, se izračuna po formuli:
HPC - 8(a - b)x N1000
V'
kjer je a prostornina raztopine Mohrove soli, uporabljene za titracijo v slepem poskusu, ml; b prostornina iste raztopine, uporabljene za titracijo vzorca, ml; N je normalnost titrirane raztopine Mohrove soli; V prostornina analizirane odpadne vode, ml; 8 - kisikov ekvivalent.
Glede na BPK/KPK se presoja učinkovitost biokemične oksidacije snovi.
