خصائص الطرق الرئيسية لتحليل المياه. الطرق الكيميائية لبحوث المياه
تحت الأكسدةفهم قدرة المواد العضوية في الماء على أن تتأكسد بالأكسجين الذري. يتم التعبير عن قيمة الأكسدة بكمية الأكسجين (ملغ) المطلوبة لأكسدة المواد العضوية الموجودة في لتر واحد من الماء. مصدر الأكسجين الذري في هذه التفاعلات هو برمنجنات البوتاسيوم أو ثنائي كرومات ، وتسمى قابلية الأكسدة على التوالي برمنجنات أو ثنائي كرومات. عادة ، يتم تحديد قابلية الأكسدة في الماء الحمضي ، ولكن عندما يكون محتوى الكلوريدات في الماء أكثر من 300 مجم / لتر ويكون شديد التلوث ، يتم إجراء الدراسة في بيئة قلوية.
طريقة البرمنجنات (حسب كوبيل).بناءً على قدرة برمنجنات البوتاسيوم على إطلاق الأكسجين في بيئة حمضية. من خلال كمية الأكسجين المستهلكة ، يتم الحكم على قابلية أكسدة الماء.
أدوات المائدة والأواني: السحاح ، ماصات 5 مل ، قوارير 250-300 مل ، اسطوانات قياس 100 مل ، أنابيب اختبار ، خرز زجاجي ، قمع بقطر 5-7 سم.
الكواشف:
1) محلول من برمنجنات البوتاسيوم (0.01 ن) - لهذا الغرض ، يتم إذابة 0.316 جم من الدواء في 1 لتر من الماء المقطر ؛ 1 مل من هذا المحلول يتوافق مع 0.08 ملغ من الأكسجين. تم تخزين المحلول في زجاجة زجاجية داكنة
تغطية والتحقق من كل سلسلة من الدراسات ؛
2) الحل حمض الأكساليك(0.01 ن) - لتحضيره ، يزن 0.63 جم من الحمض ويذوب في لتر واحد من الماء المقطر ؛ يتطلب 1 مل من المحلول 0.08 مجم من الأكسجين لأكسدته ؛
3) محلول حامض الكبريتيك (25٪) بكثافة 1.84 جم / سم 3 مكعب
الحجم (1: 3) في الماء المقطر.
طريقة البحث.
1) توضع عدة حبات زجاجية في دورق مخروطي سعة 250 مل ويضاف 100 مل من الماء ، ويضاف 5 مل من حامض الكبريتيك (1: 3) و 10 مل من محلول برمنجنات البوتاسيوم (0.01 نيوتن). يُسخن الخليط بسرعة حتى يغلي (خلال 5 دقائق) ويُحفظ على نار خفيفة لمدة 10 دقائق تقريبًا. بعد ذلك ، تتم إزالة القارورة (يجب أن يحتوي المحلول اللون الوردي) و 10 مل من محلول حمض الأكساليك (0.01 ن) يضاف إلى المحلول الساخن. تتم معايرة المحلول الساخن المتغير اللون (عند درجة حرارة 80 درجة مئوية) بمحلول برمنجنات البوتاسيوم (0.01 نيوتن) حتى يتم الحصول على لون وردي باهت مستقر. إذا أصبح السائل قيد التحقيق عديم اللون أو أصبح بنيًا فاتحًا أثناء الغليان ، يتم إيقاف المزيد من البحث ويتم سكب المحلول. يؤخذ جزء جديد من الماء ويخفف أولاً بالماء المقطر 2 أو 5 مرات وتكرر التحليلات ، كما هو مبين أعلاه.
2) يتم تعيين الحالة الطبيعية لمحلول برمنجنات البوتاسيوم (قيمة K) على النحو التالي. صب 100 مل من الماء المقطر في دورق بسعة 250 مل ، أضف 5 مل من حامض الكبريتيك (25٪) و 10 مل من محلول برمنجنات البوتاسيوم (0.01 نيوتن). يسخن السائل ويغلى لمدة 10 دقائق على نار خفيفة. ثم يضاف 10 مل من محلول حمض الأكساليك (0.01 نيوتن) إلى السائل الساخن ، مما يؤدي إلى تغير اللون. بعد ذلك ، بينما تكون ساخنة ، تتم معايرتها بمحلول من برمنجنات البوتاسيوم (0.01 نيوتن) حتى يتم الحصول على لون وردي شاحب.
يتم حساب عامل التصحيح (K) لعيار 0.01 N من محلول برمنجنات البوتاسيوم بالصيغة التالية:
حيث 10 هي كمية 0.01 ن محلول حمض الأكساليك ، مل ؛ ب - كمية 0.01 ن من محلول برمنجنات البوتاسيوم المضافة قبل الغليان ثم تستخدم للمعايرة ، مل.
3) يتم حساب أكسدة الماء بالصيغة التالية:
حيث X هي أكسدة الأكسجين بالملجم لكل 1 لتر من الماء ؛ أ - كمية KMPO 4 في مل ، تُسكب قبل الغليان ؛ ب هي كمية KMPO 4 المستخدمة للمعايرة بالمللي ؛ K - عامل تصحيح الوضع الطبيعي لـ KMPO 4 ؛ 10 - كمية KMPO 4 التي تنفق على أكسدة حمض الأكساليك ؛ 0.08 - كمية الأكسجين المقابلة لـ 1 مل من محلول 0.01 ن من KMnO 4 ؛ 1000 - نقل إلى 1 لتر من الماء ؛ C هو حجم الماء المأخوذ للتحليل ، مل.
ملحوظة:إذا تم تخفيف عينة ماء الاختبار بالماء المقطر ، فمن الضروري التحقق من محتوى المواد العضوية ، وعند حساب قابلية الأكسدة ، اطرح كمية KMnO 4 التي ذهبت إلى أكسدة المواد العضوية في الماء المقطر.
نظرًا لحقيقة أن بعض المركبات المعدنية (أكسيد) - الحديد ، والمنغنيز ، والنتريت ، وكبريتيد الهيدروجين - يمكن أيضًا أن تتأكسد في الماء ، مع وجود محتوى كبير منها ، فمن الضروري مراعاة التأثير على قيمة الأكسدة ( يتم إجراء التجربة بدون تدفئة).
تحديد التأكسد في بيئة قلوية (حسب شولتز).هذه الطريقة قابلة للتطبيق لتحديد قابلية أكسدة المياه الملوثة بالكلوريدات ، إلخ.
الكواشف:
1) محلول من برمنجنات البوتاسيوم (0.01 ن) - لهذا الغرض ، يتم إذابة 0.316 جم من الدواء في 1 لتر من الماء المقطر ؛
2) محلول هيدروكسيد الصوديوم بنسبة 50٪ ؛
3) محلول حمض الأكساليك (0.01 ن) - لتحضيره ، يزن 0.63 جم من الحمض ويذوب في لتر واحد من الماء المقطر ؛
4) 20٪ محلول حامض الكبريتيك.
طريقة البحث.
يُسكب 100 مل من الماء في دورق مخروطي ، ويضاف 0.5 مل من محلول هيدروكسيد الصوديوم بنسبة 50٪ و 10 مل من محلول برمنجنات البوتاسيوم (0.01 نيوتن). يسخن السائل ويغلى لمدة 10 دقائق من بداية ظهور الفقاعات الأولى ، يبرد إلى 50-60 درجة مئوية ، يضاف 5 مل من حامض الكبريتيك ، 10 مل من محلول حمض الأكساليك 0.01 ن (يجب أن يتغير لون السائل ؛ إذا لم يكن الأمر كذلك ، أضف بضع مل من الأحماض الأكساليك). ثم عاير بمحلول 0.01 نيوتن من برمنجنات البوتاسيوم حتى يظهر لون وردي باهت ، والذي لا يختفي في غضون 3-5 دقائق. يتم الحساب وفقًا لنفس الصيغة وفقًا لطريقة Kubel ، ويتم التعبير عن النتيجة بملجم أكسجين لكل لتر.
طريقة صريحة لتحديد التأكسد. صب 10 مل من الماء في أنبوب اختبار وأضف 0.5 مل من 1: 3 تخفيف 1: 3 من محلول حامض الكبريتيك و 1 مل من محلول برمنجنات البوتاسيوم 0.01 ن. يُخلط الخليط جيدًا ويترك بمفرده لمدة 20 دقيقة عند درجة حرارة 20 درجة مئوية ولمدة 40 دقيقة عند درجة حرارة 10-20 درجة مئوية بعد ذلك ، يُفحص المحلول من الجانب ومن الأعلى ويتم تحديد قابلية الأكسدة حسب اللون الذي يعتمد على اللون. لذلك ، اللون الوردي الفاتح يتوافق مع 1 ، أرجواني وردي - 2 ، وردي أرجواني ضعيف - 4 ، وردي أرجواني باهت - 6 ، وردي باهت - 8 ، وردي - أصفر - 12 ، أصفر - 16 مجم O 2 / ل وما فوق.
أمونيا النيتروجين وأملاح الأمونيوم. يتم تحديد كمية الأمونيا ونيتروجين الأمونيوم في الماء بطريقة القياس اللوني ، والتي يتمثل جوهرها في أنه عند إضافة كاشف نيسلر إلى مياه الاختبار ، يتشكل يوديد الزئبق ، الذي يلون الماء في الأصفرشدة متفاوتة حسب محتوى الأمونيا. بعد إضافة كاشف Nessler ، تتم مقارنة عينة الماء بمحلول كلوريد الأمونيوم القياسي الذي يحتوي على كمية معروفة من نيتروجين الأمونيوم. لقياس الألوان ، الماء الذي يحتوي على تركيز الأمونيا في حدود 0.1-10 ملجم / لتر مناسب.
أدوات المائدة والأواني: مقياس الألوان الكهروضوئي - FEC ، ماصات 1 و 5 مل ، قوارير 100 مل ، اسطوانة متدرجة 100 مل وأنابيب اختبار.
الكواشف:
1) كاشف نيسلر.
2) محلول معياري من كلوريد الأمونيوم ، يحتوي على نيتروجين 0.001 مجم
في 1 مل ؛
3) محلول مائي بنسبة 50٪ من ملح روشيل ؛
4) خليط قلوي يتكون من 50 جم من هيدروكسيد الصوديوم و 100 جم من ثاني أكسيد الكربون
صودا مذابة في 300 مل من الماء المقطر (يغلي المحلول المحضر لمدة 15 دقيقة ويرشح من خلال صوف الأسبستوس) ؛
5) هيدروكسيد الألومنيوم.
تحضير الماء للتحليل: تتأثر دقة تحديد محتوى الأمونيا النيتروجين وأملاح الأمونيوم في الماء بلونها وصلابتها ومحتوى الحديد والكبريتات وثاني أكسيد الكربون الحر. لإزالة لون 500 مل من الماء ، أضف 0.5 جرام من هيدروكسيد الألومنيوم واستقر المادة المترسبة لمدة ساعتين ،
يتم تحديد الكبريتيدات على النحو التالي: يضاف 1 مل من كاشف Nessler ثم 2 مل من محلول حامض الكبريتيك (1: 3) إلى 10 مل من الماء. إذا لم تختف العكارة بعد تحمض الماء ، فإنها تحتوي على كبريتيدات ، والتي يجب إزالتها بإضافة 10 قطرات من محلول 30٪ من أسيتات الزنك إلى 100 مل من الماء. بعد ذلك ، تتم تسوية الماء لمدة ساعتين ، ويتم تصريف الجزء الشفاف وأخذ عينات منه للبحث.
عندما يكون عسر الماء أكثر من 3.5 مجم / مكافئ. لتليينه ، يضاف 2 مل من الصودا الكاوية إلى 100 مل من الماء ويتم تسوية المحلول لمدة ساعتين.
مناهج البحث العلمي. يُسكب 100 مل من محلول كلوريد الأمونيوم القياسي في دورق واحد ، ويصب 100 مل من ماء الاختبار في الآخر. بعد ذلك ، يضاف 3 مل من محلول 50٪ من ملح روشيل و 2 مل من كاشف نيسلر إلى كلا القوارير. يتم اهتزاز محتويات القوارير وتركها بمفردها لمدة 10 دقائق تقريبًا حتى يظهر اللون.
يتم إجراء قياس الألوان على FEC باستخدام مرشح الضوء الأزرق (رقم 4) في فتحات بسماكة 1-5 سم. الكثافة البصريةالمحلول القياسي لمياه الاختبار بعد 10 دقائق بالضبط من إضافة كاشف نيسلر (يؤخذ تسلسل إضافة الكواشف وقياس الألوان في الاعتبار). يتم الحساب وفقًا للصيغة:
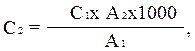
حيث C 2 هو تركيز الأمونيا ونيتروجين الأمونيوم في ماء الاختبار ، مجم / لتر ؛ C 1 - هو نفسه في محلول قياسي من كلوريد الأمونيوم ، ملغم / لتر ؛ أ 1 - الكثافة الضوئية لمحلول قياسي من كلوريد الأمونيوم (مقياس أحمر) ؛ أ 2 - الكثافة الضوئية للمياه المدروسة (على مقياس أحمر) ؛ 1000 - ينقل إلى 1 لتر.
تقدير الأمونيا بطريقة تقريبية. تصب في أنبوب اختبار
10 مل من الماء الذي تم فحصه ، أضف 0.2-0.3 مل من محلول 50٪ من روشيل
يخلط الملح جيدا ويضاف كاشف نيسلر. تعريف الأمونيا
يؤدي وفقًا للجدول 38.
نتريت النيتروجين. مبدأ الدراسة هو أن الماء الذي يحتوي على النتريت ، عند إضافة كاشف Griess ، يتحول إلى اللون الوردي. للكشف عن النتريت ، استخدم كاشف Griess - محلول ألفا نفثالامين وحمض السلفانيليك في حمض الاسيتيك. عندما يكون محتوى النتريت في الماء أكثر من 0.3 مجم / لتر ، يتحول لون الماء إلى اللون الأصفر. حد حساسية الكاشف هو 0.01 مجم / لتر من النتريت.
من الممكن حساب وتركيب نظام تنقية مياه عالي الجودة في أي مؤسسة وفي أي منشأة فقط عن طريق إجراء تحليل للمياه. اليوم هناك أكثر متغيرات مختلفةتحليلات ، لكنها لا تزال أولوية. بدون بياناتها ، من المستحيل إجراء معالجة مياه عالية الجودة. الوقت لا يقف ساكنا و الأساليب الحديثة تحليل كيميائيماءالسماح للجيل الحالي ، في ظل نفس الظروف ، بالحصول على مزيد من المعلومات.
التحليل المخبري: الآثار المترتبة على صحة الإنسان
وتجدر الإشارة إلى أن التقدم التكنولوجي لم يجلب تقنيات جديدة إلى حياة الناس فحسب ، بل جلب أيضًا المشكلات البيئية. المياه القذرةهو مصدر العدوى. ومن المستحيل الاستغناء عن طرق التنظيف ، إنه ببساطة مستحيل. يقول العلماء أنه نتيجة للمعاملة الرديئة ، فإن أكثر من 70 في المائة من المياه التي يستهلكها الناس غير حية. أي أنه لن يكون هناك بالتأكيد أي فائدة من مثل هذه المياه.
هناك معايير معينة تنطبق على جودة المياه. تم تطويرها من أجل الحصول على الأقل على مياه مقبولة للاستهلاك. ولكن ، للأسف ، معظم الموارد المائية من أنظمة مركزيةلا تفي بهذه المعايير. يحاول العلماء في جميع أنحاء العالم لفت الانتباه إلى جودة المياه ومشاكلها. و الطرق الحديثةيحتل التحليل الكيميائي للمياه في هذا الجانب مكانة كبيرة ، مما يساعد على حلها سطر كاملمشاكل.
وأول شيء يساعد في حل مثل هذا التحليل هو تقييم جودة المياه. واليوم عليك أن تفهم أنه على الرغم من إجراء تقييم جودة المياه وفقًا لنفس المعايير ، إلا أن لها خصائصها الخاصة للمياه من ، ومن ، ومن. مجموعة المعلمات متشابهة ، لكنها لا تزال مختلفة قليلاً. لذلك ، عند طلب تحليل ، يجب على المستخدم أن يشير بوضوح إلى ما يحتاج إلى تقييم بالضبط وكيف يريد أن يتم تقييم الماء من خلال التركيب الكيميائي أو البكتريولوجي.
سيكون عليك تحليل المياه في أي حال وفي أي مصدر. هذه النتائج هي ضمان السلامة للمستهلكين والمؤسسة. من الأفضل إجراء مثل هذا الإجراء في مختبرات متخصصة خاصة. يجب أن يكون لكل مختبر شهادة تأكيد. وتصدر للمؤسسات مهما كان شكل ملكيتها.
يمكن إجراء التحليلات في اتجاهين - جرثومي وكيميائي - فيزيائي. الأساليب الحديثةالتحليل الكيميائي ينتمي إلى المجموعة الثانية. هنا ، يتم عرض كل من معلمات الصلابة والعكارة ، يتم عرض جميع أنواع الروائح ، ويتم فحص الشوائب العضوية وغير العضوية في الماء.
من الممكن الاستغناء عن التحليل البكتيريولوجي فقط في حالة تقييم ماء الصنبور ، باستخدام إمدادات المياه المركزية. كقاعدة عامة ، تم بالفعل تطهير هذه المياه. في جميع الحالات الأخرى ، يجب أن يتم التقييم في المجمع.
يتطلب تصميم معالجة المياه لأي غرض تقييم حالة الموارد المائية في أي حال. لا يوجد تحليل - لا توجد معدات عالية الجودة لتنقية المياه.
لكي يسير كل شيء على ما يرام ، يمكنك ، وفقًا للقواعد ، إجراء اختيار الماء بنفسك. ولكن لضمان عدم وجود أخطاء في التقدير ، من الأفضل الاتصال بأخصائي في المنزل أو في مؤسسة.
أصبح تقييم المياه جزءًا من حياة الإنسان اليوم. وكلاهما في العمل والمنزل. إذا أراد مستخدم الموارد المائية ضمان صحته ، فإن الرابط الصحيح لا غنى عنه - تقييم المياه + النظام الصحيحطهارة.
من المهم بنفس القدر الإجابة على السؤال - كم مرة يتم تحليل المياه؟ ليس سراً أن تكوين الماء يتغير بمرور الوقت. وماذا يفعل صاحب البيت الخاص؟ كيف وبأي ترتيب ينبغي إجراء الاختبارات؟ ما للاستيلاء على؟
رحلة صغيرة للمبتدئين. أولئك الذين جهزوا للتو بئرًا في موقعهم ، في بدون فشلإجراء تحليل كيميائي كامل للماء مرتين. قبل وبعد التثبيت. المرة الأولى واضحة. يتم تنفيذ الثانية من أجل تقييم صحة نظام التنقية المترجم. يوفر فرصة لتصحيح الأخطاء.
في المستقبل ، عندما يتم تشغيل البئر ، في السنة الأولى - يتم تحليلها مرة واحدة كل ثلاثة أشهر ، ثم يمكن إجراؤها مرة كل 12 شهرًا. ربما يبدو هذا العدد من التحليلات زائدة عن الحاجة لشخص ما ، ولكن يجب دائمًا تذكر ميزتين:
- يجب على أولئك الذين حفروا بمفردهم أن يفهموا أن السيطرة على حالة المياه تقع بالكامل على أكتافهم ، وبالتالي سيتعين عليهم التحكم فيها بأنفسهم وطوال حياتهم ؛
- عند العمل بالبئر الخاص بك ، يمكن أن يحدث أي شيء ، وقد لا يعرف صاحب المنزل أن هناك مادة كيميائية في مكان قريب. مصنع صغير ، وفي ذلك اليوم حرفيًا ، اندلع أنبوب به نفايات هناك. في الوقت نفسه ، لم تصبح حالة المياه خطيرة فحسب ، بل أصبحت حرجة ، تمامًا مثلما حدث عندما لم يلاحظوا طبقة المياه الجوفية ، ونفايات من بالوعةالقرية بأكملها ، وقد تتضح هذه الحقيقة بعد نصف عام من التشغيل.
بأي حال من الأحوال ، فإن إجراء التحليل الكيميائي في البداية ليس عملاً بلا هدف على الإطلاق. علاوة على ذلك ، من الممكن اليوم استخدام أكثر الطرق فعالية وحداثة في التحليل الكيميائي للمياه.
الخيارات الحديثة لأبحاث المياه
يوجد اليوم عدة خيارات لدراسة المياه ، معظمها مادة كيميائية. والشيء السيئ هو أن ليس كل المختبرات تقوم بمثل هذه الاختبارات. بعض الأساليب جديدة وتقدمية بحيث لا يمكن إجراؤها إلا في الخارج. يوجد أدناه جدول بأساليب التحليل الحديثة نفسها. الأكثر تميزًا في الوقت الحالي هي التحليلات الطيفية للكتلة اللونية ، التنشيط الضوئي والنيوتروني. يتم إجراء هذا الأخير بشكل عام على المستوى النيوتروني ، تحت المجهر بدقة عالية جدًا.
|
نوع التحليل |
المنهجية |
|
بالصوت |
|
|
الكهروكيميائية |
مقياس فرق الجهد علم الاستقطاب |
|
صور- ، طيفية الانارة |
|
|
صور + كيمياء |
الضوئية |
|
اللوني |
أعمدة سائلة سائلة عالية الكفاءة |
من أجل إجراء التحليل الصحيح ، من الضروري اختيار الماء بشكل صحيح. للقيام بذلك ، يمكنك أن تأخذ زجاجة عادية من الماء العادي ، وليس الغازي أو الحلو. يتم تصريف الماء من الصنبور لمدة 15 دقيقة على الأقل. ثم يتم غسل الزجاجة (بدون وظائف) ، ويتم كتابتها تحت العنق. صب في مجرى رفيع على طول جانب الزجاجة. من الأفضل أخذه إلى المختبر على الفور. يمكنك الاحتفاظ بها في الثلاجة لمدة أقصاها 24 ساعة.
إحدى طرق التحليل الحديثة هي التقييم الكيميائي للمياه وفقًا لقائمة موسعة. تستخدم هذه الطريقة عند تقييم الآبار أو الآبار الضحلة. نظرًا لعمقها الصغير ، فهناك خطر تلوث المياه بجميع أنواع الشوائب الضارة. لذلك ، يجب فحص هذه المياه مع مراعاة المعايير التالية:
- المواد العضوية - بالإضافة إلى الأملاح المعدنية القياسية ، سيشمل ذلك كلوريد الفينيل ، ورابع كلوريد الكربون ، والأكريلاميد ، وما إلى ذلك ؛
- المواد غير العضوية - لا يتم فحص وجود الشوائب الصلبة فحسب ، بل أيضًا أملاح النيكل والرصاص والزنك وما إلى ذلك ؛
- الشوائب الميكروبيولوجية - هنا يقومون بفحص الإشريكية القولونية ، لامبيا ، بشكل عام ، نطاق أوسع قليلاً البكتيريا الضارةمن التحليل البكتريولوجي التقليدي ؛
- نظرًا لاستخراج المياه من أعماق ضحلة ، فهناك مخاطر كبيرة و عدد كبير، شوائب مبيدات الآفات ، لذلك يتم الكشف عنها - ميثوكسيكلور ، توكسافول ، إندرين ، إلخ ؛
- شوائب النويدات المشعة ومبيدات الأعشاب ، والسبب هو نفسه - يتم تحديد محتوى بنكلوروفينول ، أتراسين ، ويتم تحديد عدد الجسيمات المشحونة والراديوم.
طقم الاختبار
يمكن الاستشهاد بمجموعة الاختبار كمثال على طريقة حديثة للتحليل الكيميائي للماء. هذه طريقة مريحة للغاية تسمح لك بتقييم موارد المياه بسرعة ، تقريبًا في هذا المجال.

تحتوي مجموعة الاختبار هذه على مجموعة كاملة مستهلك 100 نوع من التحليلات. وكل شيء يتم بسرعة وبساطة. وجميع التحليلات تلبي متطلبات أساليب التحليل. تعتبر مجموعات الاختبار هذه جيدة لأنها تسمح لك بفحص الماء بسرعة من أجل التركيب ، مرة واحدة كل ثلاثة أشهر. أي لمراقبة حالة الماء ، فإن هذه المجموعة هي الأفضل. علاوة على ذلك ، سوف يتلقى المثمن نتائج الاختيار هناك على الفور ، دون رحلات إلى المختبر والتوقعات.
هذه الطريقة تجعل من الممكن تقييم كليهما المياه التقنية. يتوافق خطأ المؤشرات مع الأبحاث المختبرية. يتقلب بين 25-30 في المئة. ولكن بالنسبة للسرعة ، فهذه رسوم مقبولة تمامًا ، وسيساعد الاتصال بأخصائي بهذه المجموعة في تقييم حالة المياه حتى في المناطق النائية والتي يصعب الوصول إليها ، وهو أمر مهم.
يتم إنتاج هذه المجموعات بمبلغ 12 مجموعة لكل 100 اختبار. أي أنها اقتصادية أيضًا.
لطالما كان تقييم المياه ولا يزال المكون الرئيسي لأي نظام معالجة. هل ستكون مؤسسة صناعية قوية أم صغيرة منزل خاص. لكن الاستغناء عن نتائج وجود شوائب مختلفة في الماء لن ينجح. لا يمكنك إنفاق الأموال على أجهزة خطيرة مثل عمال النظافة بشكل عشوائي. فقط خطة واضحة وتقييم. هذا هو السبب في أنه من المستحيل التقليل من أهمية الطرق الكيميائية للتحليل اليوم. بدونها ، لا يمكن لأكثر من مستهلك رؤية معالجة المياه عالية الجودة.
مقدمة
يتم تحديد أهمية الموضوع من خلال حقيقة أنه من المهم معرفة المعنى يشرب الماءوخصائصه. يعد الماء أحد أكثر المواد شيوعًا في الطبيعة (يحتل الغلاف المائي 71٪ من سطح الأرض). الماء ملك الدور الأساسيفي الجيولوجيا ، تاريخ الكوكب. لا يمكن أن توجد الكائنات الحية بدون الماء.
وفقًا لخصائص المنشأ أو التكوين أو التطبيق ، هناك:
الماء العذب و الماء العسر، مياه عذبة، مياه الأمطارذوبان الماء المياه الجوفيةوالمياه المعدنية والمياه المقطرة ومياه الصرف الصحي ومياه الشرب.
من بين المؤشرات الرئيسية لنوعية مياه الشرب:
يُطلق على المياه التي لا تضر بصحة الإنسان والتي تلبي متطلبات معايير الجودة الحالية مياه الشرب ، إذا لزم الأمر ، حتى تتوافق المياه مع المعايير الصحية والوبائية ، يتم فحصها وتنقيتها أو ، من الناحية الرسمية ، "معدة" باستخدام محطات معالجة المياه.
مياه الصرف الصحي - أي ماء و تساقط، حولت إلى المسطحات المائية من المناطق المؤسسات الصناعيةو مناطق مأهولة بالسكانمن خلال نظام الصرف الصحي أو عن طريق الجاذبية التي تدهورت خصائصها نتيجة النشاط البشري.
يمكن تصنيف مياه الصرف الصحي وفقًا لـ العلامات التالية:
إنتاج
الصرف الصحي السطحي
معظم الناس والحيوانات والنباتات هم من الماء ، بما في ذلك البشر: الماء يشكل 70٪ من وزن الجسم. ربما ، في انتشار الماء ، في حقيقة أن كل شيء "يتخللها الماء ويعانقها" ، وأهمها خاصية فريدة.
ثاني أهم خاصية هي قدرة الماء على إذابة المواد. الماء مذيب عالمي. نتيجة لهذا ، لا يقتصر تكوينه على الصيغة H 2 O.
الخاصية الفريدة الثالثة للماء هي أنه موجود على الأرض في وقت واحد في ثلاث حالات أو ، باستخدام المصطلحات الفيزيائية ، في ثلاث مراحل - غازية ، سائلة وصلبة ، أي في شكل بخار ماء ، في الواقع ماء سائل وثلج. لا تحاول العثور على مادة أخرى لها نفس الخاصية! خذ على سبيل المثال غاز الأكسجين - يتحول إلى سائل عند درجة حرارة -183 درجة مئوية ، وإلى مرحلة صلبة عند -218 درجة مئوية. حديد، معدن صلب، يصبح سائلاً (يذوب) عند +1539 درجة مئوية ، ويمر في حالة بخار عند درجة حرارة عالية تصل إلى +3200 درجة مئوية.
مياه ينابيع كثيرة مياه عذبةغير مناسب لشرب الإنسان لأنه يمكن أن ينشر المرض أو يسبب مشاكل صحية طويلة الأمد إذا لم يستوف معايير معينة لجودة المياه:
يُطلق على المياه التي لا تضر بصحة الإنسان والتي تلبي متطلبات معايير الجودة الحالية مياه الشرب ، إذا لزم الأمر ، حتى تتوافق المياه مع المعايير الصحية والوبائية ، يتم فحصها وتنقيتها أو ، من الناحية الرسمية ، "معدة" باستخدام محطات معالجة المياه. من المهم معرفة تعريف عكارة المياه ، لأن صحة الناس تعتمد عليها.
العكارة مؤشر الماءتميز انخفاض شفافية المياه بسبب وجود معلقات دقيقة غير عضوية وعضوية ، وكذلك تطور الكائنات العوالق. سأخبرك قليلاً عن مصنع Starooskol الميكانيكي.
ستاروسكولسكي مصنع ميكانيكيهي المنتج الرئيسي للصلب والحديد بالرصاص في البلاد. كما أنها تصنع معدات التعدين ومعدات الحفر ، ومنشآت التهوية والاستحمام لإنتاج المعادن الساخنة ؛ سلع الاستهلاك الشائع.
لتصنيع المنتجات ، النطاق الحالي ، يستخدم المصنع العمليات التكنولوجية التي تجعل من الممكن إنتاج جميع الأنواع الرئيسية لإعادة التوزيع المستخدمة في الصناعة الهندسية. يتم إجراء التحكم التحليلي لجميع عمليات الإنتاج في المصنع. تشمل مراقبة الإنتاج التحليلية الاستخدام العملينظرية وطرق الكيمياء التحليلية لتحديد تكوين كائنات معينة من أي إنتاج.
يتم استخدام مراقبة الإنتاج للتحقق من جودة المنتجات والتقدم المحرز العملية التكنولوجية، لمنع الزواج وتأمينه
التي وضعتها القواعد و تحديدجودة المنتجات المصنعة.
تشمل مؤشرات الجودة المؤشرات التالية: الغرض من البضاعة ، وموثوقية البضائع ، ومدى ملاءمة البضائع للبيئة ، ومؤشرات التوافق البيئي للبضائع ، والمؤشرات المريحة ، ومؤشرات بيئة العمل ، ومؤشرات قابلية تصنيع البضائع وجماليات البضائع. (انظر الملحق 3)
بالإضافة إلى التحكم في الإنتاج ، تتم مراقبة تكوين مياه الشرب والشرب باستمرار في المصنع. مياه الصرف الصحيطرق كيميائية وكيميائية فيزيائية مختلفة.
الغرض من عمل المقرر: دراسة نوعية مياه الشرب حسب مقياس التعكر وتقدير العكارة.
 المحتوى
المحتوى
1- مقدمة ………………………………………………………………………………… ... 5
2. الجزء الرئيسي …………………………………………………………………… ... 9
2.1 جوهر طرق التحليل الفيزيائية والكيميائية .................. .......... 9
2.2 تحديد مقياس ضوئي لعكارة مياه الشرب بطريقة قياس التعكر وفقًا للمواصفة GOST 3351-74 ............................................ 12
2.3 الكواشف. المواد. المعدات ………………………… ... 19
2.4 تحليل ……………………………………………………… .. 21
2.5 معالجة النتائج …………………………………………… .......... 23
2.6 استنتاج …………………………………………………………………………… .24
3-الاستنتاج ................................................................................................................................................... 26
4. الأدب ………………………………………………………………………………… .28
5. التطبيق
2. الجزء الرئيسي
جوهر طرق التحليل الفيزيائية والكيميائية
تحليل الطرق الفيزيائية والكيميائية (PCMA)، تعتمد على اعتماد الخصائص الفيزيائية لمادة ما على طبيعتها ، والإشارة التحليلية هي الكمية خاصية فيزيائية، مرتبطة وظيفيًا بتركيز أو كتلة المكون المحدد.
قد تشمل طرق التحليل الفيزيائية والكيميائية (PCMA) التحويل الكيميائي للتحليل ، وانحلال العينة ، وتركيز المادة التحليلية ، وإخفاء المواد المتداخلة ، وغيرها.
على عكس الطرق الكيميائية "الكلاسيكية" للتحليل ، حيث تُستخدم كتلة المادة أو حجمها كإشارة تحليلية ، في الطرق الفيزيائية والكيميائية للتحليل ، تُستخدم كثافة الإشعاع وقوة التيار والتوصيل الكهربائي وفرق الجهد وما إلى ذلك كتحليل الإشارة.
الأهمية قيمة عمليةلها طرق تعتمد على دراسة الانبعاث والامتصاص الاشعاع الكهرومغناطيسيفي مجالات متنوعةنطاق.
وتشمل هذه التحليل الطيفي (على سبيل المثال ، تحليل الانارة والتحليل الطيفي وقياس الكلى وقياس التعكر وغيرها). تشمل طرق التحليل الفيزيائية والكيميائية الهامة: الطرق الكهروكيميائية باستخدام القياس الخواص الكهربائيةالمواد ، وقياس الألوان ، وقياس الجهد ، وما إلى ذلك) ، وكذلك اللوني (على سبيل المثال ، كروماتوغرافيا الغاز ، الكروماتوغرافيا السائلة ، التبادل الأيوني ، اللوني ، كروماتوغرافيا الطبقة الرقيقة).
 تم تطوير طرق تعتمد على قياس السرعات بنجاح تفاعلات كيميائية(طرق التحليل الحركية) ، التأثيرات الحرارية للتفاعلات (المعايرة الحرارية) ، وكذلك على فصل الأيونات في المجال المغناطيسي (قياس الطيف الكتلي).
تم تطوير طرق تعتمد على قياس السرعات بنجاح تفاعلات كيميائية(طرق التحليل الحركية) ، التأثيرات الحرارية للتفاعلات (المعايرة الحرارية) ، وكذلك على فصل الأيونات في المجال المغناطيسي (قياس الطيف الكتلي).
عند إجراء طرق التحليل الفيزيائية والكيميائية ، يتم استخدام معدات قياس خاصة ، وأحيانًا معقدة للغاية ، وبالتالي غالبًا ما تسمى هذه الطرق بوسائل. كثير الأجهزة الحديثةمجهزة بأجهزة كمبيوتر مدمجة تسمح لك بالعثور عليها الظروف المثلىالتحليل (على سبيل المثال ، المنطقة الطيفية للحصول على أكثر النتائج دقة عند تحليل خليط من المواد الملونة) ، أقوم بإجراء. في جميع طرق التحليل الفيزيائية والكيميائية تقريبًا ، يتم استخدام طريقتين رئيسيتين: طرق القياس المباشر والمعايرة.
تستخدم الطرق المباشرة اعتماد الإشارة التحليلية على طبيعة المادة التحليلية وتركيزها. اعتماد الإشارة على طبيعة المادة - الأساس التحليل النوعي(جهد نصف الموجة في الاستقطاب ، إلخ). في بعض الطرق ، يتم تأسيس العلاقة بين الإشارة التحليلية وطبيعة المادة بشكل صارم من الناحية النظرية. على سبيل المثال ، يمكن حساب طيف ذرة الهيدروجين باستخدام الصيغ المشتقة نظريًا. في التحليل الكمي ، يتم استخدام اعتماد شدة الإشارة على تركيز مادة ما.
يتم تحديد القيم العددية للثوابت في معادلة الاقتران بشكل تجريبي باستخدام العينات القياسية والحلول القياسية وما إلى ذلك. فقط في قياس الكولوم استنادًا إلى قانون فاراداي ، لا يلزم تعريف الثوابت.
الأكثر انتشارًا في الممارسة هي الطرق التالية لتحديد ثوابت معادلة الاتصال أو ، ما هو نفسه ، طرق الكميات ، والتحليل باستخدام القياسات الفيزيائية والكيميائية:
1) طريقة منحنى المعايرة. يتم قياس شدة الإشارة التحليلية للعديد من العينات القياسية أو الحلول القياسية ويتم رسم رسم بياني للمعايرة في الإحداثيات I = f (c) أو I = f (lgc) ، حيث C هو تركيز المكون في الحل القياسي أو عينة قياسية. في ظل نفس الظروف ، يتم قياس شدة إشارة العينة التي تم تحليلها ويتم العثور على التركيز من منحنى المعايرة.
2) يتم استخدام طريقة الخاصية المولية في الحالات التي يتم فيها ملاحظة معادلة العلاقة I = bc بشكل صارم. قم بقياس الإشارة التحليلية من عدة عينات أو حلول قياسية واحسب b = I st / s st ؛ إذا تم قياس c st بالمول / لتر ، فإن b هي خاصية مولارية.
3) طريقة الإضافات. قم بقياس شدة الإشارة التحليلية للعينة I x ، ثم شدة إشارة العينة بإضافة معروفة للحل القياسي I x + stt.
4) طرق المعايرة. قم بقياس شدة الإشارة التحليلية I اعتمادًا على الحجم V للمعاير المضاف. وفقًا لمنحنى المعايرة I = f (V) ، تم العثور على نقطة التكافؤ ويتم حساب النتيجة باستخدام الصيغ المعتادة لتحليل المعايرة.
غالبًا ما تُستخدم طرق التحليل الفيزيائية والكيميائية لتحديد المحتويات المنخفضة (بترتيب 10 -3٪ أو أقل) ، حيث تكون طرق التحليل الكيميائية التقليدية غير قابلة للتطبيق عادةً.
في مجال التركيزات المتوسطة والعالية ، تتنافس طرق التحليل الكيميائية والفيزيائية الكيميائية بنجاح مع بعضها البعض ، ويكمل بعضها بعضًا. تتطور طرق التحليل الفيزيائية والكيميائية في اتجاه البحث عن خصائص تحليلية كيميائية جديدة لمادة ما ، وزيادة دقة التحليل ، وتصميم أدوات تحليل دقيقة جديدة ، وتحسين الأساليب الحالية وأتمتة التحليل.
تستخدم طريقة قياس التعكر على نطاق واسع لتحديد التعكر في مياه الشرب.
 2.2 تحديد مقياس ضوئي لعكارة مياه الشرب بطريقة قياس التعكر
2.2 تحديد مقياس ضوئي لعكارة مياه الشرب بطريقة قياس التعكر
يتم استخدام طريقة قياس التعكر لتحليل المعلقات والمستحلبات والمعلقات المختلفة والوسائط العكرة الأخرى. تنخفض شدة شعاع الضوء الذي يمر عبر هذا الوسط بسبب تشتت الضوء وامتصاصه بواسطة الجسيمات المعلقة.
تعتمد طرق قياس التعكر على قياس شدة الضوء الذي يمر عبر التعليق الذي تم تحليله.
الميزة الرئيسية لطريقة قياس التعكر هي حساسيتها العالية ، والتي تعتبر ذات قيمة خاصة فيما يتعلق بالعناصر أو الأيونات التي لا توجد لها تفاعلات لونية.
هذا النوعتعتمد دراسة الوسائط العكرة على قياس التغير في شدة تدفق الطاقة الضوئية الذي يمر عبر نظام مشتت. التغيير في تدفق الطاقة الضوئية ناتج عن كل من الامتصاص والتشتت بواسطة نظام مشتت. تشبه هذه الطريقة طريقة القياس اللوني ، ولكن في بعض الحالات يمكن أن يتم القياس في تيار "الضوء الأبيض" بدون استخدام المرشحات.
فيما يتعلق بحساسية الطريقة ، تفضل المقارنة بين قياس الكلى وقياس التعكر قياس الكلى ، لأن هذه الطريقة تكون أكثر حساسية عندما تؤدي كمية صغيرة من الجسيمات المعلقة إلى زيادة ملحوظة في الإشارة مع خلفية قليلة.
تم تقليل تأثير الانتثار في الخلفية في عدد من الأدوات من خلال القضاء على قياسات التشتت بزاوية 90 درجة وطرح إشارات الخلفية إلكترونيًا (قياس سرعة الكلية).
 تتمثل ميزة تحليل العكر في أنه يمكن إجراء القياسات على أي مقياس ألوان أو مقياس ضوئي تقريبًا. يمكن تحقيق زيادة حساسية دراسات قياس التعكر باستخدام مقاييس الطيف الضوئي ذات أجهزة الكشف عالية الجودة.
تتمثل ميزة تحليل العكر في أنه يمكن إجراء القياسات على أي مقياس ألوان أو مقياس ضوئي تقريبًا. يمكن تحقيق زيادة حساسية دراسات قياس التعكر باستخدام مقاييس الطيف الضوئي ذات أجهزة الكشف عالية الجودة.
يوضح الشكل اتجاهات تدفق الطاقة الضوئية ، موضحًا مبادئ دراسات قياس التعكر.
تُستخدم مصابيح القوس الزئبقي ومصابيح التنغستن واليود وليزر الهيليوم والنيون بشكل شائع كمصادر للضوء. يصدر الليزر ضوءًا أحادي اللون يتركز في حزمة ضيقة ومكثفة. ومع ذلك ، فإن الليزر غالي الثمن ويمكن أن يصدر مجموعة محدودة من الأطوال الموجية الثابتة.
يتم إجراء القياسات باستخدام مقاييس ضوئية كهروضوئية ، وتقنية القياس مماثلة لتلك الخاصة بالقياس الضوئي. تُستخدم طريقة منحنى المعايرة لإيجاد التركيز.
ميزة طرق قياس العكر وطرق قياس النوى
هي حساسيتها العالية ، وهي ذات قيمة خاصة في حالة تحديد العناصر التي لا تظهر تفاعلات لونية. ومع ذلك ، فإن خطأ القياس في طرق قياس التعكر أكبر إلى حد ما مما هو عليه في طرق القياس الضوئي ، والذي يرتبط بصعوبات في الحصول على معلقات بنفس أحجام الجسيمات ، والاستقرار بمرور الوقت ، وما إلى ذلك. محاليل تحتوي على كبريتات عند إضافة كلوريد الباريوم.
تقاس الكثافة الضوئية للحلول عند 315 نانومتر. التبعية الخطيةلوحظت الكثافة الضوئية لتركيز الكبريتات في حدود 0-50 مجم / دسم 3
تترسب أيونات الكبريتات على شكل كبريتات الباريوم في بيئة هيدروكلورية. لتثبيت معلق BaSO 4 ، يتم إدخال الجلسرين أو الإيثيلين جلايكول في خليط التفاعل ، ولتقليل قابلية ذوبان كبريتات الباريوم - الإيثانول.
يتم إعاقة التحديد من خلال المواد المعلقة والملونة والبراق ، وكذلك حمض السيليك بتركيز يزيد عن 200 مجم / دسمسيتر ، وهو أمر غير محتمل بالنسبة للمياه ذات المحتوى المنخفض من الكبريتات.
يتم التخلص من تأثير التداخل للمواد المعلقة والغروانية عن طريق الترشيح الأولي للعينة من خلال مرشح غشائي بقطر مسام يبلغ 0.45 ميكرومتر. يؤخذ تأثير المواد البراقة واللون المنخفض في الاعتبار عن طريق قياس الكثافة البصرية الجوهرية للعينة ،
حامض. يتم التخلص من تأثير اللون العالي بسبب وجود المواد الدبالية عن طريق معالجة العينة بالكربون النشط.
يتم التخلص من إمكانية ترسيب الأنيونات الأخرى (كربونات ، فوسفات ، كبريتات) بواسطة كلوريد الباريوم أثناء التحليل عن طريق تحميض العينة.
قم بقياس شدة الضوء المتناثر (مقياس نيفيلومتري
متغير) ، أو ضوء يمر عبر وسط عكر (متغير عكر). يتم تحديد محتوى أيونات الكبريتات بواسطة طريقة منحنى المعايرة.
لتحضير محلول قياسي ، تحتاج إلى ما يلي: محلول حمض الهيدروكلوريك (1: 1). يخلط حمض الهيدروكلوريك المركز 50 سم 3 مع 50 سم 3 ماء مقطر. الحل مستقر.
محلول كلوريد الباريوم 5٪. يتم إذابة 6.2 جم من كلوريد الباريوم BaCI 2 .2H 2 O في 100 سم 3 من الماء المقطر.
محلول مترسب. يتم خلط 50 سم 3 من محلول كلوريد الباريوم 5٪ مع 150 سم 3 من الجلسرين أو الإيثيلين جلايكول و 150 سم 3 من كحول الإيثيل في دورق مخروطي بحجم 500 سم 3. يتم ضبط قيمة الرقم الهيدروجيني للمحلول إلى 3 تقريبًا بمحلول حمض الهيدروكلوريك 1: 1 ويترك لمدة يوم أو يومين في مكان مظلم ، مع تغطية القارورة بزجاج ساعة. بعد الاستقرار ، يسكب المحلول المترسب في دورق مظلم بسدادة أرضية. إذا تشكلت المادة المترسبة في قاع القارورة أثناء الترسيب ، فيجب أن يتم نقل الكاشف إلى القارورة بعناية بحيث تظل المادة المترسبة في القارورة. محلول الترسيب مناسب لمدة لا تزيد عن 3 أشهر.
لإنشاء رسم بياني للمعايرة ، يتم إدخال 0 في قوارير حجمية بسعة 50 سم 3 باستخدام ماصات متدرجة بسعة 1 و 5 و 10 سم 3 ؛ 0.6 ، 1.0 ؛ 20 ؛ 3.0 ؛ 4 ^ 0 ؛ 6.0 ؛ 8.0 ؛ 10.0 سم 3 من محلول كبريتات البوتاسيوم بتركيز كتلة أيونات الكبريتات 0.250 مجم / سم 3. يتم ضبط أحجام المحاليل على العلامات الموجودة على القوارير بالماء المقطر المختلط. احسب التركيزات الناتجة. يتم وضع 5 سم من كل من المحاليل المحضرة في قوارير مخروطية بسعة 50 سم 3 ويتم إضافة قطرة واحدة من محلول حمض الهيدروكلوريك 1: 1. مع التقليب المستمر ، صب 5 سم 3 من محلول الترسيب في كل دورق واستمر في تقليب المحتويات لمدة 10-15 ثانية أخرى. بعد 40 ± 5 دقائق ، يتم قياس امتصاص المحاليل في كفيت 2 سم ويتم طرح امتصاص الفراغ من امتصاص المحاليل المحتوية على الكبريتات.
تم بناء اعتماد المعايرة في الإحداثيات: الكثافة الضوئية - تركيز أيونات الكبريتات بالملجم / DM 3 وتحسب بطريقة المربعات الصغرى.
لتقدير أيونات الكبريتات. خذ 5.0 مل من الماء الذي تم تحليله في دورق مخروطي جاف
بسعة 50 مل 3 او انبوب اختبار بسدادة ارضية بسعة 10-
15 سم ، أضف قطرة واحدة من حمض الهيدروكلوريك 1: 1 واخلط.
بعد 1-2 دقيقة ، مع التقليب المستمر ، صب 5 سم 3 من محلول الترسيب في القارورة واستمر في تقليب المحتويات لمدة 10-15 ثانية أخرى. بعد 40 جم 5 دقائق ، يتم قياس الكثافة الضوئية للعينة عند 315 نانومتر في كفيت بطول 2 سم بالنسبة إلى الماء المقطر. في نفس الوقت ، يتم تحليل عينة فارغة باستخدام 5 مل من الماء المقطر.
للحساب ، يتم حساب قيمة الكثافة الضوئية Dx ، المقابلة لتركيز الكبريتات في العينة الأولية وفقًا للصيغة:
أ \ u003d أ - Ai -A 2 ،
أين
أ - قيمة الكثافة البصرية للعينة التي تم الحصول عليها أثناء التحديد ؛
Ai هي قيمة الكثافة البصرية الجوهرية للعينة ؛
أ 2 - قيمة الكثافة البصرية لعينة فارغة.
وفقًا لاعتماد المعايرة ، تم العثور على تركيز كتلة الكبريتات في عينة الماء التي تم تحليلها ، بما يتوافق مع القيمة التي تم الحصول عليها للكثافة البصرية أ.
لتحديد أيونات الكبريتات ، يلزم استخدام الكواشف التالية: محلول حمض الهيدروكلوريك (1: 1) ، يتم خلط 50 سم 3 من حمض الهيدروكلوريك المركز مع 50 سم 3 من الماء المقطر. الحل مستقر. محلول كلوريد الباريوم ، 5٪ 6.2 جم من كلوريد الباريوم BaCI 2 .2H 2 O مذاب في 100 سم 3 من الماء المقطر. محلول الترسيب: يتم خلط 50 سم 3 من محلول كلوريد الباريوم بنسبة 5٪ مع 150 سم 3 من الجلسرين أو الإيثيلين جلايكول و 150 سم 3 من كحول الإيثيل في دورق مخروطي بحجم 500 سم 3. يتم ضبط قيمة الرقم الهيدروجيني للمحلول إلى 3 تقريبًا بمحلول حمض الهيدروكلوريك 1: 1 ويترك لمدة 1-2 أيام في مكان مظلم ، مع تغطية القارورة بزجاج ساعة.
بعد الاستقرار ، يسكب المحلول المترسب في دورق مظلم بسدادة أرضية.
إذا تشكلت المادة المترسبة في قاع القارورة أثناء الترسيب ، فيجب أن يتم نقل الكاشف إلى القارورة بعناية بحيث تظل المادة المترسبة في القارورة. يكون محلول الترسيب مناسبًا لمدة لا تزيد عن 3 أشهر ، ولإنشاء مخطط معايرة ، يتم إدخال 0 في قوارير حجمية بسعة 50 سم 3 باستخدام ماصات مدرجة بسعة 1 و 5 و 10 سم 3 ؛ 0.6 ، 1.0 ؛ 20 ؛ 3.0 ؛ 4 ^ 0 ؛ 6.0 ؛ 8.0 ؛ 10.0 سم 3 من محلول كبريتات البوتاسيوم بتركيز كتلة أيونات الكبريتات 0.250 مجم / سم 3. يتم ضبط أحجام المحاليل على العلامات الموجودة على القوارير بالماء المقطر المختلط. احسب التركيزات الناتجة. يتم وضع 5 سم من كل من المحاليل المحضرة في قوارير مخروطية بسعة 50 سم 3 ويتم إضافة قطرة واحدة من محلول حمض الهيدروكلوريك 1: 1. مع التقليب المستمر ، صب 5 سم 3 من محلول الترسيب في كل دورق واستمر في تقليب المحتويات لمدة 10-15 ثانية أخرى. بعد 40 ± 5 دقائق ، تُقاس الكثافة الضوئية للحلول في كفيت بطول 2 سم.
تُطرح الكثافة الضوئية للتجربة الفارغة من الكثافة الضوئية للمحاليل المحتوية على كبريتات.
يعتمد تحديد مقياس التعكر على الكالسيوم على ترسيب الكالسيوم على شكل أكسالات وقياس شدة الضوء المنقول عبر محلول يحتوي على معلق CaC 2 O 4. يزيد وجود الإيثانول من حساسية الطريقة.
الكواشف التالية مطلوبة لتحديد الكالسيوم: كربونات الكالسيوم CaCO 3 (c) ، مجففة عند 110 درجة مئوية ، أكسالات الأمونيوم (NH 4) 2 C 2 O 4 H 2 O ، 0.25 M محلول ، حامض الهيدروكلوريكحل HC1 ، 2M.
لتحضير محلول معياري من الكالسيوم ، يتم حساب جزء من كربونات الكالسيوم 3 ، وهو أمر ضروري لتحضير 100 مل من المحلول القياسي الأولي مع عيار الكالسيوم T Ca = 1 10 ~ 3 جم / مل.
 يتم وزن عينة من CaCO 3 قريبة من العينة المحسوبة على ميزان تحليلي في دورق بسعة 50 مل ويتم إذابته بعناية في 10 مل من محلول HC1 ، مع إضافة الحمض تدريجياً ، في أجزاء صغيرة. انقل المحلول الناتج كميًا إلى دورق حجمي سعة 100 مل وخفف بالماء حتى العلامة.
يتم وزن عينة من CaCO 3 قريبة من العينة المحسوبة على ميزان تحليلي في دورق بسعة 50 مل ويتم إذابته بعناية في 10 مل من محلول HC1 ، مع إضافة الحمض تدريجياً ، في أجزاء صغيرة. انقل المحلول الناتج كميًا إلى دورق حجمي سعة 100 مل وخفف بالماء حتى العلامة.
يتم تحضير محلول معياري مخفف من الكالسيوم مع عيار الكالسيوم T Ca = 1 10 ~ 4 جم / مل (محلول 2) عن طريق تخفيف المحلول الأولي بالماء 10 مرات. ماصة مختلفة (من 1 إلى 10 مل) أحجام مختلفة من معيار مخفف يضاف محلول ملح الكالسيوم (المحلول 2) ويتم وضع محتويات القوارير على العلامة بالماء. (يوصى بإعداد الحلول على فترات 5 دقائق.
لزيادة حساسية التحديد ، يمكن إضافة 5-10 مل من الكحول الإيثيلي لكل دورق.)
يتم خلط المحاليل ، ويتم سكبها بالتناوب في كفيت جهاز بصري (I = 3 سم عند العمل على مقياس الألوان الكهروضوئي) ، وبعد 5 دقائق من التحضير ، يتم قياس الكثافة الضوئية بالنسبة إلى الماء باستخدام مرشح الضوء الأخضر. بناءً على البيانات التي تم الحصول عليها ، تم إنشاء رسم بياني للمعايرة في إحداثيات كثافة تركيز الكالسيوم.
لتحديد الكالسيوم ، يوضع محلول الاختبار في دورق حجمي سعة 100 مل ، ويخفف بالماء حتى العلامة ويخلط جيدًا. ماصة 10 مل من المحلول الناتج في دورق حجمي بسعة 50 مل.
أضف 10 مل من محلول أكسالات الأمونيوم ، كحول الإيثيل (إذا تمت إضافته عند إنشاء الرسم البياني للمعايرة) من السحاحة وإحضار المحلول إلى العلامة بالماء. بعد 5 دقائق من التحضير ، تقاس الكثافة الضوئية ويوجد تركيز الكالسيوم من الرسم البياني.
حل التحقيق. احسب كتلة الكالسيوم في عينة محلول الاختبار.
2.3 الكواشف. المواد. معدات
مقياس كهروضوئي KFK-2 ؛
أنابيب بسمك طبقة امتصاص الضوء 50 و 100 مم ؛
موازين المختبر ، فئة الدقة 1 ، 2 ؛
خزانة التجفيف: جهاز طرد مركزي.
البوتقات الخزفية
جهاز للتصفية من خلال المرشحات الغشائية بمضخة نفاثة مائية ؛
قياس الماصات ، بسعة 25 ، 100 مل ؛
يجب أن يحتوي المعلق على حوالي 4 جم / دسم 3 من الكاولين الكاولين المخصب لصناعة العطور ؛
بيروفوسفات البوتاسيوم
بيروفوسفات الصوديوم ،
كبريتات الهيدرازين ،
hexamethidentetramine للبلورات المفردة ،
كلوريد الزئبق
الفورمالين ،
الكلوروفورم.
مرشحات الغشاء
يتم تحديد العكارة في موعد لا يتجاوز 24 ساعة بعد أخذ العينات. يمكن حفظ العينة بإضافة 2-4 مل من الكلوروفورم إلى 1 لتر من الماء. يتم تحديد عكارة الماء ضوئيًا عن طريق مقارنة عينات من الماء الذي تم فحصه مع المعلقات القياسية.
يمكن صنع الملاط القياسي من الكاولين أو طرابلس. يتم إعداد الحلول القياسية وفقًا للعينة القياسية الحكومية (GSO - مصممة للمعايرة والتحقق من الأدوات التحليلية ، والتحكم في أخطاء طرق القياس (MVI) ، وإصدار شهادة MVI المطورة حديثًا لمحتوى الأنيونات في بيئات الماء والهواء ، والتربة والنفايات ).
تحضير العينة المعيارية (CO- يتكون من التحضير الأولي لمعلقات المعايرة منها بطريقة التخفيف الحجمي). يجب تحضير المعلقات من CO عند درجة حرارة 20-25 درجة. أثناء تحضير التعليق ، لا يُسمح بتغييرات درجات الحرارة. بيئةأكثر من 20 درجة.
حجم يصل إلى 50 سم 3 من محلول 2.5 جم من hexamethylenetetramine (CH 2) 6 N 4 مخفف في دورق حجمي بسعة 500 سم 3 في 25 سم 3 من الماء المقطر 25 سم 3 من المحلول أ يضاف إلى الحل.
لتحضير المعلقات المعيارية العاملة من الكاولين التعكر ، يتم رج المعلق القياسي الرئيسي ويتم تحضير معلق يحتوي على 100 مجم / دسم 3 من الكاولين. من التعليق الوسيط ، يتم تحضير معلقات العمل بتركيز 0.5 ؛ 1.0 ؛ 1.5 ؛ 2.0 ؛ 3.0 ؛ 4.0 ؛ 5.0 مجم / دسم 3. يتم تحضير المعلق الوسيط وجميع معلقات العمل بالماء المقطر وتخزينها لمدة لا تزيد عن يوم واحد.
لتحضير المعلق القياسي الرئيسي للفورمازين I ، الذي يحتوي على 0.4 وحدة دولية في 1 سم 3 ، خذ المحلول أ. 0.5 جم من كبريتات الهيدرازين (NH 2) 2 H 2 SO 4 يذوب في ماء مقطر ويتم تعديله إلى B ويحفظ (24 ± 2) ح عند درجة حرارة (25 ± 5) درجة مئوية. ثم أضف الماء المقطر حتى العلامة. يتم تخزين المعلق القياسي الرئيسي للفورمازين لمدة شهرين ولا يتطلب الحفظ والاستقرار.
لتحضير معلق قياسي من فورمازين II يحتوي على 0.04 وحدة دولية لكل 1 سم 3 من المحلول ، قم بما يلي: 50 سم 3 من المعلق القياسي الأساسي المختلط تمامًا من فورمازين 1 يتم تخفيفه بالماء المقطر إلى حجم 500 سم 3. يتم تخزين المعلق القياسي للفورمازين II لمدة أسبوعين.
لإعداد معلقات العمل المعيارية للفورمازين ، خذ 2.5 ؛ 5.0 ؛ 10.0 ؛ 20.0 سم 3 معلق قياسي مسبق الخلط من فورمازين II يتم تعديله إلى حجم 100 سم 3 بالماء المقطر.
 2.4 إجراء التحليل
2.4 إجراء التحليل
لتحضير المعلق القياسي الأساسي من الكاولين ، خذ 25-30 جم من الكاولين ، ورجه جيدًا مع 3-4 دسم 3 من الماء المقطر واتركه لمدة 24 ساعة.بعد 24 ساعة ، يؤخذ الجزء غير الموضح من السائل مع سيفون. يُسكب الماء مرة أخرى في الجزء المتبقي ، ويهتز بقوة ، ويترك مرة أخرى بمفرده لمدة 24 ساعة ، ويتم أخذ الجزء الأوسط غير المصفى مرة أخرى. تتكرر هذه العملية ثلاث مرات ، في كل مرة يتم إضافة التعليق الذي لم يتم توضيحه خلال اليوم إلى التعليق الذي تم جمعه مسبقًا. يتم رج المعلق المتراكم جيدًا وبعد ثلاثة أيام يتم تصريف السائل الموجود فوق الرواسب ، حيث يحتوي على جزيئات صغيرة جدًا.
يضاف 100 سم 3 من الماء المقطر إلى المادة المترسبة التي تم الحصول عليها ، ورجها ويتم الحصول على معلق قياسي أساسي. يتم تحديد تركيز المعلق الرئيسي بطريقة الوزن (على الأقل من عينتين متوازيتين): يتم وضع 5 سم 3 من المعلق في بوتقة يتم إحضارها إلى وزن ثابت ، وتجفيفها عند درجة حرارة 105 درجة مئوية إلى وزن ثابت ، ويتم وزنها ويتم حساب محتوى الكاولين لكل 1 دسم 3 من المعلق.
ثم يتم تثبيت المعلق القياسي الرئيسي مع البوتاسيوم أو بيروفوسفات الصوديوم (200 مجم لكل 1 دسم 3) ويتم حفظه بمحلول مشبع من كلوريد الزئبق (1 سم 3 لكل 1 دسم 3) أو الفورمالين (10 سم 3 لكل 1 دسم 3) أو الكلوروفورم (1 سم 3 لكل 1 دسم 3).
يتم تخزين التعليق القياسي الرئيسي لمدة 6 أشهر. هذا هو ماء الاختبار القياسي الرئيسي الذي أزيلت منه المواد الصلبة العالقة بالطرد المركزي أو الترشيح من خلال المرشحات الغشائية.
لإنشاء رسم بياني للمعايرة ، يتم أخذ معلقات العمل القياسية. تم رسم القيم التي تم الحصول عليها من الكثافات الضوئية والتركيزات المقابلة للمعلقات القياسية (مجم / لتر) على الرسم البياني.
قبل الاختبار ، من أجل تجنب الأخطاء ، يتم معايرة المقاييس الضوئية ضد المعلقات المعيارية للعكارة السائلة أو ضد مجموعة من المعلقات المعيارية للعكارة الصلبة ذات الكثافة البصرية المعروفة.
يتم إدخال عينة اختبار اهتزت جيدًا في كفيت بسمك طبقة ماصة للضوء من 5-10 سم ، وتقاس الكثافة الضوئية في الجزء الأخضر من الطيف. سائل التحكم هو ماء الاختبار الذي يتم منه إزالة المواد الصلبة العالقة بالطرد المركزي أو الترشيح من خلال المرشحات الغشائية.
2.5 معالجة النتائج
يتم حساب حجم ثاني أكسيد الكربون ، Vco ، سم 3 بالصيغة:
Vco \ u003d X * Vk 1Xco
X هي قيمة التعكر التي أعدتها المعلقات ، NMF ؛
Xco - قيمة التعكر المعتمدة لـ CO ، NMF ؛
Vk - الحجم الذي يستخدمه الدورق الحجمي ، سم 3
محلول رقم 1-1 سم 3 GSO مياه الشرب حتى 1000 سم 3
1 سم 3 \ u003d 4 EMF
محلول رقم 2-1 سم 3 محلول رقم 1 مياه شرب حتى 1000 سم 3
1 سم 3 \ u003d 0.04 فائق التوهج
محلول Vcm 3 رقم 2 + مياه شرب حتى 1000 سم 3 à وقم بتحليل KFK-2
يتم تحديد التعكر من خلال الصيغة:
2.6 الخلاصة
يجب أن تكون مياه الشرب آمنة من الناحية الوبائية وغير ضارة في التركيب الكيميائي ولها خصائص حسية مناسبة.
يتم تحديد جودة المياه من خلال تكوينها وخصائصها عندما تدخل شبكة إمدادات المياه ؛ عند نقاط سحب المياه لشبكة إمدادات المياه الخارجية والداخلية.
المؤشرات الميكروبيولوجية. من الناحية الوبائية ، يتم تحديد سلامة المياه من خلال الرقم الإجماليالكائنات الحية الدقيقة وعدد البكتيريا من مجموعة Escherichia coli.
وفقًا للمؤشرات الميكروبيولوجية ، يجب أن تلبي مياه الشرب المتطلبات.
المؤشرات السمية لنوعية المياه تميز عدم ضررها. التركيب الكيميائيوتشمل معايير المواد:
التي تظهر نتيجة التلوث الصناعي والزراعي والمنزلي وغيره من مصادر إمدادات المياه.
تركيز مواد كيميائيةالموجودة في المياه الطبيعية أو المضافة إلى الماء أثناء معالجتها يجب ألا تتجاوز المعايير.
تشمل المؤشرات الحسية التي توفر خصائص حسية مواتية للمياه معايير للمواد:
وجدت في المياه الطبيعية.
يضاف إلى الماء أثناء المعالجة في شكل كواشف ؛
الناتجة عن الصناعية والزراعية و التلوث المنزليمصادر إمدادات المياه.
 يجب ألا تتجاوز تركيزات المواد الكيميائية التي تؤثر على الخواص الحسية للماء ، الموجودة في المياه الطبيعية أو المضافة إلى الماء أثناء معالجتها ، المعايير
يجب ألا تتجاوز تركيزات المواد الكيميائية التي تؤثر على الخواص الحسية للماء ، الموجودة في المياه الطبيعية أو المضافة إلى الماء أثناء معالجتها ، المعايير
يجب ألا تحتوي المياه على كائنات مائية يمكن رؤيتها بالعين المجردة ويجب ألا تحتوي على طبقة رقيقة على السطح.
التركيزات الكيميائية , الموجودة في المياه نتيجة للتلوث الصناعي والزراعي والمنزلي ، يجب ألا تتجاوز MAC المعتمد من قبل وزارة الصحة في اتحاد الجمهوريات الاشتراكية السوفياتية لمياه الشرب ومياه الشرب. استخدام المياه الثقافي والمجتمعيعلى الخصائص الحسية والسمية الصحية ، وكذلك معايير السلامة من الإشعاع NRB-76/87. إذا تم العثور على مثل هذه المواد الكيميائية مع نفس علامة الحد من الضرر في الماء ، يجب ألا يزيد مجموع نسب التركيزات المكتشفة في الماء و MPC الخاصة بهم عن 1.
مياه الشرب هي المياه المخصصة للاستهلاك اليومي غير المقيد والآمن للإنسان والكائنات الحية الأخرى. الفرق الرئيسي من المقاصف و مياه معدنيةهو محتوى ملح منخفض (بقايا جافة) ، بالإضافة إلى وجود معايير حالية لـ التكوين العاموالخصائص.
يتم فحص الرائحة والطعم والعكارة واللون وصلابة مياه الشرب ، وهذا شائع لجميع أنواع المياه.
تعكر الماء هو مؤشر يميز انخفاض شفافية الماء بسبب وجود معلقات دقيقة غير عضوية وعضوية.
الخلاصة: استيفاء نتائج التحليل لأنها تلبي معايير التسامح (انظر الملحق 4)
3 - الخلاصة
ربما يعلم الجميع ذلك جسم الانسانللحياة الطبيعية ، أولاً وقبل كل شيء ، هناك حاجة إلى مياه الشرب النظيفة. الماء هو الوسيلة الرئيسية لإيصال المغذيات الدقيقة إلى جميع أجزاء الجسم. لا غنى عن مياه الشرب النقية في عمليات نمو وتغذية الجسم ، فمياه الشرب النقية تضمن مستوى حرارة ثابتًا في الجسم ، وفي حالات الحاجة ، الماء هو الذي يمكن أن يملأ المفقودين ، ولكن الموارد الحيوية في الجسم و استبدلها لفترة من الوقت.
في الوتيرة السريعة لحياتنا ، غالبًا ما يعاني الجسم من نقص في توازن الماء في الجسم. يتجلى هذا في العطش الخفيف ، ولكن في أغلب الأحيان بسبب كتلة كبيرةنحن لا نهتم بهذا الشعور ، خاصة إذا لم يكن هناك مصدر للمياه في متناول اليد. وعواقب نقص السوائل في الجسم تنعكس بشكل مؤسف للغاية على صحتنا: بمجرد أن يتوقف الجسم عن الحصول على كمية كافية من الماء ، تضيع جميع الدورات الفسيولوجية ، تلك الموارد التي يحتفظ بها الجسم لـ "يوم ممطر" أو بشكل خاص حالات طارئة. وجد الجسم الماء ، ولكن من أجل تعويض الموارد المفقودة التي تنفق على الماء - يحاول الجسم تجديده بأسرع ما يمكن ، وحتى بهامش - ومن هنا جاء الوزن الزائد "على الوجه" ، وليس فقط على على الوجه ، ولكن على الجسد كله. هذه ليست النتيجة الوحيدة "للعطش الخفيف": آليات الهضم ، والتمثيل الغذائي ، والدورة الدموية ، وحتى نشاط المخ. كل هذا يهدد بالإرهاق وفقدان الانتباه والصداع. ولكن هذا ليس كل شيء. إذا كان الجسم لا يحصل على كمية كافية من الماء بانتظام خلال فترة النشاط من اليوم ، فإن هذا يهدد بفشل خطير في جميع أجهزة الجسم تقريبًا ، ونتيجة لذلك ، فإن نقص الماء لا يؤدي فقط إلى تفاقم "نقاط الضعف" في الجسم ، ولكن أيضًا لظهور أمراض جديدة. المياه النظيفة ، كما ذكرنا سابقًا ، لها أهمية كبيرة في الحياة البشرية، حياة الحيوان،  النباتيةوالطبيعة بشكل عام. تعتمد قدرة جميع الخلايا الحية على توافر المياه. باستكشاف الدور الذي يلعبه الماء لشخص ما ، يمكن للمرء أن يرى أن جسمنا بالكامل عبارة عن مجموعة من المحاليل المائية والغرويات والمعلقات وأنظمة المياه المعقدة الأخرى.
النباتيةوالطبيعة بشكل عام. تعتمد قدرة جميع الخلايا الحية على توافر المياه. باستكشاف الدور الذي يلعبه الماء لشخص ما ، يمكن للمرء أن يرى أن جسمنا بالكامل عبارة عن مجموعة من المحاليل المائية والغرويات والمعلقات وأنظمة المياه المعقدة الأخرى.
الماء يثري خلايا الجسم العناصر الغذائية(فيتامينات وأملاح معدنية) ويزيل الفضلات (الخبث). بالإضافة إلى ذلك ، يشارك الماء في عملية التنظيم الحراري (التعرق) وفي عملية التنفس (يمكن للشخص أن يتنفس هواءً جافًا جدًا ، ولكن نسبيًا القليل من الوقت). من أجل الأداء الطبيعي لجميع الأنظمة ، يحتاج الشخص إلى شرب ما لا يقل عن 1/5 لتر من الماء يوميًا.
نتيجة لذلك ، فإن الماء النظيف الذي يستهلكه الشخص ضروري لأداء عمله بشكل صحيح. لذلك ، فإن القضية الرئيسية في تغذيتنا هي الاستخدام المنتظم للماء عن طريق إدخاله في الجسم بشكل حر وفي الطعام ، وكذلك الاستخدام الإلزامي الدقيق للمياه. ماء نقي. لذلك ، يجب تنقية مياه الشرب. يعد اختبار تعكر مياه الشرب أيضًا جزءًا لا يتجزأ من تنقية المياه والتحقق من جودتها.
تعكر المياه هو مؤشر يميز انخفاض شفافية المياه بسبب وجود معلقات دقيقة غير عضوية وعضوية ، فضلاً عن تطور الكائنات العوالق. قد تكون أسباب تعكر المياه هي وجود الرمل والطين والمركبات غير العضوية (الهيدروكسيد والألمنيوم والكربونات المختلفة والمعادن) ، وكذلك الشوائب العضوية أو الكائنات الحية ، مثل البكتيريا النباتية أو العوالق الحيوانية.
وهكذا في ورقة مصطلحيعكس قيمة مؤشر الجودة تعريف مياه الشربالعكارة.
4. الأدب
الملخصات:
الملخص حسب التخصص: " الكيمياء التحليلية»
الملخص حسب التخصص: " التحليل الفني»
الملخص حسب التخصص: "طرق التحليل الفيزيائية والكيميائية"
الملخص حسب التخصص: "التحليل الطيفي"
"أساسيات التحليل الفني". بيسارينكو ف. وزاخاروف إل ، إس. دار نشر " تخرج من المدرسه". موسكو 1972
"التحليل الفني للتحكم". Avgustinovich IV ، Andrianova S.Yu. موسكو. مركز النشر "الاكاديمية" 2010
"التدريب الصناعي لمساعدي المختبرات للكيميائيين". جورفيتش يا. موسكو. الثانوية 1987
"أساسيات الكيمياء التحليلية". الكتاب 1. Ivanov V.M. جارماش إيه في
Dorolova Yu.A. موسكو. "المدرسة الثانوية" 2004
"الكيمياء التحليلية". AA ايشينكو. موسكو. مركز النشر "الاكاديمية" 2012
GOST 3351-74 مياه الشرب. طرق تحديد الطعم والرائحة واللون والعكارة.
GOST 4192-82 مياه الشرب. طرق التحديد المعادن
GOST 2874-82 مياه الشرب. متطلبات النظافةومراقبة جودة المياه.
مقالات وبرامج وإعلانات الكيمياء التحليلية.
يحتوي المنتدى الكيميائي Chemforum.ru على معلومات عن صناعة كيميائيةروسيا ورابطة الدول المستقلة. إنه مركز معلومات متنوع للشركات العاملة في الصناعات الكيميائية والصناعات ذات الصلة في روسيا ورابطة الدول المستقلة.
chem.msu.su - في موقع "العلوم الكيميائية والتعليم في روسيا": " المكتبة الرقميةفي الكيمياء "- chem.msu.su (قسم" مواد لتلاميذ المدارس ") و" تعليم الكيمياء المدرسية في روسيا: المعايير والكتب المدرسية والأولمبياد والامتحانات "- chem.msu.su (مواد للمعلمين وأطفال المدارس).
school-sector.relarn.ru - "الكيمياء للجميع"من سلسلة "الموسوعات التربوية".
 الدولة الإقليمية المستقلة مؤسسة تعليمية
الدولة الإقليمية المستقلة مؤسسة تعليمية
وسط التعليم المهني
"كلية ستاروسكول الصناعية"
عمل الدورة
في تخصص "طرق التحليل الفيزيائية والكيميائية"
"تحديد قياس ضوئي لعكارة مياه الشرب بطريقة قياس التعكر"
ك. 240308.4979.00.00.PZ
أكمله الطالب Trebunskikh أولغا ميخائيلوفنا
مجموعة AK 44تخصص " مراقبة الجودة التحليلية مركبات كيميائية »
محمي بدرجة _____________
مدير المشروع __________ "___" ________ 2014 Semerdzhieva E.V.
