Značilnosti glavnih metod analize vode. Kemijske metode raziskovanja vode
Spodaj oksidabilnost razumeti sposobnost organskih snovi v vodi, da se oksidirajo z atomskim kisikom. Vrednost oksidabilnosti je izražena s količino kisika (mg), ki je potrebna za oksidacijo organskih snovi v 1 litru vode. Vir atomskega kisika v teh reakcijah je kalijev permanganat ali bikromat, oksidativnost pa se imenuje permanganat oziroma dikromat. Običajno se oksidabilnost določi v kisli vodi, ko pa je vsebnost kloridov v vodi več kot 300 mg/l in je zelo onesnažena, študijo izvajamo v alkalnem okolju.
Permanganatna metoda (po Kubelu). Temelji na sposobnosti kalijevega permanganata, da sprošča kisik v kislem okolju. Po količini porabljenega kisika ocenjujemo oksidativnost vode.
Jedilni pribor in posoda: birete, 5 ml pipete, 250-300 ml bučke, 100 ml graduirani valji, epruvete, steklene kroglice, lijaki s premerom 5-7 cm.
Reagenti:
1) raztopina kalijevega permanganata (0,01 N) - za to se 0,316 g zdravila raztopi v 1 litru destilirane vode; 1 ml te raztopine ustreza 0,08 mg kisika. Raztopina je bila shranjena v temni steklenici
pokrijte in preverite z vsako serijo študij;
2) rešitev oksalna kislina(0,01 n) - za njegovo pripravo stehtamo 0,63 g kisline in jo raztopimo v 1 litru destilirane vode; 1 ml raztopine potrebuje za oksidacijo 0,08 mg kisika;
3) raztopina žveplove kisline (25%) z gostoto 1,84 g/cm3 kubične
prostornino (1:3) v destilirani vodi.
Raziskovalna metoda.
1) V 250 ml bučko damo več steklenih kroglic in nalijemo 100 ml vode, dodamo 5 ml žveplove kisline (1: 3) in 10 ml raztopine kalijevega permanganata (0,01 N). Mešanico hitro segrejemo do vretja (v 5 minutah) in pustimo na majhnem ognju približno 10 minut. Po tem se bučka odstrani (raztopina mora imeti roza barva) in vroči raztopini dodamo 10 ml raztopine oksalne kisline (0,01 N). Razbarvano vročo raztopino (pri temperaturi 80 0 C) titriramo z raztopino kalijevega permanganata (0,01 N), dokler ne dobimo stabilne rahlo rožnate barve. Če preiskovana tekočina med vrenjem postane brezbarvna ali postane svetlo rjava, se nadaljnje raziskave ustavi in raztopina izlije. Vzamemo novo porcijo vode in jo najprej 2- ali 5-krat razredčimo z destilirano vodo in analize ponovimo, kot je navedeno zgoraj.
2) Normalnost raztopine kalijevega permanganata (vrednost K) je nastavljena na naslednji način. V bučko s prostornino 250 ml vlijemo 100 ml destilirane vode, dodamo 5 ml žveplove kisline (25 %) in 10 ml raztopine kalijevega permanganata (0,01 N). Tekočino segrejemo in kuhamo 10 minut na majhnem ognju. Nato v vročo tekočino dodamo 10 ml raztopine oksalne kisline (0,01 N), kar povzroči razbarvanje. Nato se v vročem titrira z raztopino kalijevega permanganata (0,01 N), dokler ne dobimo bledo rožnate barve.
Korekcijski faktor (K) za titer 0,01 N raztopine kalijevega permanganata se izračuna po formuli:
kjer je 10 količina 0,01 n raztopine oksalne kisline, ml; b - količina 0,01 n raztopine kalijevega permanganata, dodana pred vrenjem in nato uporabljena za titracijo, ml.
3) Oksidabilnost vode se izračuna po formuli:
kjer je X oksidabilnost kisika v mg na 1 liter vode; a - količina KMPO 4 v ml, ki se vlije pred vretjem; b količina KMPO 4, uporabljena za titracijo v ml; K-korekcijski faktor na normalnost KMnO 4 ; 10 - količina KMPO 4, porabljena za oksidacijo oksalne kisline; 0,08 - količina kisika, ki ustreza 1 ml 0,01 n raztopine KMnO 4 ; 1000 - prenesite v 1 liter vode; C je prostornina vode, vzete za analizo, ml.
Opomba:če je vzorec preskusne vode razredčen z destilirano vodo, ga je treba preveriti glede vsebnosti organskih snovi in pri izračunu oksidabilnosti odšteti količino KMnO 4, ki je šla za oksidacijo organskih snovi v destilirani vodi.
Ker se nekatere mineralne (oksidne) spojine - železo, mangan, nitriti, vodikov sulfid - lahko oksidirajo tudi v vodi, pri čemer je njihova vsebnost precejšnja, je treba upoštevati vpliv na vrednost oksidabilnosti ( poskus poteka brez segrevanja).
Določanje oksidabilnosti v alkalnem okolju (po Schultzu). Ta metoda je uporabna za določanje oksidabilnosti vode, onesnažene s kloridi itd.
reagenti:
1) raztopina kalijevega permanganata (0,01 N) - za to se 0,316 g zdravila raztopi v 1 litru destilirane vode;
2) 50 % raztopina natrijevega hidroksida;
3) raztopina oksalne kisline (0,01 n) - za njeno pripravo stehtamo 0,63 g kisline in jo raztopimo v 1 litru destilirane vode;
4) 20 % raztopina žveplove kisline.
Raziskovalna metoda.
V bučko vlijemo 100 ml vode, dodamo 0,5 ml 50 % raztopine natrijevega hidroksida in 10 ml raztopine kalijevega permanganata (0,01 N). Tekočino segrevamo in kuhamo 10 minut od začetka pojava prvih mehurčkov, ohladimo na 50-60 °C, dodamo 5 ml žveplove kisline, 10 ml 0,01 N raztopine oksalne kisline (tekočina naj postane razbarvana). ; če temu ni tako, dodajte še nekaj ml oksalne kisline). Nato titriramo z 0,01 N raztopino kalijevega permanganata, dokler se ne pojavi rahlo rožnata barva, ki ne izgine v 3-5 minutah. Izračun se izvede po enaki formuli kot po Kubelovi metodi, rezultat je izražen v mg kisika na liter.
Ekspresna metoda za določanje oksidabilnosti. V epruveto nalijemo 10 ml vode in dodamo 0,5 ml raztopine žveplove kisline v razmerju 1:3 in 1 ml 0,01 N raztopine kalijevega permanganata. Zmes temeljito premešamo in pustimo pri miru 20 minut pri temperaturi 20 0 C in 40 minut pri temperaturi 10-20 0 C. Nato raztopino pregledamo s strani in od zgoraj ter določimo oksidativnost. po barvi, kar je odvisno od barve. Torej, svetla medeno-roza barva ustreza 1, lila-roza - 2, šibka lila-roza - 4, bledo lila-roza - 6, bledo roza - 8, roza-rumena - 12, rumena - 16 mg O 2 / l in več.
Dušikov amoniak in amonijeve soli. Količino amoniaka in amonijevega dušika v vodi določimo s kolorimetrično metodo, katere bistvo je, da ob dodajanju Nesslerjevega reagenta v testno vodo nastane živosrebrni jodid, ki obarva vodo v rumena različno intenzivnost glede na vsebnost amoniaka. Po dodajanju Nesslerjevega reagenta vzorec vode primerjamo s standardno raztopino amonijevega klorida, ki vsebuje znano količino amonijevega dušika. Za kolorimetrijo je primerna voda s koncentracijo amoniaka v območju 0,1-10 mg/l.
Jedilni pribor in posoda: fotoelektrični kolorimeter - FEC, pipete 1 in 5 ml, bučke 100 ml, merilni cilinder 100 ml in epruvete.
reagenti:
1) Nesslerjev reagent;
2) standardna raztopina amonijevega klorida z vsebnostjo dušika 0,001 mg
v 1 ml;
3) 50 % vodna raztopina soli Rochelle;
4) alkalna zmes, sestavljena iz 50 g natrijevega hidroksida in 100 g ogljikovega dioksida
soda, raztopljena v 300 ml destilirane vode (pripravljeno raztopino kuhamo 15 minut in filtriramo skozi azbestno volno);
5) aluminijev hidroksid.
Priprava vode za analizo: na natančnost določanja vsebnosti amonijevega dušika in amonijevih soli v vodi vplivajo njena barva in trdota, vsebnost železa, sulfitov in prostega ogljikovega dioksida. Za razbarvanje 500 ml vode dodamo 0,5 g aluminijevega hidroksida in oborino usedemo 2 uri,
Sulfide določimo na naslednji način: 1 ml Nesslerjevega reagenta in nato 2 ml raztopine žveplove kisline (1:3) dodamo 10 ml vode. Če motnost po zakisanju vode ne izgine, potem vsebuje sulfide, ki jih je treba odstraniti tako, da v 100 ml vode dodamo 10 kapljic 30 % raztopine cinkovega acetata. Po tem se voda usede 2 uri, prozorni del se izsuši in iz njega vzamemo vzorce za raziskave.
Ko je trdota vode večja od 3,5 mg / ekv. l zmehčam, za to dodamo 2 ml kavstične sode v 100 ml vode in raztopino odtajamo 2 uri.
Raziskovalna metodologija. V eno bučko vlijemo 100 ml standardne raztopine amonijevega klorida, v drugo pa 100 ml preskusne vode. Nato v obe bučki dodamo 3 ml 50 % raztopine Rochelleove soli in 2 ml Nesslerjevega reagenta. Vsebino bučk pretresemo in pustimo pri miru približno 10 minut, dokler se ne pojavi barva.
Kolorimetrija se izvaja na FEC s filtrom modre svetlobe (št. 4) v kivetah debeline 1-5 cm. optična gostota standardne raztopine testne vode točno 10 minut po dodatku Nesslerjevega reagenta (upošteva se zaporedje dodajanja reagentov in njihova kolorimetrija). Izračun se izvede po formuli:
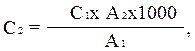
kjer je C 2 koncentracija amoniaka in amonijevega dušika v preskusni vodi, mg/l; C 1 - enako v standardni raztopini amonijevega klorida, mg/l; A 1 - optična gostota standardne raztopine amonijevega klorida (rdeča lestvica); A 2 - optična gostota preučevane vode (na rdeči lestvici); 1000 - prenesite na 1 liter.
Določanje amoniaka s približno metodo. Nalijte v epruveto
10 ml preiskovane vode dodamo 0,2-0,3 ml 50% raztopine Rochelle
solimo, dobro premešamo in dodamo Nesslerjev reagent. Opredelitev amoniaka
svinec po tabeli 38.
dušikov nitrit. Načelo študije je, da voda, ki vsebuje nitrite, ko dodamo Griessov reagent, postane rožnata. Za odkrivanje nitritov uporabite Griessov reagent - raztopino alfa-naftalamina in sulfanilne kisline v ocetna kislina. Ko je vsebnost nitritov v vodi večja od 0,3 mg/l, voda porumeni. Meja občutljivosti reagenta je 0,01 mg/l nitritov.
V vsakem podjetju, v katerem koli objektu je mogoče izračunati in namestiti visokokakovosten sistem čiščenja vode samo z analizo vode. Danes jih je največ različne variante analize, vendar še vedno ostaja prioriteta. Brez njegovih podatkov je nemogoče narediti kakovostno obdelavo vode. Čas ne miruje in sodobne metode kemična analiza voda omogočiti sedanji generaciji pod enakimi pogoji pridobiti veliko več informacij.
Laboratorijske analize: posledice za zdravje ljudi
Treba je opozoriti, da tehnološki napredek v življenja ljudi ni prinesel le novih tehnologij, temveč tudi okoljske probleme. Umazana voda je vir okužbe. In brez metod čiščenja je nemogoče, preprosto je nemogoče. Znanstveniki pravijo, da je zaradi nekvalitetne obdelave več kot 70 odstotkov vode, ki jo zaužijejo ljudje, nežive. Se pravi, od takšne vode zagotovo ne bo koristi.
Obstajajo določeni standardi, ki veljajo za kakovost vode. Razvili so jih zato, da bi dobili vsaj sprejemljivo vodo za porabo. Ampak, žal, večina vodnih virov iz centralizirani sistemi ne izpolnjujejo teh standardov. Po vsem svetu znanstveniki poskušajo opozoriti na kakovost vode in njene težave. in sodobne načine kemična analiza vode v tem vidiku zasedajo precejšnjo nišo, ki pomaga pri reševanju celo vrstico težave.
In prva stvar, ki pomaga rešiti takšno analizo, je ocena kakovosti vode. Poleg tega morate danes razumeti, da čeprav se ocena kakovosti vode izvaja po istih parametrih, ima svoje značilnosti za vodo iz, iz, iz. Nabor parametrov je podoben, a še vedno nekoliko drugačen. Zato mora uporabnik ob naročilu analize jasno navesti, kaj točno je treba ovrednotiti in kako želi, da se voda ovrednoti po kemični sestavi ali bakteriološko.
Vodo boste morali analizirati v vsakem primeru, na katerem koli viru. Takšni rezultati so zagotovilo varnosti za potrošnike in podjetje. Ta postopek je najbolje izvesti v posebnih specializiranih laboratorijih. Vsak laboratorij mora imeti potrdilo o potrditvi. Izda se podjetjem katere koli oblike lastništva.
Analize se lahko izvajajo v dveh smereh - bakteriološki in kemično-fizikalni. Sodobne metode kemične analize spadajo v drugo skupino. Tukaj so prikazani tako parametri trdote kot motnosti, vse vrste vonjav, preverjajo se organski in anorganski vključki v vodi.
Brez bakteriološke analize je mogoče storiti le v primeru ocenjevanja vode iz pipe, s centralno oskrbo z vodo. Takšna voda je praviloma že razkužena. V vseh drugih primerih bi morala biti ocena v kompleksu.
Zasnova čiščenja vode za kateri koli namen pomeni v vsakem primeru oceno stanja vodnih virov. Ni analize - ni visokokakovostne opreme za čiščenje vode.
Da bi šlo vse v redu, lahko v skladu s pravili izbor vode izvedete sami. Toda da bi zagotovili odsotnost napak pri oceni, je najbolje, da pokličete strokovnjaka na dom ali v podjetje.
Ocenjevanje vode je danes postalo del človekovega življenja. In to tako v službi kot doma. Če želi uporabnik vodnih virov zagotoviti lastno zdravje, potem je prava povezava nepogrešljiva - ocena vode + pravilen sistemčiščenje.
Enako pomembno je odgovoriti na vprašanje - kako pogosto analizirati vodo? Ni skrivnost, da se sestava vode sčasoma spreminja. In kaj naj stori lastnik zasebne hiše? Kako in v kakšnem vrstnem redu je treba opraviti teste? Za kaj se zgrabiti?
Majhen izlet za začetnike. Tisti, ki so pravkar opremili vodnjak na svoji lokaciji, v brez napak dvakrat opravite popolno kemično analizo vode. Pred in po namestitvi. Prvič je jasno. Drugi se izvede, da se oceni pravilnost sestavljenega sistema čiščenja. Zagotavlja priložnost za popravljanje napak.
V prihodnosti, ko bo vrtina obratovala, prvo leto - analizira se enkrat na tri mesece, nato se lahko opravi enkrat na 12 mesecev. Morda se bo takšno število analiz komu zdelo odveč, vendar si je treba vedno zapomniti dve značilnosti:
- Tisti, ki so kopali sami, bi morali razumeti, da je nadzor nad stanjem vode v celoti na njihovih ramenih, zato ga bodo morali nadzorovati sami in vse življenje;
- Pri delu z lastnim vodnjakom se lahko zgodi karkoli, lastnik hiše morda ne ve, da je nekje v bližini kemikalija. majhna tovarna in dobesedno pred dnevi se je tam prebila cev z odpadki. Hkrati je stanje vode postalo ne le nevarno, ampak kritično, tako kot takrat, ko niso opazili vodonosnika in odpadkov iz greznica celotno vas, to dejstvo pa bo morda postalo jasno po pol leta delovanja.
Nikakor pa izvedba kemičnih analiz na začetku sploh ni brezcilen podvig. Poleg tega je danes mogoče uporabiti najučinkovitejše in najsodobnejše metode kemične analize vode.
Sodobne možnosti za raziskovanje vode
Danes obstaja več možnosti za preučevanje vode, večinoma kemične. Slaba stvar je, da vsi laboratoriji ne izvajajo takšnih testov. Nekatere metode so tako nove in napredne, da jih je mogoče izvajati le v tujini. Spodaj je tabela samih sodobnih analiz. Najbolj edinstvene za danes so kromato-masne spektrometrične analize, luminiscenčna in nevtronska aktivacija. Slednje se običajno izvajajo na nevtronski ravni, pod mikroskopom z zelo visoko natančnostjo.
|
Vrsta analize |
Metodologija |
|
Po prostornini |
|
|
Elektrokemični |
Potenciometer polarografija |
|
Foto-, spektrometrični Luminescenčna |
|
|
Fotografija+kemija |
Fotokemični |
|
kromatografija |
Tekoči stolpci Visoka učinkovitost tekočine |
Za pravilno analizo je potrebno pravilno izbrati vodo. Če želite to narediti, lahko vzamete navadno steklenico navadne vode, ne gazirane ali sladke. Vodo iz pipe odvajamo najmanj 15 minut. Nato steklenico operemo (BREZ FUNKCIJ) in jih vtipkamo pod sam vrat. Nalijte v tankem curku ob strani steklenice. Bolje je, da ga takoj odnesete v laboratorij. V hladilniku ga lahko hranite največ 24 ur.
Ena izmed sodobnih analiznih metod je kemična ocena vode po razširjenem seznamu. Ta metoda se uporablja pri ocenjevanju plitvih vrtin ali vrtin. Zaradi majhne globine obstaja nevarnost onesnaženja vode z vsemi vrstami škodljivih nečistoč. Zato je treba takšno vodo pregledati ob upoštevanju naslednjih parametrov:
- Organske - poleg standardnih kovinskih soli bo to vključevalo vinil klorid, ogljikov tetraklorid, akrilamid itd.;
- Anorganske snovi - preverja se prisotnost ne le trdnih nečistoč, temveč tudi soli niklja, svinca, cinka itd.;
- Mikrobiološke nečistoče - tukaj pregledajo E. coli, lambijo, na splošno nekoliko širši razpon škodljive bakterije kot pri običajni bakteriološki analizi;
- Ker se voda črpa iz majhne globine, obstaja veliko tveganje in veliko število, nečistoče pesticidov, zato jih zaznamo - metoksiklor, toksafol, endrin itd .;
- Radionuklidne nečistoče in herbicidi, razlog je isti - določi se vsebnost penklorofenola, atracina, določi se število nabitih delcev in radija.
Testni komplet
Kot primer sodobne metode kemične analize vode lahko navedemo testni komplet. To je zelo priročna metoda, ki vam omogoča hitro oceno vodnih virov skoraj na terenu.

Ta testni komplet vsebuje celoten komplet potrošni material za 100 vrst analiz. In vse je narejeno hitro in preprosto. In vse analize izpolnjujejo zahteve za metode analize. Takšni testni kompleti so dobri, ker vam omogočajo hitro preverjanje sestave vode enkrat na četrtletje. To pomeni, da je za spremljanje stanja vode takšen sklop najbolj optimalen. Poleg tega bo ocenjevalec rezultate izbire prejel kar na licu mesta, brez izletov v laboratorij in pričakovanj.
Ta metoda omogoča oceno obeh tehnično vodo. Napaka indikacij ustreza laboratorijskim raziskavam. Giba se med 25-30 odstotki. Toda za hitrost je to povsem sprejemljiva pristojbina in klic specialista s takšnim kompletom bo pomagal oceniti stanje vode tudi na najbolj oddaljenih in težko dostopnih območjih, kar je pomembno.
Takšni kompleti se proizvajajo v količini 12 kompletov na 100 testov. Se pravi, da je tudi precej ekonomičen.
Ocena vode je bila in ostaja glavna sestavina vsakega čistilnega sistema. Ali bo to močno industrijsko podjetje ali majhno zasebna hiša. Toda brez rezultatov prisotnosti različnih nečistoč v vodi ne bo delovalo. Ne morete naključno porabiti denarja za tako resne naprave, kot so čistila. Le jasen načrt in ocena. Zato je danes nemogoče podcenjevati pomen kemičnih analiz. Brez njih kakovostne obdelave vode ne more videti več kot en potrošnik.
Uvod
Relevantnost teme določa dejstvo, da je pomembno poznati pomen pitna voda in njegove lastnosti. Voda je ena najpogostejših snovi v naravi (hidrosfera zavzema 71 % zemeljske površine). Voda pripada bistveno vlogo v geologiji, zgodovini planeta. Živi organizmi ne morejo obstajati brez vode.
Glede na značilnosti izvora, sestave ali uporabe so:
mehka voda in trdo vodo, sladka voda, deževnica, stopljena voda, Podtalnica, mineralna voda, destilirana voda, odpadna voda in pitna voda.
Med glavnimi kazalci kakovosti pitne vode so:
Voda, ki ne škoduje zdravju ljudi in izpolnjuje zahteve veljavnih standardov kakovosti, se imenuje pitna voda, če je potrebno, da voda ustreza sanitarnim in epidemiološkim standardom, jo preverimo, prečistimo ali, uradno rečeno, »pripravimo« z uporabo čistilne naprave.
Odpadna voda - katera koli voda in padavine, preusmerjena v vodna telesa z ozemelj industrijska podjetja in naseljenih območjih preko kanalizacijskega sistema ali gravitacije, katerih lastnosti so se zaradi človekove dejavnosti poslabšale.
Odpadne vode lahko razvrstimo glede na naslednje znake:
Proizvodnja
Površinska kanalizacija
Ljudje, živali in rastline so večinoma voda, tudi ljudje: voda predstavlja 70 % naše telesne teže. Morda v razširjenosti vode, v tem, da je vse "prežeto in objeto z vodo", in njen glavni edinstvena lastnina.
Druga najpomembnejša lastnost je sposobnost vode, da raztopi snovi. Voda je univerzalno topilo. Zaradi tega njegova sestava ni omejena na formulo H 2 O.
Tretja edinstvena lastnost vode je, da je na Zemlji prisotna hkrati v treh stanjih oziroma, če uporabimo fizikalno terminologijo, v treh fazah - plinasti, tekoči in trdni, torej v obliki vodne pare, pravzaprav tekoča voda in led. Ne poskušajte najti druge snovi, ki bi imela enako lastnost! Vzemimo na primer plin kisik - pri temperaturi -183 °C se spremeni v tekočo, pri -218 °C pa v trdno fazo. železo, trdna kovina, postane tekočina (talina) pri +1539 °C in preide v parno stanje pri ogromni temperaturi +3200 °C.
Voda številnih izvirov sladko vodo ni primeren za pitje ljudi, saj lahko širi bolezen ali povzroči dolgotrajne zdravstvene težave, če ne izpolnjuje določenih standardov kakovosti vode:
Voda, ki ne škoduje zdravju ljudi in izpolnjuje zahteve veljavnih standardov kakovosti, se imenuje pitna voda, če je potrebno, da voda ustreza sanitarnim in epidemiološkim standardom, jo preverimo, prečistimo ali, uradno rečeno, »pripravimo« z uporabo čistilne naprave. Pomembno je poznati definicijo motnosti vode, saj je od tega odvisno zdravje ljudi.
Motnost voda - indikator ki označuje zmanjšanje preglednosti vode zaradi prisotnosti anorganskih in organskih finih suspenzij ter razvoj planktonskih organizmov. Povedal vam bom nekaj o strojni tovarni Starooskol.
Starooskolsky mehanski obrat je glavni proizvajalec jeklene in železne šibe v državi. Proizvaja tudi rudarsko in vrtalno opremo, prezračevalne in tuš naprave za vročo metalurško proizvodnjo; Blago skupne potrošnje.
Za proizvodnjo izdelkov obstoječega asortimana obrat uporablja tehnološke postopke, ki omogočajo izdelavo vseh glavnih vrst prerazporeditve, ki se uporabljajo v inženirski industriji. V tovarni se izvaja analitični nadzor vseh proizvodnih procesov. Analitična kontrola proizvodnje vključuje praktična uporaba teorija in metode analitične kemije za določitev sestave specifičnih predmetov katere koli proizvodnje.
Kontrola proizvodnje se uporablja za preverjanje kakovosti izdelkov in napredka tehnološki proces, preprečiti poroko in zavarovano
določeno s pravili in specifikacije kakovost izdelanih izdelkov.
Kazalniki kakovosti vključujejo naslednje kazalnike: namen blaga, zanesljivost blaga, okolju prijaznost blaga, kazalnike okolju prijaznosti blaga, ergonomske kazalnike, kazalnike ergonomije, kazalnike proizvodnost blaga, estetika blaga. (Glejte Dodatek 3)
Poleg nadzora proizvodnje se v obratu nenehno spremlja sestava pitne in pitne vode. odpadne vode različne kemične in kemijsko-fizikalne metode.
Namen predmeta: študij kakovosti pitne vode glede na turbidimetrično določanje motnosti.
 Vsebina
Vsebina
1.Uvod……………………………………………………………………………………...5
2. Glavni del……………………………………………………………………………………..9
2.1 Bistvo fizikalno-kemijskih analiznih metod…………………….. 9
2.2 Fotometrično določanje motnosti pitne vode s turbidimetrično metodo po GOST 3351-74……………………………………….12
2.3 Reagenti. Materiali. Oprema………………………………………19
2.4 Analiza…………………………………………………………………………..21
2.5 Obdelava rezultatov…………………………………………………………..23
2.6 Zaključek………………………………………………………………………………….24
3.Sklep……………………………………………………………………………………...26
4. Literatura…………………………………………………………………………………….28
5. Aplikacija
2.Glavni del
Bistvo fizikalno-kemijskih analiz
Analiza fizikalno-kemijskih metod (PCMA)., temeljijo na odvisnosti fizikalnih lastnosti snovi od njene narave, analitični signal pa je količina fizična lastnina, funkcionalno povezana s koncentracijo ali maso določene komponente.
Fizikalno-kemijske metode (PCMA) analize lahko vključujejo kemično transformacijo analita, raztapljanje vzorca, koncentracijo analita, maskiranje motečih snovi in drugo.
Za razliko od »klasičnih« kemičnih metod analize, kjer masa snovi ali njen volumen služi kot analitični signal, se pri fizikalno-kemijskih metodah analize kot analitična uporabljajo jakost sevanja, jakost toka, električna prevodnost, potencialna razlika itd. signal.
Pomembno praktična vrednost imajo metode, ki temeljijo na preučevanju emisij in absorpcije elektromagnetno sevanje v različna področja spekter.
Sem spadajo spektroskopija (na primer luminiscenčna analiza, spektralna analiza, nefelometrija in turbidimetrija in drugo). Pomembne fizikalno-kemijske metode analize vključujejo: elektrokemijske metode z uporabo meritev električne lastnosti snovi, kulometrija, potenciometrija itd.), kot tudi kromatografija (na primer plinska kromatografija, tekoča kromatografija, ionska izmenjava, kromatografija, tankoplastna kromatografija).
 Uspešno se razvijajo metode, ki temeljijo na merjenju hitrosti kemične reakcije(kinetične metode analize), toplotnih učinkov reakcij (termometrična titracija), kot tudi na ločevanje ionov v magnetnem polju (masna spektrometrija).
Uspešno se razvijajo metode, ki temeljijo na merjenju hitrosti kemične reakcije(kinetične metode analize), toplotnih učinkov reakcij (termometrična titracija), kot tudi na ločevanje ionov v magnetnem polju (masna spektrometrija).
Pri izvajanju fizikalno-kemijskih analiznih metod se uporablja posebna, včasih precej zapletena merilna oprema, v zvezi s katero se te metode pogosto imenujejo instrumentalne. veliko sodobnih aparatov opremljen z vgrajenimi računalniki, ki vam omogočajo iskanje optimalni pogoji analizo (npr. spektralno območje za pridobitev najbolj natančnih rezultatov pri analizi mešanice obarvanih snovi), izvajam. V skoraj vseh fizikalno-kemijskih metodah analize se uporabljata dve glavni metodi: metode neposrednih meritev in titracija.
Neposredne metode uporabljajo odvisnost analitičnega signala od narave analita in njegove koncentracije. Odvisnost signala od narave snovi - osnova kvalitativno analizo(polvalovni potencial v polarografiji itd.). Pri nekaterih metodah je povezava med analitskim signalom in naravo snovi vzpostavljena strogo teoretično. Na primer, spekter vodikovega atoma je mogoče izračunati z uporabo teoretično izpeljanih formul. Pri kvantitativni analizi se uporablja odvisnost jakosti signala od koncentracije snovi.
Številčne vrednosti konstant v spojni enačbi se eksperimentalno določijo s standardnimi vzorci, standardnimi raztopinami itd. Samo v kulometriji, ki temelji na Faradayevem zakonu, definicija konstant ni potrebna.
V praksi so najbolj razširjene naslednje metode za določanje konstant komunikacijske enačbe ali, kar je isto, metode količin, analize s fizikalno-kemijskimi meritvami:
1) Metoda kalibracijske krivulje. Intenzivnost analitičnega signala se izmeri za več standardnih vzorcev ali standardnih raztopin in nariše kalibracijski graf v koordinatah I=f(c) ali I=f(lgc), kjer je C koncentracija komponente v standardni raztopini. ali standardni vzorec. Pod enakimi pogoji se izmeri jakost signala analiziranega vzorca in iz kalibracijske krivulje ugotovi koncentracija.
2) Metoda molarnih lastnosti se uporablja v primerih, ko se enačba relacije I = bc upošteva precej strogo. Izmerite analitični signal iz več standardnih vzorcev ali raztopin in izračunajte b=I st /s st; če je c st merjen v mol / l, potem je b molska lastnost.
3) Metoda dodatkov. Izmerimo jakost analitičnega signala vzorca I x , nato pa intenziteto signala vzorca z znanim dodatkom standardne raztopine I x+stt .
4) Metode titracije. Izmerimo intenzivnost analitskega signala I glede na prostornino V dodanega titranta. Po titracijski krivulji I=f (V) se poišče ekvivalentna točka in rezultat izračuna z uporabo običajnih formul titrimetrične analize.
Fizikalno-kemijske analizne metode se pogosto uporabljajo za določanje nizkih vsebnosti (reda 10 -3 % ali manj), kjer klasične kemijske metode analize običajno niso uporabne.
Na področju srednjih in visokih koncentracij kemijske in fizikalno-kemijske metode analize uspešno tekmujejo med seboj in se medsebojno dopolnjujejo. Fizikalne in kemijske metode analize se razvijajo v smeri iskanja novih kemijskih analitskih lastnosti snovi, povečanja natančnosti analize, oblikovanja novih preciznih analitskih instrumentov, izboljšanja obstoječih metod in avtomatizacije analize.
Za določanje motnosti pitne vode se široko uporablja turbidimetrična metoda.
 2.2 Fotometrično določanje motnosti pitne vode s turbidimetrično metodo
2.2 Fotometrično določanje motnosti pitne vode s turbidimetrično metodo
Turbidimetrična metoda se uporablja za analizo suspenzij, emulzij, različnih suspenzij in drugih motnih medijev. Intenzivnost svetlobnega snopa, ki prehaja skozi tak medij, se zmanjša zaradi sipanja in absorpcije svetlobe s suspendiranimi delci.
Turbidimetrične metode temeljijo na merjenju jakosti svetlobe, ki je prešla skozi analizirano suspenzijo.
Glavna prednost turbidimetrične metode je njihova visoka občutljivost, ki je še posebej dragocena glede na elemente ali ione, za katere ni barvnih reakcij.
Ta vrstaŠtudija motnih medijev temelji na merjenju spremembe intenzivnosti toka svetlobne energije, ki je prešla skozi razpršeni sistem. Spremembo pretoka svetlobne energije povzročata tako absorpcija kot njeno razpršitev v razpršenem sistemu. Metoda je podobna kolorimetrični, vendar lahko v nekaterih primerih meritev poteka v toku "bele svetlobe" brez uporabe filtrov.
V smislu občutljivosti metode primerjava nefelometrije in turbidimetrije daje prednost nefelometriji, saj je ta metoda bolj občutljiva, ko majhna količina suspendiranih delcev povzroči opazno povečanje signala z majhnim ozadjem.
Učinek razpršenosti ozadja je bil zmanjšan v številnih instrumentih z odpravo meritev 90° razpršenosti in z elektronskim odštevanjem signalov ozadja (hitrostna nefelometrija).
 Prednost turbidimetrične analize je, da lahko meritve opravimo na skoraj katerem koli kolorimetru ali fotometru. Povečanje občutljivosti turbidimetričnih študij je mogoče doseči z uporabo spektrofotometrov z visokokakovostnimi detektorji.
Prednost turbidimetrične analize je, da lahko meritve opravimo na skoraj katerem koli kolorimetru ali fotometru. Povečanje občutljivosti turbidimetričnih študij je mogoče doseči z uporabo spektrofotometrov z visokokakovostnimi detektorji.
Smeri tokov svetlobne energije, ki pojasnjujejo principe turbidimetričnih študij, so prikazane na sliki.
Kot viri svetlobe se običajno uporabljajo živosrebrne obločne sijalke, volfram-jodne sijalke in helij-neonski laserji. Laserji oddajajo monokromatsko svetlobo, koncentrirano v ozek in intenziven žarek. Vendar so laserji zelo dragi in lahko oddajajo omejen nabor fiksnih valovnih dolžin.
Meritve se izvajajo s fotoelektrokolorimetri, tehnika merjenja pa je podobna tisti pri fotometriji. Za iskanje koncentracije se uporablja metoda kalibracijske krivulje.
Prednost nefelometrične in turbidimetrične metode
je njihova visoka občutljivost, kar je še posebej dragoceno pri določanju elementov, ki ne kažejo barvnih reakcij. Vendar je merilna napaka pri turbidimetričnih metodah nekoliko večja kot pri fotometričnih metodah, kar je povezano s težavami pri pridobivanju suspenzij z enakimi velikostmi delcev, stabilnostjo v času itd. Turbidimetrično določanje sulfatnih ionov temelji na merjenju intenzivnosti motnosti raztopine, ki vsebujejo sulfate pri dodajanju barijevega klorida.
Optična gostota raztopin se meri pri 315 nm. Linearna odvisnost Optična gostota na koncentracijo sulfatov je opažena v območju od 0 - 50 mg / dm 3
Sulfatni ioni se oborijo kot barijev sulfat v klorovodikovem okolju. Za stabilizacijo suspenzije BaSO 4 se v reakcijsko zmes vnese glicerol ali etilen glikol in za zmanjšanje topnosti barijevega sulfata - etanol.
Določanje ovirajo suspendirane, obarvane, opalescentne snovi, pa tudi silicijeva kislina v koncentraciji več kot 200 mg/dmSi, kar je malo verjetno za vode z nizko vsebnostjo sulfatov.
Moteči učinek suspendiranih in koloidnih snovi odpravimo s predhodno filtracijo vzorca skozi membranski filter s premerom por 0,45 µm. Učinek opalescentnih snovi in nizke barve se upošteva z merjenjem intrinzične optične gostote vzorca,
nakisana kislina. Učinek visoke barve zaradi prisotnosti humusnih snovi odpravimo z obdelavo vzorca z aktivnim ogljem.
Možnost obarjanja drugih anionov (karbonatov, fosfatov, sulfitov) z barijevim kloridom med analizo odpravimo z nakisanjem vzorca.
Izmerite intenzivnost katere koli razpršene svetlobe (nefelometrično
varianta) ali svetloba, ki prehaja skozi moten medij (turbidimetrična varianta). Vsebnost sulfatnih ionov določimo z metodo kalibracijske krivulje.
Za pripravo standardne raztopine potrebujete naslednje: raztopino klorovodikove kisline (1:1). 50 cm 3 koncentrirane klorovodikove kisline zmešamo s 50 cm 3 bidestilirane vode. Rešitev je stabilna.
Raztopina barijevega klorida, 5%. 6,2 g barijevega klorida BaCI 2 .2H 2 O raztopimo v 100 cm 3 bidestilirane vode.
oborjevalna raztopina. 50 cm 3 5 % raztopine barijevega klorida zmešamo s 150 cm 3 glicerola ali etilen glikola in 150 cm 3 etilnega alkohola v erlenmajerici s premerom 500 cm 3. Vrednost pH raztopine naravnamo na približno 3 z raztopino klorovodikove kisline 1:1 in pustimo 1-2 dni v temnem prostoru, pri čemer bučko pokrijemo z urnim steklom. Po usedanju oborjevalno raztopino vlijemo v temno bučko z zmletim zamaškom. Če se med usedanjem na dnu bučke tvori oborina, je treba reagens prenesti v bučko previdno, tako da oborina ostane v bučki. Oborinska raztopina je primerna največ 3 mesece.
Za izdelavo kalibracijskega grafa se 0 vnese v merilne bučke s prostornino 50 cm 3 z uporabo graduiranih pipet s prostornino 1, 5 in 10 cm 3; 0,6,; 1,0; 20; 3,0; 4^0; 6,0; 8,0; 10,0 cm 3 raztopine kalijevega sulfata z masno koncentracijo sulfatnih ionov 0,250 mg/cm 3 . Prostornine raztopin prilagodimo oznakam na bučkah z bidestilirano vodo, premešamo. Izračunajte nastale koncentracije. 5 cm vsake od pripravljenih raztopin damo v bučke s prostornino 50 cm 3 in dodamo 1 kapljico raztopine klorovodikove kisline 1:1. Ob neprekinjenem mešanju v vsako bučko vlijemo 5 cm 3 oborine in vsebino mešamo še 10-15 s. Po 40 ± 5 minutah izmerimo absorbanco raztopin v 2 cm kiveti in absorbanco slepega materiala odštejemo od absorbance raztopin, ki vsebujejo sulfate.
Kalibracijska odvisnost je vgrajena v koordinatah: optična gostota - koncentracija sulfatnih ionov v mg/DM 3 in izračunana po metodi najmanjših kvadratov.
Za določanje sulfatnih ionov. V suho bučko odlijemo 5,0 ml analizirane vode
s prostornino 50 ml 3 ali epruveto z brušenim zamaškom s kapaciteto 10-
15 cm dodamo 1 kapljico klorovodikove kisline 1:1 in premešamo.
Po 1-2 minutah ob nenehnem mešanju v bučko vlijemo 5 cm 3 oborjevalne raztopine in nadaljujemo z mešanjem vsebine še 10-15 s. Po 40 g 5 min izmerimo optično gostoto vzorca pri 315 nm v 2 cm dolgi kiveti glede na destilirano vodo. Hkrati se s 5 ml bidestilirane vode analizira slepi vzorec.
Za izračun se izračuna vrednost optične gostote Dx, ki ustreza koncentraciji sulfatov v začetnem vzorcu po formuli:
A \u003d A - Ai -A 2,
kje
A - vrednost optične gostote vzorca, pridobljena med določanjem;
Ai je vrednost intrinzične optične gostote vzorca;
A 2 - vrednost optične gostote slepega vzorca.
Glede na kalibracijsko odvisnost ugotovimo masno koncentracijo sulfatov v analiziranem vzorcu vode, ki ustreza dobljeni vrednosti optične gostote A.
Za določanje sulfatnih ionov so potrebni naslednji reagenti: raztopina klorovodikove kisline (1:1) 50 cm 3 koncentrirane klorovodikove kisline zmešamo s 50 cm 3 bidestilirane vode. Rešitev je stabilna. Raztopina barijevega klorida, 5 % 6,2 g barijevega klorida BaCI 2 .2H 2 O raztopimo v 100 cm 3 bidestilirane vode. Oborjevalna raztopina: 50 cm 3 5 % raztopine barijevega klorida zmešamo s 150 cm 3 glicerola ali etilen glikola in 150 cm 3 etilnega alkohola v erlenmajerici s prostornino 500 cm 3. Vrednost pH raztopine naravnamo na približno 3 z raztopino klorovodikove kisline 1:1 in pustimo 1-2 dni v temnem prostoru, pri čemer bučko pokrijemo z urnim steklom.
Po usedanju oborjevalno raztopino vlijemo v temno bučko z zmletim zamaškom.
Če se med usedanjem na dnu bučke tvori oborina, je treba reagens prenesti v bučko previdno, tako da oborina ostane v bučki. Oborjevalna raztopina je primerna za največ 3 mesece, za izdelavo kalibracijskega grafa pa se 0 vnese v merilne bučke s prostornino 50 cm 3 z uporabo graduiranih pipet s prostornino 1, 5 in 10 cm 3; 0,6,; 1,0; 20; 3,0; 4^0; 6,0; 8,0; 10,0 cm 3 raztopine kalijevega sulfata z masno koncentracijo sulfatnih ionov 0,250 mg/cm 3 . Prostornine raztopin prilagodimo oznakam na bučkah z bidestilirano vodo, premešamo. Izračunajte nastale koncentracije. 5 cm vsake od pripravljenih raztopin damo v bučke s prostornino 50 cm 3 in dodamo 1 kapljico raztopine klorovodikove kisline 1:1. Ob neprekinjenem mešanju v vsako bučko vlijemo 5 cm 3 oborine in vsebino mešamo še 10-15 s. Po 40 ± 5 min izmerimo optično gostoto raztopin v kiveti dolžine 2 cm.
Optična gostota slepega poskusa se odšteje od optične gostote raztopin, ki vsebujejo sulfate.
Turbidimetrično določanje kalcija temelji na precipitaciji kalcija v obliki oksalata in merjenju jakosti svetlobe, prepuščene skozi raztopino, ki vsebuje suspenzijo CaC 2 O 4 . Prisotnost etanola poveča občutljivost metode.
Za določitev kalcija so potrebni naslednji reagenti: kalcijev karbonat CaCO 3 (c), posušen pri 110 °C, amonijev oksalat (NH 4) 2 C 2 O 4 H 2 O, 0,25 M raztopina, klorovodikova kislina HC1, 2M raztopina.
Za pripravo standardne raztopine kalcija se izračuna delež CaCO 3, ki je potreben za pripravo 100 ml začetne standardne raztopine s kalcijevim titrom T Ca = 1 10 ~ 3 g / ml.
 Vzorec CaCO 3, ki je blizu izračunanemu, stehtamo na analitski tehtnici v čaši s prostornino 50 ml in previdno raztopimo v 10 ml raztopine HC1, pri čemer kislino dodajamo postopoma, v majhnih porcijah. Dobljeno raztopino kvantitativno prenesite v 100 ml merilno bučko in jo do oznake razredčite z vodo.
Vzorec CaCO 3, ki je blizu izračunanemu, stehtamo na analitski tehtnici v čaši s prostornino 50 ml in previdno raztopimo v 10 ml raztopine HC1, pri čemer kislino dodajamo postopoma, v majhnih porcijah. Dobljeno raztopino kvantitativno prenesite v 100 ml merilno bučko in jo do oznake razredčite z vodo.
Razredčeno standardno raztopino kalcija s kalcijevim titrom T Ca = 1 10 ~ 4 g/ml (raztopina 2) pripravimo tako, da začetno raztopino 10-krat razredčimo z vodo. Odpipetiramo različne (od 1 do 10 ml) volumne razredčenega standarda dodamo raztopino kalcijeve soli (raztopina 2) in vsebino bučk dovedemo do oznake z vodo. (Raztopine je priporočljivo pripravljati v intervalih 5 minut.
Za povečanje občutljivosti določanja lahko v vsako bučko dodamo 5-10 ml etilnega alkohola.)
Raztopine zmešamo, izmenično vlijemo v kiveto optične naprave (I = 3 cm pri delu na fotoelektričnem kolorimetru) in 5 minut po pripravi izmerimo optično gostoto glede na vodo s filtrom zelene svetlobe. Na podlagi pridobljenih podatkov se zgradi kalibracijski graf v koordinatah optična gostota-koncentracija kalcija.
Za določitev kalcija preskusno raztopino damo v 100 ml merilno bučko, razredčimo do oznake z vodo in dobro premešamo. Odpipetirajte 10 ml dobljene raztopine v merilno bučko s prostornino 50 ml.
Iz birete dodamo 10 ml raztopine amonijevega oksalata, etilnega alkohola (če je bil dodan pri izdelavi kalibracijskega grafa) in z vodo dolijemo raztopino do oznake. 5 minut po pripravi izmerimo optično gostoto in iz grafa ugotovimo koncentracijo kalcija.
raziskana rešitev. Izračunajte maso kalcija v vzorcu preskusne raztopine.
2.3 Reagenti. Materiali. oprema
Fotoelektrokolorimeter KFK-2;
kivete z debelino sloja, ki absorbira svetlobo, 50 in 100 mm;
Laboratorijske tehtnice, razred točnosti 1, 2;
sušilna omara: centrifuga;
Porcelanasti lončki;
Naprava za filtriranje skozi membranske filtre z vodno curkom črpalke;
Odmerjene pipete s prostornino 25 100 ml;
Suspenzija naj vsebuje približno 4 g/dm 3 kaolina Kaolin, obogaten za parfumsko industrijo;
Kalijev pirofosfat
natrijev pirofosfat,
hidrazin sulfat,
heksametidentetramin za monokristale,
živosrebrov klorid,
formalin,
kloroform;
Membranski filtri;
Motnost se določi najkasneje 24 ur po vzorčenju. Vzorec lahko konzerviramo tako, da v 1 liter vode dodamo 2-4 ml kloroforma. Motnost vode določimo fotometrično s primerjavo vzorcev preiskovane vode s standardnimi suspenzijami.
Standardne suspenzije so lahko izdelane iz kaolina ali tripolisa. Standardne raztopine so pripravljene v skladu z vzorcem državnega standarda (GSO - zasnovan za kalibracijo in verifikacijo analitskih instrumentov, nadzor napak merilnih metod (MVI), certificiranje na novo razvitih MVI za vsebnost anionov v vodnem in zračnem okolju, prsti in odpadkih ).
Priprava standardnega vzorca (CO- sestoji iz predhodne priprave kalibracijskih suspenzij iz njega z metodo volumetričnega redčenja). Suspenzije iz CO je treba pripraviti pri temperaturi 20-25 stopinj. Med pripravo suspenzije spremembe temperature niso dovoljene. okolje več kot 20 stopinj.
Prostornino do 50 cm 3 raztopine 2,5 g heksametilentetramina (CH 2) 6 N 4 razredčimo v merilni bučki s prostornino 500 cm 3 v 25 cm 3 destilirane vode 25 cm 3 raztopine A dodana raztopini.
Za pripravo delovnih standardnih suspenzij iz motnega kaolina glavno standardno suspenzijo stresemo in iz nje pripravimo suspenzijo, ki vsebuje 100 mg/dm 3 kaolina. Iz vmesne suspenzije pripravimo delovne suspenzije s koncentracijo 0,5; 1,0; 1,5; 2,0; 3,0; 4,0; 5,0 mg / dm 3. Vmesno suspenzijo in vse delovne suspenzije pripravimo z bidestilirano vodo in hranimo največ en dan.
Za pripravo glavne standardne suspenzije formazina I, ki vsebuje 0,4 ie v 1 cm 3, vzamemo raztopino A. 0,5 g hidrazin sulfata (NH 2 ) 2 H 2 SO 4 raztopimo v destilirani vodi in nastavimo na B in hranimo (24 ± 2) h pri temperaturi (25 ± 5) °C. Nato dodajte destilirano vodo do oznake. Glavna standardna suspenzija formazina je shranjena 2 meseca in ne zahteva konzerviranja in stabilizacije.
Za pripravo standardne suspenzije formazina II, ki vsebuje 0,04 ie na 1 cm 3 raztopine, naredite naslednje: 50 cm 3 temeljito premešane osnovne standardne suspenzije formazina I razredčimo z destilirano vodo do prostornine 500 cm 3 . Standardna suspenzija formazina II je shranjena dva tedna.
Za pripravo delovnih standardnih suspenzij formazina vzemite 2,5; 5,0; 10,0; 20,0 cm 3 vnaprej mešane standardne suspenzije formazina II naravnamo na prostornino 100 cm 3 z bidestilirano vodo.
 2.4 Izvajanje analize
2.4 Izvajanje analize
Za pripravo osnovne standardne suspenzije iz kaolina vzamemo 25-30 g kaolina, ga dobro pretresemo s 3-4 dm 3 destilirane vode in pustimo stati 24 ur Po 24 urah vzamemo neprečiščen del tekočine z sifon. V preostali del ponovno vlijemo vodo, močno pretresemo, pustimo pri miru 24 ur in spet vzamemo srednji neprečiščen del. Ta postopek se ponovi trikrat, pri čemer vsakič dodamo suspenzijo, ki čez dan ni bila očiščena, k predhodno zbrani. Nabrano suspenzijo dobro pretresemo in po treh dneh tekočino nad usedlino odcedimo, saj vsebuje premajhne delce.
Dobljeni oborini dodamo 100 cm 3 destilirane vode, pretresemo in dobimo osnovno standardno suspenzijo. Koncentracijo glavne suspenzije določimo z utežno metodo (vsaj iz dveh vzporednih vzorcev): 5 cm 3 suspenzije damo v lonček, doveden do konstantne teže, posušimo pri temperaturi 105 ° C do konstantne teže, stehtamo in se izračuna vsebnost kaolina na 1 dm 3 suspenzije.
Nato glavno standardno suspenzijo stabiliziramo s kalijevim ali natrijevim pirofosfatom (200 mg na 1 dm 3) in konzerviramo z nasičeno raztopino živosrebrovega klorida (1 cm 3 na 1 dm 3), formalina (10 cm 3 na 1 dm 3) oz. kloroform (1 cm 3 na 1 dm 3).
Glavna standardna suspenzija je shranjena 6 mesecev. To je glavna standardna preskusna voda, iz katere so bile suspendirane trdne snovi odstranjene s centrifugiranjem ali filtracijo skozi membranske filtre.
Za izdelavo kalibracijskega grafa se vzamejo standardna delovna vzmetenja. Dobljene vrednosti optičnih gostot in ustreznih koncentracij standardnih suspenzij (mg/l) se izrišejo na graf.
Pred testiranjem, da bi se izognili napakam, se fotokolorimetri kalibrirajo glede na tekoče standardne suspenzije motnosti ali na niz trdnih standardnih suspenzij motnosti z znano optično gostoto.
Dobro pretresen preskusni vzorec vnesemo v kiveto z debelino sloja, ki absorbira svetlobo 5-10 cm, in izmerimo optično gostoto v zelenem delu spektra. Kontrolna tekočina je preskusna voda, iz katere so bile suspendirane trdne snovi odstranjene s centrifugiranjem ali filtracijo skozi membranske filtre.
2.5 Rezultati ravnanja
Prostornina CO, Vco, cm 3 se izračuna po formuli:
Vco \u003d X * Vk 1Xco
X je vrednost motnosti, pripravljene s suspenzijami, NMF;
Xco - certificirana vrednost motnosti CO, NMF;
Vk - prostornina, ki jo uporablja merilna bučka, cm 3
Raztopina št. 1-1 cm 3 GSO pitna voda do 1000 cm 3
1cm 3 \u003d 4 EMF
Raztopina št. 2-1 cm 3 raztopina št. 1 pitna voda do 1000 cm 3
1 cm 3 \u003d 0,04 UMF
Vcm 3 raztopina št. 2 + pitna voda do 1000 cm 3 à in naredite analizo za KFK-2
Motnost se določi s formulo:
2.6 Zaključek
Pitna voda mora biti epidemično varna, po kemični sestavi neškodljiva in imeti ugodne organoleptične lastnosti.
Kakovost vode je odvisna od njene sestave in lastnosti, ko pride v vodovodno omrežje; na mestih odvzema vode zunanjega in notranjega vodovodnega omrežja.
Mikrobiološki kazalniki. Epidemiološko varnost vode določajo skupno število mikroorganizmov in število bakterij iz skupine Escherichia coli.
Po mikrobioloških kazalcih mora pitna voda ustrezati zahtevam.
Toksikološki kazalniki kakovosti vode označujejo njeno neškodljivost. kemična sestava in vključujejo standarde za snovi:
ki nastanejo kot posledica industrijskega, kmetijskega, gospodinjskega in drugega onesnaženja virov oskrbe z vodo.
Koncentracija kemične snovi ki jih najdemo v naravnih vodah ali dodamo vodi med njeno predelavo, ne smejo presegati standardov.
Organoleptični kazalniki, ki zagotavljajo ugodne organoleptične lastnosti vode, vključujejo standarde za snovi:
najdemo v naravnih vodah;
dodani vodi med predelavo v obliki reagentov;
ki izhajajo iz industrijskih, kmetijskih in onesnaževanje gospodinjstev viri oskrbe z vodo.
 Koncentracije kemikalij, ki vplivajo na organoleptične lastnosti vode, najdene v naravnih vodah ali dodane vodi med njeno predelavo, ne smejo presegati standardov
Koncentracije kemikalij, ki vplivajo na organoleptične lastnosti vode, najdene v naravnih vodah ali dodane vodi med njeno predelavo, ne smejo presegati standardov
Voda ne sme vsebovati vodnih organizmov, vidnih s prostim očesom, in ne sme imeti filma na površini.
Kemične koncentracije , prisotna v vodi kot posledica industrijskega, kmetijskega in gospodinjskega onesnaženja, ne sme presegati MAC, ki ga je odobrilo Ministrstvo za zdravje ZSSR za vodo teles pitne in pitne vode. kulturna in skupnostna raba vode o organoleptičnih in sanitarno-toksikoloških lastnostih ter standardih sevalne varnosti NRB-76/87. Če se v vodi najdejo takšne kemikalije z enakim mejnim znakom škodljivosti, vsota razmerij zaznanih koncentracij v vodi in njihovih MPC ne sme biti večja od 1.
Pitna voda je voda, ki je namenjena za vsakodnevno neomejeno in varno uživanje ljudi in drugih živih bitij. Glavna razlika od menz in mineralne vode je nizka vsebnost soli (suhi ostanek), kot tudi prisotnost obstoječih standardov za splošna sestava in lastnosti.
Preverjajo se vonj, okus, motnost, barva, trdota pitne vode, to je skupno za vse vrste vode.
Motnost vode je indikator, ki označuje zmanjšanje prosojnosti vode zaradi prisotnosti anorganskih in organskih finih suspenzij.
Zaključek: rezultati analize so zadovoljni, saj izpolnjujejo tolerančne standarde (glej prilogo 4).
3. Zaključek
To verjetno vsi vedo Človeško telo Za normalno življenje je najprej potrebna čista pitna voda. Voda je glavno sredstvo za dostavo mikrohranil v vse dele našega telesa. Čista pitna voda je nepogrešljiva v procesih rasti in prehranjevanja telesa, čista pitna voda zagotavlja stabilen temperaturni nivo v telesu, v primeru potrebe pa je voda tista, ki lahko zapolni manjkajoče, a vitalne vire v telesu in jih nekaj časa zamenjajte.
V hitrem tempu našega življenja telo pogosto doživi pomanjkanje vodnega ravnovesja v telesu. To se kaže v blagi žeji, najpogosteje pa zaradi velik grozd zadevah, temu občutku ne posvečamo pozornosti, še posebej, če pri roki ni vira vode. In posledice pomanjkanja tekočine v telesu se zelo žalostno odražajo na našem zdravju: takoj ko telo neha imeti dovolj vode, zaidejo vsi fiziološki cikli, tisti viri, ki jih telo prihrani za »deževen dan« oz. izrednih razmerah. Telo je našlo vodo, a da bi nadoknadilo manjkajoči vir, porabljen za vodo - telo jo poskuša obnoviti čim hitreje in celo z rezervo - od tod dodatna teža "na obrazu", in ne samo na na obrazu, ampak na celem telesu. To ni edina posledica "lahke žeje": mehanizmi prebave, presnove, krvnega obtoka in celo možganska aktivnost. Vse to grozi s prekomernim delom, izgubo pozornosti, glavoboli. Ampak to še ni vse. Če telo v aktivnem obdobju dneva redno ne prejema dovolj vode, to grozi z resnimi okvarami v skoraj vseh telesnih sistemih, posledično pomanjkanje vode ne vodi le do poslabšanja "šibkih točk" v našem telesu, ampak tudi do pojava novih bolezni. Čista voda je, kot že omenjeno, velikega pomena pri človeško življenje, živalsko življenje,  floro in naravo nasploh. Zmogljivost vseh živih celic je odvisna od razpoložljivosti vode. Če raziskujemo vlogo, ki jo ima voda za človeka, lahko ugotovimo, da je naše celotno telo skupek vodnih raztopin, koloidov, suspenzij in drugih zapletenih vodnih sistemov.
floro in naravo nasploh. Zmogljivost vseh živih celic je odvisna od razpoložljivosti vode. Če raziskujemo vlogo, ki jo ima voda za človeka, lahko ugotovimo, da je naše celotno telo skupek vodnih raztopin, koloidov, suspenzij in drugih zapletenih vodnih sistemov.
Voda bogati celice telesa hranila(vitamini, mineralne soli) in odstranjuje odpadne produkte (žlindre). Poleg tega je voda vključena v proces termoregulacije (potenje) in v proces dihanja (človek lahko diha zelo suh zrak, vendar relativno malo časa). Za normalno delovanje vseh sistemov mora oseba piti vsaj 1/5 litra vode na dan.
Posledično je čista voda, ki jo zaužije oseba, potrebna za njegovo pravilno delovanje. Zato je glavno vprašanje naše prehrane redna uporaba vode z vnosom vode v telo v prosti obliki in v hrani ter obvezna uporaba natančno čista voda. Zato je treba pitno vodo prečistiti. Sestavni del, ki čisti vodo in preverja kakovost, je tudi test motnosti pitne vode.
Motnost vode je indikator, ki označuje zmanjšanje preglednosti vode zaradi prisotnosti anorganskih in organskih finih suspenzij ter razvoja planktonskih organizmov. Vzroki za motnost vode so lahko prisotnost peska, gline, anorganskih spojin (hidroksid, aluminij, različni karbonati, kovine), pa tudi organskih nečistoč ali živih bitij, kot je bakterio-fito- ali zooplankton.
Tako v seminarska naloga odraža vrednost kazalnika kakovosti definicija pitne vode motnost.
4. Literatura
povzetki:
Povzetek po disciplini: " Analitična kemija»
Povzetek po disciplini: " Tehnična analiza»
Povzetek po disciplini: "Fizikalne in kemijske metode analize"
Povzetek po disciplini: "Spektralna analiza"
"Osnove tehnične analize". Pisarenko V.V. in Zakharov L, S. Založba " podiplomska šola". Moskva 1972
"Tehnična analiza nadzora". Avgustinovič I.V., Andrianova S.Yu. Moskva. Založniško središče "Akademija" 2010
"Industrijsko usposabljanje laboratorijskih asistentov kemikov". Gurvič Ya.A. Moskva. "Srednja šola" 1987
"Osnove analitične kemije". Knjiga 1. Ivanov V.M. Garmash A.V
Dorolova Yu.A. Moskva. "Srednja šola" 2004
"Analitična kemija". A. A. Iščenko. Moskva. Založniško središče "Akademija" 2012
GOST 3351-74 Pitna voda. Metode za določanje okusa, vonja, barve in motnosti;
GOST 4192-82 Pitna voda. Metode določanja minerali
GOST 2874-82 Pitna voda. Higienske zahteve in nadzor kakovosti vode.
Članki, programi, objave iz analitične kemije.
Chemical Forum Chemforum.ru vsebuje informacije o kemična industrija Rusija in CIS. Je raznoliko informacijsko središče za podjetja v kemični in sorodnih panogah v Rusiji in CIS.
chem.msu.su - na spletnem mestu "Kemijska znanost in izobraževanje v Rusiji": " Digitalna knjižnica v kemiji" - chem.msu.su (razdelek "Gradivo za šolarje") in "Šolsko izobraževanje o kemiji v Rusiji: standardi, učbeniki, olimpijade, izpiti" - chem.msu.su (gradivo za učitelje in šolarje).
school-sector.relarn.ru - "Kemija za VSE" iz serije "Izobraževalne enciklopedije".
 Območna državna avtonomna izobraževalna ustanova
Območna državna avtonomna izobraževalna ustanova
sredina poklicno izobraževanje
"Starooskol Industrial College"
TEČAJNO DELO
V disciplini "Fizikalne in kemijske metode analize"
"Fotometrično določanje motnosti pitne vode s turbidimetrično metodo"
KR. 240308.4979.00.00.PZ
Izpolnil študent Trebunskih Olga Mihajlovna
Skupina AK 44 Posebnost " Analitična kontrola kakovosti kemične spojine »
Zaščiten z oceno _____________
Vodja projekta __________ "___" ________ 2014 Semerdzhieva E.V.
