Максимално допустими концентрации на вредни вещества във водните обекти. MPC във водната среда
Валидност и недействителност на използването на различни списъци с MPC за Отпадъчни водигалванично производство
AT последните годинив Русия има известен растеж промишлено производство, което, от една страна, води до възраждане на галваничното производство, но, от друга страна, се ограничава от високата си опасност за околната среда. Пречиствателните съоръжения на предприятията трябва да служат за намаляване на опасността за околната среда от галваничното производство. Но освен обективни причини (остарели технологии за почистване, лошо състояние на оборудването и др.), съществуват и субективни причини за неефективността на мерките за опазване на околната среда, основните от които са неразумното използване на различни списъци с ПДК и неразумното регионално правило -изработка.
Въз основа на разликата в целите на потреблението на вода и в изискванията на различните потребители на вода към качеството на водните обекти, съществуват както хигиенни, така и екологични стандарти за едни и същи химически замърсители на водата.
Хигиенните ПДК са максималните концентрации на вещества, при които те все още не оказват пряко или косвено въздействие върху здравето на населението (когато са изложени на човешкото тяло през целия живот), а хигиенните условия за използване на водата не се влошават. Хигиенните стандарти регулират съдържанието на замърсители само в тези водни обекти, които се използват за битови и питейни и културни и битови цели, включително за ползване на води за отдих, а не в целия резервоар или в местата за заустване на отпадъчни води, а само в точките на водоползване на население, най-близо до изходните канали. Има две категории домакински и питейни и културно и обществено ползване на водата: първата категория включва използването на воден обект като източник на битово и питейна вода, както и за водоснабдяване на предприятия от питейната промишленост; към втората категория - употребата водни телаза културно-битови нужди на населението, отдих и спорт.
Появата на нови източници на замърсяване и разширяването на тяхната география доведоха до развитието независима системарибарски (екологични) ПДК, насочени към опазване на водните обекти като основа за организирано рибовъдство и риболов. Има две категории използване на рибни води: първата категория включва използването на воден обект за опазване и възпроизводство на ценни рибни видове, които са силно чувствителни към кислород; към втория - използване на воден обект за търговско производство на риба и други водни животни и растения.
Ако водоемът се използва за риболовни цели и водоснабдяване на населението, те се ръководят от най-строгия стандарт.
При приписването на воден обект към определена категория органите на Държавния комитет по рибарство се ръководят от Постановление на Министерския съвет на СССР № 1045 от 15 септември 1958 г., според което: „Всички водоеми и техните принадлежности води, които се използват или могат да се използват за търговско производство на риба и други водни животни и растения или са важни за възпроизводството на търговски рибни запаси, се считат за рибни резервоари. По този начин, в съответствие с такава неоправдано широка дефиниция, всички повърхностни водни тела на такава огромна страна като Русия се класифицират като рибни водни обекти, тоест се предполага, че във всички повърхността на водатапроизведения на Русия са запазени и възпроизвеждани ценни видовериби с висока чувствителност към кислород или се използват за търговско производство на риба и други водни животни и растения. Оказва се, че във всички случаи повърхностните води трябва да се контролират в съответствие с ПДК за водоеми за риболов (ПДК RH).
Освен това, тъй като почти всички изпускатели за отпадъчни води се намират в границите на населено място, в съответствие с правилата и нормите за опазване на повърхностните води, стандартите за максимално замърсяване на водните обекти се прилагат за самите зауствани води, т.е. не се вземат предвид разреждането на отпадъчните води във водата на резервоара и асимилационният капацитет на резервоарите. По този начин качеството на отпадъчните води, зауствани във водните обекти, е предмет на изискванията на списъка на MPC RH навсякъде.
Освен това такива изисквания се налагат не само върху градските отпадни води, зауствани във водни обекти, но и върху отпадните води, влизащи в градската канализация от предприятия. По този начин, не само разреждането на промишлени отпадъчни води от градски битов отпадък, но и прехвърля неефективността на работата на градските пречиствателни станции върху плещите на предприятията. Това необосновано и ненужно затяга изискванията за качеството на отпадъчните води от предприятията и ги забива в задънена улица поради очевидно невъзможното постигане на такива ПДК при използване на стандартни технологии за пречистване на отпадъчни води за галванично производство.
Нека обосноваваме това твърдение.
Практически във всички пречиствателни станции за отпадъчни води от галванично производство се използва реагентният метод. Основните замърсители на такива отпадъчни води са йони на тежки метали. Остатъчната концентрация на йони на тежки метали, изчислена от продукта на разтворимостта на съответните хидроксиди и наблюдавана на практика, е представена в Таблица 1.
Таблица 1. Ефективност на реагентния метод за пречистване на отпадъчни води от тежки метали
| йон на тежки метали | Концентрация на остатъчни метални йони, изчислена от продукта на разтворимост, mg/l | Концентрация на остатъчни метални йони, наблюдавана на практика при pH 8,5-9,0, mg/l | MPC RH, mg/l |
| Fe2+ | 0,44 | 0,3 - 1 | 0,1 |
| Fe3+ | 0,21 10 -4 | 0,3 - 0,5 | 0,1 |
| * Cr3+ | 0,13 10 -2 | 0,05 - 0,1 | 0,07 |
| Cu2+ | 0,024 | 0,1 - 0,15 | 0,001 |
| Ni2+ | 1,47 | 0,25 - 0,75 | 0,01 |
| Zn2+ | 0,17 | 0,05 - 0,1 | 0,01 |
| CD 2+ | 2,62 | 2,5 | 0,005 |
| Ал 3+ | 0,23 10 -3 | 0,1 - 0,5 | 0,04 |
* - не са дадени данни за Cr 6+, т.к на етапа на неутрализиране на отпадъчни води, съдържащи хром, реакцията на химическа редукция на Cr 6+ до Cr 3+ протича напълно.
Ориз. 1. Схема на приложение на различни списъци на ПДК в отпадъчните води
Следователно има три точки по цялата дължина на битовата канализация на всеки град, където към отпадъчните води трябва да се прилагат различни списъци с ПДК (фиг. 1), както е направено в Москва (описано по-долу):
1 - на изхода от предприятието - максималната концентрация вредни веществав отпадъчни води, приети в градската канализация;
2 - преди влизане в градските гари биологично лечение- допустима концентрация на вредни вещества в отпадъчни води, приети за биологично пречистване;
3 - на мястото на заустване на отпадъчни води в естествен водоем в съответствие с неговата категория - или ПДК на вредни вещества във водите на водни обекти за питейни и културни цели, или ПДК във водите на водни обекти с риболовни цели (ПДК RH).
Нека разгледаме използването на различни списъци с ПДК за тежки метали в отпадъчните води, като използваме примера на Москва (фиг. 2).
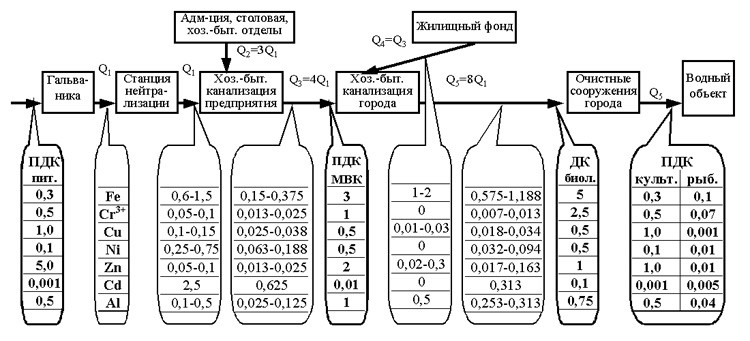
Ориз. Фиг. 2. Схема на промените в концентрацията на йони на тежки метали в отпадъчните води от галваничния цех до водоема
(Q е обемът на отпадъчните води)
В предприятието отпадъчните води от галванично производство (Q 1), съдържащи йони на тежки метали, се подлагат на химическо третиране в станцията за неутрализация, в резултат на което концентрацията на йони на тежки метали достига стойностите, посочени в табл.1. След пречистване отпадъчните води от галванично производство (Q 1) се разреждат с битови отпадъчни води (Q 2) от административни, битови и други звена на предприятието, които не замърсяват отпадните води с йони на тежки метали. По правило обемът на потреблението на вода (водоотвеждане) от галваничното производство е около 25% от общото потребление на вода (водоотвеждане) на предприятието (Q 3). Следователно концентрацията на йони на тежки метали на изхода на предприятието е 4 пъти по-ниска от концентрацията им в галваничните отпадъчни води, преминали през пречиствателни съоръжения. При нормална (проектна) ефективност на пречиствателните съоръжения действителната концентрация на тежки метали в битовата канализация на изхода от предприятието (Q 3) ще бъде: Fe 2+ 0,075-0,250 mg / l, Fe 3+ 0,075- 0,125 mg/l, (Fetotal 0,150-0,375 mg/l), Cr 3+ 0,013-0,025 mg/l, Cu 2+ 0,025-0,038 mg/l, Ni 2+ 0,063-0,188 mg/l, Zn 013- 0,025 mg/l, Cd 2+ 0,625 mg/l, Al 3+ 0,025-0,125 mg/l.
Съгласно „Правилата за приемане на промишлени отпадъчни води в канализационната система на Москва (временна)“ № 127, одобрени с решение на Изпълнителния комитет на Московския съвет от 20 януари 1984 г., Мосводоканал определя следните максимални концентрации на тежки метали в отпадъчните води, приети в градската канализация (на фиг. 2 MPC MVK): Fetot. 3,0 mg/l; Cr 3+ 1,0 mg/l; Cu 2+ 0,5 mg/l; Ni 2+ 0,5 mg/l; Zn 2+ 2,0 mg/l; Cd 2+ 0,01 mg/l; Al 3+ 1,0 mg/l.
Така в Москва отпадъчните води, идващи от предприятия в общинската канализационна система, с нормална (проектна) ефективност на работа на пречиствателни станции за пречистване на отпадъчни води от галванично производство, отговарят на изискванията за MPC (с изключение на кадмий), установени от Мосводоканал . Намаляването на концентрацията на кадмий в отпадъчните води на предприятията в Москва се постига чрез ограничаване на употребата на кадмий в съответствие с Постановление на правителството на Москва № 893 от 05.11.96 г.
В градската битова канализация отпадните води от предприятия (Q 3) се смесват с битови отпадъчни води от жилищния фонд на града (Q 4), в които възможните концентрации на тежки метали са следните стойности: Fetot. 1-2 mg/l; Cr 3+ 0 mg/l; Cu 2+ 0,01-0,03 mg/l; Ni 2+ 0 mg/l; Zn 2+ 0,02-0,3 mg/l; Cd 2+ 0 mg/l; Al 3+ 0,5 mg/l. При условие, че дневният обем на промишлените отпадъчни води може да достигне максимум 50% от общия отпадъчни води на града, концентрацията на тежки метали в смесените отпадъчни води ![]() не е повече от: Fegen. - 0,575-1,188 mg / l; Cr 3+ - 0,007-0,013 mg / l; Cu 2+ - 0,018-0,034 mg / l; Ni 2+ - 0,032-0,094 mg / l; Zn 2+ - 0,017-0,163 mg / l; Cd 2+ - 0,313 mg / l; Al 3+ - 0,253-0,313 mg / l.
не е повече от: Fegen. - 0,575-1,188 mg / l; Cr 3+ - 0,007-0,013 mg / l; Cu 2+ - 0,018-0,034 mg / l; Ni 2+ - 0,032-0,094 mg / l; Zn 2+ - 0,017-0,163 mg / l; Cd 2+ - 0,313 mg / l; Al 3+ - 0,253-0,313 mg / l.
Смесените отпадни води (Q5) с тази концентрация на тежки метали се изпращат към общинските биологични пречиствателни станции. Според правилата за прием индустриална водав канализационни системи селища„Допустимата концентрация на тежки метали в отпадъчните води, приети за биологично пречистване, е: Fetotal 5,0 mg/l; Cr 3+ 2,5 mg/l; Cu 2+ 0,5 mg/l; Ni 2+ 0, 5 mg/l, Zn 2+ 1,0 mg/l, Cd 2+ 0,1 mg/l, Al 3+ 0,75 mg/l и битови отпадъчни води, отговарят на списъка с допустимите концентрации на тежки метали (с изключение на кадмий) за биологично пречистване.
Практиката показва, че в процеса на биологично пречистване на отпадъчни води се наблюдава значително намаляване на концентрацията на йони на тежки метали (с 40-80%) поради адсорбцията им от активна утайка. Но дори и без това да се вземе предвид, градските отпадъчни води (Q 5), съдържащи промишлени и битови отпадъчни води, по отношение на концентрацията на йони на тежки метали, отговарят на изискванията на списъка с ПДК на вредни вещества (с изключение на желязо и кадмий) в питейните водни и културно-битови цели. Превишението на съдържанието на желязо в отпадъчните води над ПДК за културни и битови цели се определя от преобладаващия принос за този излишък от замърсяване с желязо на битови отпадъчни води.
Прилагането на изискванията на списъка на MPC за културни и битови нужди към градските отпадъчни води е логично правилно, изхождайки от тезата: „отпадните води трябва да се контролират по същия списък на MPC, според който водата, доставяна на предприятията и жилищните секторът се контролира”. Освен това MPC ITM в питейната вода (MPCp.) практически съвпада с техните MPC във вода за битови и питейни и културни цели
Като се има предвид факта, че нито река Москва, нито Яуза, нито други реки на Москва, с цялото си желание, могат да бъдат причислени към рибни водни обекти, изискванията на правилата и разпоредбите за защита на повърхностните води от замърсяване от отпадните води от галваничното производство в Москва са доста постижими. За това е необходимо да се осигури нормална работастанции за неутрализиране. Ако обемът на галваничните отпадъчни води надвишава 25% от общия обем на потреблението на вода на предприятието, тогава, за да се изпълнят тези изисквания, е необходимо да се намали консумацията на вода за измиване в цехове за поцинковане и / или да се въведат локални инсталации за изплакване пречистване на водата.
Въпреки това, изискванията на списъка на MPC за рибни резервоари се прилагат универсално за отпадъчни води, зауствани във водни обекти, и дори за отпадъчни води от предприятия, влизащи в градската канализация, което всъщност прави невъзможно изпускането на питейна вода в отпадъчните води без пречистване. Абсурдността на изискванията за пречистване на отпадъчни води от предприятия до чистота, по-дълбока от чистотата пия вода, едва ли може да се съмнява. Днес обаче всички изисквания към предприятията за чистота на отпадните води всъщност (макар и в малко забулена форма) се свеждат до факта, че отпадните води са много по-чисти от водата, доставяна на предприятието. Друг основен контрааргумент на прилагането на MPC за риболовни резервоари към промишлени отпадъчни води е практическата невъзможност да се постигне такава чистота на отпадъчните води по някой от известните методи. „Практичен“ в смисъл, че използването на много методи за последващо пречистване на отпадъчни води прави експлоатацията на промишлените предприятия икономически неоправдана. По този начин самият факт на наличието на галванично производство като част от предприятието го прави нарушител на екологичното законодателство.
Тази ситуация се влошава от доброволното регионално нормотворчество. В много региони изискванията за отпадъчни води от предприятията са много по-строги, отколкото дори ПДК за водоеми за риболов. Например, в съответствие с разпоредбата "Инструкции за регулиране на емисиите (изпусканията) на замърсители в атмосферата и във водните обекти", одобрена от заместник-председателя на Госкомприрода на СССР на 11 септември 1989 г., ако действителното изхвърляне на вещества с отпадъчни води е по-малко от изчисленото максимално допустимо заустване (MPD), тогава действителното заустване се приема като PDS (клауза 3.4). Тази разпоредба се тълкува от регионалните органи по опазване на околната среда по ясен начин, без да се отчита основната цел за установяване на стандарти за MPD - недопустимостта на превишаване на установената MPC нормативни документифедерално ниво или ако те са превишени под въздействието на естествени фактори за запазване (не влошаване) на състава и свойствата на водата от естествен резервоар. Поради това регионалните власти си позволяват да установят стандарти за качество на отпадните води на предприятията на ниво практически чиста вода, например, ако по време на вземане на проби в предприятието по някаква причина (престой в производството, ремонт на оборудване и др.) не се образуват замърсени отпадъчни води. Подобни действия на регионалните органи по опазване на околната среда за създаване на ДПВ, включително тези, основани на принципа „от постигнатото ниво“ (например в резултат на повишаване на ефективността на пречиствателните съоръжения), влияят негативно на интереса на предприятията за подобряване на качеството на отпадъчните води. лечение.
Регионалната инициатива за определяне на стандарти за качество на отпадъчните води често стига до абсурд. Така например в град Калуга ПДК на цинк в отпадъчните води, изпратени в битовата канализация, е 3 пъти по-малък от ПДК на цинк в отпадъчните води. дъждовна канализация. И това е с оглед на факта, че дъждовни каналисе заустват директно в река Ока и преди да бъдат зауствани в естествен водоем, битовите отпадъчни води се разреждат с битови отпадъчни води от градски жилищни сгради и се пречистват в градски пречиствателни съоръжения.
Като пример в Таблица 2 са дадени сравнителни данни за ПДК на йони на тежки метали в отпадъчни води, зауствани от предприятия в градските канализации, използвани в различни страни и градове.
Представената таблица показва, че не само нашите съображения, описани по-горе, но и практиката на други страни показват изключителната неразумна твърдост на изискванията за качеството на отпадъчните води от руски предприятия. И това въпреки факта, че въпреки хиляди пъти по-малко строги изисквания в Европа и Съединените щати (табл. 2), в последните десетилетияимаше съживяване на река Рейн и рязко намаляване на замърсяването на Големите американски езера, където вече е разрешен търговски риболов, а у нас, дори като се вземе предвид спада на промишленото производство, няма значителен напредък в подобряването на състоянието на водните ресурси.
Таблица 2. ПДК на тежки метали в отпадъчни води, зауствани от предприятия в градска канализация, използвани в различни страни и градове
| Селски град | Cu2+ | Zn2+ | Ni2+ | Cr3+ | Fe (общо) |
| САЩ | 2,07 | 1,48 | 2,38 | - | - |
| Германия | 0,5 | 2 | 0,5 | - | 3 |
| Австрия | 0,5 | 2 | 0,5 | 0,5 | - |
| Европейски съюз, ЕС | 0,5 | 0,5 | 0,5 | 0,5 | - |
| Литва | 1 | 1 | 0,5 | 1 | - |
| Беларус, Минск | 1 | 5 | 0,44 | 2,5 | 3,3 |
| руската федерация | |||||
| Киржач | 0,0001 | 0,001 | 0,001 | 0,014 | 0,006 |
| Калуга | 0,0026 | 0,0036 | 0,012 | 0,029 | 1,98 |
| Мценск | 0,0009 | 0,04 | 0,028 | 0,01 | 0,1 |
| Тула | 0,0125 | 0,06 | 0,04 | 0,1 | 3,0 |
| Казан | 0,08 | 0,066 | 0,01 | 0,4 | 0,6 |
| орел | 0,01 | 0,08 | 0,06 | 3,6 | 1 |
| Ижевск | 0,23 | 0,21 | 0,04 | 1,35 | 0,4 |
| Сергиев Посад | 0,73 | 0,11 | 0,14 | 2,4 | 1,2 |
| Москва | 0,5 | 2 | 0,5 | 1 | 3 |
| MPC за питейна вода | 1 | 5 | 0,1 | 0,5 | 0,3 |
| ПДК за водоеми за битово и питейно и културно-битово водоползване | 1 | 1 | 0,1 | 0,5 | 0,3 |
| MPC за риболовни резервоари | 0,001 | 0,01 | 0,01 | 0,07 | 0,1 |
Следователно въпросът не е в действителното намаляване на ПДК в промишлените отпадъчни води, а в различен подход за поддържане на качеството заобикаляща среда. В повечето индустриализирани страни предприятието ползвател на вода е установило такива стандарти за качество на отпадъчните води, които може да отговаря на съществуващите съоръжения за пречистване на отпадъчни води, и тези стандарти са еднакви за всички съоръжения от определен тип и капацитет. следователно, установени стандартиса доста постижими и целят всички (без изключение) водоползватели да не превишават установените норми и да носят отговорност за нарушенията им. Освен това, когато се продава в пречиствателни станции за отпадъчни води, повече от ефективни технологиипредприятията за почистване са обект на стимули и данъчни облекчения, което прави бизнеса заинтересована страна в екологичните действия.
Фундаментална невъзможност за изпълнение регулаторни изискванияза качеството на отпадъчните води в регионите на Руската федерация, дори когато се прилагат най-много съвременни технологиипочистването превръща почти 100% от предприятията в нарушители на естественото право и напълно ги лишава от стимула за подобряване на екологичната ситуация. Неоправдано строги и нереалистични изисквания, несправедливи такси за замърсяване, глоби и санкции поставят предприятията на ръба на фалита.
Всичко това предполага, че е необходима съществена промяна на системата за качество на водите и управление на водните ресурси на федерално и регионално ниво, както и законодателството за водите. Този въпрос многократно е повдиган в пресата, включително на страниците на списанията "Водоснабдяване и санитарно инженерство" и
Вредните елементи са стандартът на санитарните и хигиенните правила, установени с държавни актове. Неспазването на пределните стойности, посочени в него, е нарушение, за което нарушителите носят отговорност съгласно закона. Стандартът MPC във вода дава указания за тези гранични стойности на замърсители, чието съдържание не води до увреждане на човешкото здраве или живот.
Основните източници на токсични елементи са множество функциониращи предприятия от промишления комплекс. Техните емисии са достатъчно силни за почвата и водата. Химически елементи, които имат негативно влияниена заобикалящата ни среда е прието да се разделят на групи в зависимост от степента на тяхната опасност за хората. Те включват опасни вещества:
спешен случай;
Високо;
умерено.
Има и група опасни елементи.
ПДК в различни води са отразени в специално разработени таблици. Има и различни формули, чието използване ви позволява да изчислите ограничаване на толерантносттатоксини. Те се използват от специалисти за извършване на мерки за контрол на водата, използвана от хората. Такива действия могат да бъдат извършени от всеки от нас. За да направите това, достатъчно е да анализирате състоянието на питейната вода в дома си и да го сравните приемливи стандартида бъдеш в него различни елементи. Например, съдържанието в милиграми на литър не трябва да бъде по-високо от:
Сух остатък - 1000;
Сулфати - 500;
Хлориди - 350;
Цинк - 5;
Желязо - 0,3;
Манган - 0,1;
Остатъчни полифосфати - 3,5.
Общата сума не трябва да надвишава седем милиграма на литър.
Голямо значениесъщо така има контрол върху състоянието на почвата. Това е земята, която служи като акумулатор и филтър за различни връзки. ПДК, които постоянно се изхвърлят в почвата, също трябва да отговарят на стандартите, тъй като постоянна миграция в нея горни слоевесилно замърсява цялата околна среда.
Според почвата не може да бъде повече от:
0,02 mg/kg бензапирен;
3 mg/kg мед;
130 mg/kg нитрати;
0,3 mg/kg толуен;
23 mg/kg цинк.
При превишаване на ПДК във водата органите, участващи в мониторинга на състоянието на околната среда, ще установят причината за това явление. Доста често, при увеличаване на количеството в природата химични веществазасегнати от обикновените битови отпадъци. В момента проблемът с почистването на водни тела от фосфатни и азотни съединения е особено остър. За решаването на този проблем могат да се използват три различни подхода:
химически;
Биологични;
Комбинация от първите два метода.
Довеждане до стандартната стойност на MPC при използване на вода химическо почистваневключва образуването на метални фосфати, които, тъй като са неразтворими, се утаяват на дъното специален контейнер. Този процес се осъществява с помощта на реагенти. С помощта на химическия метод за почистване намира широко приложениена промишлени предприятия. Тази работа може да се извършва само от специално обучен персонал.
Ако при пречистването на водата се използват фосфор или P-бактерии, тогава този метод е биологичен. Това е модерен естествен подход за предотвратяване на излишък от MPC. Специалните зони на резервоарите за обработка се доставят последователно с аеробни и анаеробни бактерии. Този метод се използва в биофилтри, септични ями и аерационни резервоари.
Комбинацията от биологични и химични методиизползва се в пречиствателни системи, където има нужда от ускоряване и засилване на реакциите на разлагане на отпадъчни води.
Много опасни токсични вещества. В днешно време мониторингът на нивата на различни такива вещества е особено важен в индустриални и градски зони.
Въпреки че всеки знае какво представляват тежките метали, не всеки знае кои химически елементи все още попадат в тази категория. Има много критерии, по които различните учени определят тежките метали: токсичност, плътност, атомна маса, биохимични и геохимични цикли, разпространение в природата. Според един критерий тежките метали включват арсен (металоид) и бисмут (крехък метал).
Общи факти за тежките метали
Известни са повече от 40 елемента, които се класифицират като тежки метали. Те имат атомна маса по-голяма от 50 a.u. Колкото и странно да изглежда, тези елементи са силно токсични дори при ниска кумулация за живите организми. V, Cr, Mn, Fe, Co, Ni, Cu, Zn, Mo...Pb, Hg, U, Th... всички те попадат в тази категория. Дори и с тяхната токсичност, много от тях са важни освен кадмий, живак, олово и бисмут, за които не е открита биологична роля.
Според друга класификация (а именно N. Reimers), тежките метали са елементи, които имат плътност по-голяма от 8 g / cm 3. По този начин ще има по-малко от тези елементи: Pb, Zn, Bi, Sn, Cd, Cu, Ni, Co, Sb.
Теоретично тежките метали могат да се нарекат цялата периодична таблица на елементите, започвайки с ванадий, но изследователите ни доказват, че това не е съвсем вярно. Такава теория се дължи на факта, че не всички от тях присъстват в природата в токсични граници и объркването в биологичните процеси е минимално за много. Ето защо много от тях включват само олово, живак, кадмий и арсен в тази категория. Икономическата комисия на ООН за Европа не е съгласна с това мнение и счита, че тежките метали са цинк, арсен, селен и антимон. Същият Н. Реймърс смята, че чрез премахването на редки и благородни елементи от периодичната таблица остават тежките метали. Но това също не е правило, други добавят злато, платина, сребро, волфрам, желязо, манган към този клас. Затова ти казвам, че все още не е ясно по тази тема...
Обсъждане на баланса на йони различни веществав разтвор ще открием, че разтворимостта на такива частици е свързана с много фактори. Основните фактори на разтваряне са pH, наличието на лиганди в разтвора и редокс потенциал. Те участват в процесите на окисление на тези елементи от едно окислително състояние в друго, при което разтворимостта на йона в разтвор е по-висока.
В зависимост от естеството на йоните в разтвора могат да възникнат различни процеси:
- хидролиза,
- комплексиране с различни лиганди;
- хидролитична полимеризация.
Поради тези процеси йоните могат да се утаят или да останат стабилни в разтвор. От това зависят каталитичните свойства на даден елемент и неговата достъпност за живите организми.
Много тежки метали образуват доста стабилни комплекси с органични вещества. Тези комплекси са част от механизма на миграция на тези елементи в езерата. Почти всички хелати на тежки метали са стабилни в разтвор. Също така, комплекси от почвени киселини със соли различни метали(молибден, мед, уран, алуминий, желязо, титан, ванадий) имат добра разтворимост в неутрална, слабо алкална и слабо кисела среда. Този факт е много важен, тъй като такива комплекси могат да се движат в разтворено състояние дълги разстояния. Най-уязвимите водни ресурси са нискоминерализирани и повърхностни водни тела, където не се образуват други подобни комплекси. За да се разберат факторите, които регулират нивото на химичен елемент в реките и езерата, тяхната химическа реактивност, бионаличност и токсичност, е необходимо да се знае не само общото съдържание, но и съотношението на свободните и свързаните форми на метала.
В резултат на миграцията на тежки метали в метални комплекси в разтвор могат да възникнат следните последици:
- Първо, натрупването на йони на химичен елемент се увеличава поради прехода им от дънни седименти към естествени разтвори;
- Второ, има възможност за промяна на пропускливостта на мембраната на получените комплекси, за разлика от конвенционалните йони;
- Също така, токсичността на елемент в сложната форма може да се различава от обичайната йонна форма.
Например, кадмий, живак и мед в хелатни форми имат по-малко токсичност от свободните йони. Ето защо е погрешно да се говори за токсичност, бионаличност, химическа реактивност само чрез общото съдържание на определен елемент, без да се отчита съотношението на свободните и свързаните форми на химичен елемент.
Откъде идват тежките метали в нашата среда? Причините за наличието на такива елементи могат да бъдат отпадни води от различни промишлени съоръжениязанимава се с черна и цветна металургия, машиностроене, поцинковане. Някои химикали се намират в пестицидите и торовете и по този начин могат да бъдат източник на замърсяване на местните езера.
И ако влезете в тайните на химията, тогава основният виновник за повишаването на нивото на разтворимите соли на тежките метали е киселинният дъжд (подкиселяване). Намаляването на киселинността на околната среда (понижаване на pH) води до прехода на тежките метали от лошо разтворими съединения (хидроксиди, карбонати, сулфати) към по-лесно разтворими (нитрати, хидросулфати, нитрити, бикарбонати, хлориди) в почвата решение.
ванадий (V)
Преди всичко трябва да се отбележи, че замърсяването с този елемент по естествен път е малко вероятно, тъй като този елемент е много разпръснат в земната кора. В природата се среща в асфалти, битуми, въглища, железни руди. Нефтът е важен източник на замърсяване.
Съдържанието на ванадий в естествените резервоари
Естествените резервоари съдържат незначително количество ванадий:
- в реките - 0,2 - 4,5 mcg / l,
- в моретата (средно) - 2 µg/l.
Анионните комплекси (V 10 O 26) 6- и (V 4 O 12) 4- са много важни в процесите на преход на ванадий в разтворено състояние. Разтворимите ванадиеви комплекси с органични вещества, като хуминови киселини, също са много важни.
Максимално допустима концентрация на ванадий за водната среда
Ванадий във високи дози е много вреден за хората. Максимално допустимата концентрация за водната среда (ПДК) е 0,1 mg/l, а в езерата за рибарство ПДК на рибовъдното стопанство е още по-ниска – 0,001 mg/l.
бисмут (Bi)
Основно бисмутът може да навлезе в реки и езера в резултат на процесите на излугване на минерали, съдържащи бисмут. Съществуват и изкуствени източници на замърсяване с този елемент. Това могат да бъдат стъклени, парфюмни и фармацевтични фабрики.
Съдържанието на бисмут в естествените резервоари
- Реките и езерата съдържат по-малко от микрограм бисмут на литър.
- И тук Подземните водиможе да съдържа дори 20 µg/l.
- В моретата бисмутът, като правило, не надвишава 0,02 µg/l.
Максимално допустима концентрация на бисмут за водната среда
Максимално допустимата концентрация на бисмут за водната среда е 0,1 mg/l.
желязо (Fe)
Желязо - химичен елементне рядко, той се съдържа в много минерали и скали и по този начин в естествените резервоари нивото на този елемент е по-високо от другите метали. Може да възникне в резултат на атмосферни процеси. скали, разрушаване на тези скали и разтваряне. Образувайки различни комплекси с органични вещества от разтвор, желязото може да бъде в колоидно, разтворено и суспендирано състояние. Невъзможно е да не споменем антропогенните източници на замърсяване с желязо. Отпадъчните води от металургични, металообработващи, бои и лакове и текстилни фабрики понякога излизат извън мащаба поради излишък на желязо.
Количеството желязо в реките и езерата зависи от химичен съставразтвор, pH и частично температура. Претеглените форми на железни съединения имат размер над 0,45 μg. Основните вещества, които са част от тези частици, са суспензии със сорбирани железни съединения, хидрат на железен оксид и други желязосъдържащи минерали. По-малките частици, т.е. колоидни форми на желязо, се разглеждат заедно с разтворените железни съединения. Желязото в разтворено състояние се състои от йони, хидроксокомплекси и комплекси. В зависимост от валентността се забелязва, че Fe(II) мигрира в йонна форма, докато Fe(III) остава в разтворено състояние при отсъствие на различни комплекси.
В баланса на железните съединения във воден разтвор ролята на окислителните процеси, както химически, така и биохимични (железни бактерии), също е много важна. Тези бактерии са отговорни за прехода на железните йони на Fe(II) в състояние на Fe(III). Железните съединения са склонни да хидролизират и утаяват Fe(OH) 3 . Както Fe(II), така и Fe(III) са склонни да образуват хидроксо комплекси от типа - , + , 3+ , 4+ , +, в зависимост от киселинността на разтвора. AT нормални условияв реките и езерата Fe(III) се свързва с различни разтворени неорганични и органични вещества. При рН по-голямо от 8, Fe(III) се трансформира в Fe(OH) 3 . Колоидните форми на съединенията на желязото са най-малко проучени.
Съдържание на желязо в естествените води
В реките и езерата нивото на желязото се колебае на ниво n * 0,1 mg/l, но може да се повиши в близост до блата до няколко mg/l. В блатата желязото е концентрирано под формата на хуматни соли (соли на хуминови киселини).
Подземните резервоари с ниско pH съдържат рекордни количества желязо - до няколкостотин милиграма на литър.
Желязото е важен микроелемент и от него зависят различни важни биологични процеси. Той влияе върху интензивността на развитие на фитопланктона и от него зависи качеството на микрофлората във водните обекти.
Нивото на желязо в реките и езерата е сезонно. Най-високите концентрации във водните обекти се наблюдават през зимата и лятото поради стагнация на водата, но през пролетта и есента нивото на този елемент забележимо намалява поради смесване на водни маси.
По този начин голямо количество кислород води до окисляване на желязото от двувалентна форма в тривалентна форма, образувайки железен хидроксид, който се утаява.
Максимално допустима концентрация на желязо за водната среда
Водата с голямо количество желязо (повече от 1-2 mg / l) се характеризира с лоша вкусови качества. Има неприятен стипчив вкус и е неподходящ за промишлени цели.
ПДК на желязо за водната среда е 0,3 mg/l, а в рибарските езера ПДК на рибовъдните стопанства е 0,1 mg/l.
кадмий (Cd)
Замърсяване с кадмий може да възникне при излужване на почвата, по време на разлагането на различни микроорганизми, които го натрупват, а също и поради миграция от медни и полиметални руди.
Човекът също е виновен за замърсяването с този метал. Отпадъчните води от различни предприятия, занимаващи се с обогатяване на руда, галванично, химическо, металургично производство, могат да съдържат големи количества кадмиеви съединения.
Естествени процеси за намаляване нивото на кадмиевите съединения са сорбция, консумацията му от микроорганизми и утаяване на слабо разтворим кадмиев карбонат.
В разтвор кадмият, като правило, е под формата на органо-минерални и минерални комплекси. Сорбираните вещества на базата на кадмий са най-важните суспендирани форми на този елемент. Миграцията на кадмий в живите организми (хидробионитите) е много важна.
Съдържание на кадмий в естествените водоеми
Нивото на кадмий в чистите реки и езера се колебае на ниво по-малко от микрограм на литър, в замърсени води нивото на този елемент достига няколко микрограма на литър.
Някои изследователи смятат, че кадмият, в малки количества, може да бъде важен за нормалното развитие на животните и хората. Повишените концентрации на кадмий са много опасни за живите организми.
Максимално допустима концентрация на кадмий за водната среда
ПДК за водната среда не надвишава 1 μg/l, а в рибарските езера ПДК за рибовъдни стопанства е под 0,5 μg/l.
кобалт (Co)
Реките и езерата могат да бъдат замърсени с кобалт в резултат на извличане на медни и други руди, от почви при разлагането на изчезнали организми (животни и растения) и разбира се, в резултат на дейността на химически, металургични и металообработващи предприятия .
Основните форми на кобалтовите съединения са в разтворено и суспендирано състояние. Различия между тези две състояния могат да възникнат поради промени в pH, температурата и състава на разтвора. В разтворено състояние кобалтът се намира под формата на органични комплекси. Реките и езерата имат характеристиката, че кобалтът е представен от двувалентен катион. В присъствието на Голям бройокислители в разтвор, кобалтът може да се окисли до тривалентен катион.
Той е част от растенията и животните, защото играе важна роляв тяхното развитие. Той е един от основните микроелементи. Ако има дефицит на кобалт в почвата, тогава нивото му в растенията ще бъде по-малко от обикновено и в резултат на това могат да се появят здравословни проблеми при животните (има риск от анемия). Този факт се наблюдава особено в тайго-горската нечерноземна зона. Той е част от B 12, регулира усвояването на азотни вещества, повишава нивото на хлорофил и аскорбинова киселина. Без него растенията не могат да растат необходимата сумакатерица. Както всички тежки метали, той може да бъде токсичен големи количества.
Съдържанието на кобалт в естествените води
- Нивата на кобалт в реките варират от няколко микрограма до милиграма на литър.
- В моретата средното ниво на кадмий е 0,5 µg/l.
Максимално допустима концентрация на кобалт за водната среда
ПДК за кобалт за водната среда е 0,1 mg/l, а в рибарските езера ПДК за рибни стопанства е 0,01 mg/l.
манган (Mn)
Манганът навлиза в реките и езерата чрез същите механизми като желязото. Основно освобождаването на този елемент в разтвор се случва при излугването на минерали и руди, които съдържат манган (черна охра, браунит, пиролузит, псиломелан). Манганът може да дойде и от разлагането на различни организми. Мисля, че индустрията има най-голямата роля в замърсяването с манган (отпадъчни води от мини, химическа индустрия, металургия).
Настъпва намаляване на количеството на усвояемия метал в разтвора, както в случая на други метали при аеробни условия. Mn(II) се окислява до Mn(IV), в резултат на което се утаява под формата на MnO 2 . Важни факторипри такива процеси се вземат предвид температурата, количеството разтворен кислород в разтвора и рН. Намаляване на разтворения манган в разтвора може да настъпи, когато се консумира от водорасли.
Манганът мигрира главно под формата на суспензии, които по правило показват състава на околните скали. Съдържат го като смес с други метали под формата на хидроксиди. Преобладаването на манган в колоидна и разтворена форма показва, че той е свързан с органични съединенияобразуване на комплекси. Стабилни комплекси се наблюдават със сулфати и бикарбонати. С хлора манганът образува комплекси по-рядко. За разлика от други метали, той е по-слабо задържан в комплекси. Тривалентният манган образува такива съединения само в присъствието на агресивни лиганди. Други йонни форми (Mn 4+, Mn 7+) са по-малко редки или изобщо не се срещат при нормални условия в реки и езера.
Съдържание на манган в естествените водоеми
Моретата се считат за най-бедни на манган - 2 μg / l, в реките съдържанието му е по-високо - до 160 μg / l, но подземните резервоари са шампиони този път - от 100 μg до няколко mg / l.
Манганът се характеризира със сезонни колебания в концентрацията, подобно на желязото.
Идентифицирани са много фактори, които влияят върху нивото на свободния манган в разтвора: връзката на реките и езерата с подземни резервоари, наличието на фотосинтетични организми, аеробни условия, разлагане на биомаса (мъртви организми и растения).
Важна биохимична роля на този елемент, тъй като е включен в групата на микроелементите. Много процеси се инхибират при недостиг на манган. Увеличава интензивността на фотосинтезата, участва в азотния метаболизъм, предпазва клетките от отрицателно въздействие Fe(II), докато го окислява до тривалентна форма.
Максимално допустима концентрация на манган за водната среда
ПДК за манган за резервоари - 0,1 mg/l.
мед (Cu)
Нито един микроелемент няма толкова важна роля за живите организми! Медта е един от най-търсените микроелементи. Той е част от много ензими. Без него почти нищо не работи в живия организъм: синтезът на протеини, витамини и се нарушава. Без него растенията не могат да се размножават. Все пак прекомерното количество мед причинява голяма интоксикация при всички видове живи организми.
Ниво на мед в естествените води
Въпреки че медта има две йонни форми, Cu(II) се среща най-често в разтвор. Обикновено Cu(I) съединенията са трудно разтворими в разтвор (Cu 2 S, CuCl, Cu 2 O). В присъствието на всякакви лиганди могат да възникнат различни акваионни медни съединения.
С днешното високо използване на медта в промишлеността и селско стопанство, този метал може да причини замърсяване на околната среда. Химически, металургични заводи, мини могат да бъдат източници на отпадни води с високо съдържание на мед. Процесите на ерозия на тръбопроводите също допринасят за замърсяването с мед. Най-важните минерали с високо съдържание на мед са малахит, борнит, халкопирит, халкоцит, азурит, бронтантин.
Максимално допустима концентрация на мед за водната среда
ПДК на медта за водната среда се счита за 0,1 mg/l, а в рибарниците ПДК на медното рибовъдно стопанство се намалява до 0,001 mg/l.
молибден (Mo)
По време на излугването на минерали с високо съдържание на молибден, различни връзкимолибден. Високо нивомолибден може да се види в реки и езера, които са в близост до обогатителни фабрики и предприятия за цветна металургия. Поради различни процеси на утаяване на трудно разтворими съединения, адсорбция на повърхността различни породи, както и използването на водни водорасли и растения, количеството му може значително да намалее.
Най-вече в разтвор, молибденът може да бъде под формата на MoO 4 2- анион. Има възможност за наличие на молибден-органични комплекси. Поради факта, че по време на окисляването на молибденита се образуват насипни фино диспергирани съединения, нивото на колоиден молибден се повишава.
Съдържанието на молибден в естествените резервоари
Нивата на молибден в реките варират между 2,1 и 10,6 µg/l. В моретата и океаните съдържанието му е 10 mcg / l.
При ниски концентрации молибденът подпомага нормалното развитие на организма (както растителен, така и животински), тъй като е включен в категорията на микроелементите. Той също е интегрална частразлични ензими като ксантин оксилаза. При липса на молибден възниква дефицит на този ензим и по този начин могат да възникнат негативни ефекти. Излишъкът от този елемент също не е добре дошъл, тъй като нормалният метаболизъм е нарушен.
Максимално допустима концентрация на молибден за водната среда
ПДК за молибден в повърхностните водни обекти не трябва да надвишава 0,25 mg/l.
арсен (като)
Замърсени с арсен са предимно райони, които са в близост до минерални мини с високо съдържание на този елемент (волфрам, медно-кобалт, полиметални руди). Много малко количество арсен може да се появи по време на разлагането на живите организми. Благодарение на водните организми, той може да се абсорбира от тях. В периода на бързо развитие на планктона се наблюдава интензивно усвояване на арсен от разтвора.
Най-важните замърсители с арсен се считат за обогатителна промишленост, предприятия за производство на багрила, както и селското стопанство.
Езерата и реките съдържат арсен в две състояния: суспендиран и разтворен. Пропорциите между тези форми могат да варират в зависимост от рН на разтвора и химичния състав на разтвора. В разтворено състояние арсенът може да бъде тривалентен или петвалентен, като влиза в анионни форми.
Нива на арсен в естествените води
В реките, като правило, съдържанието на арсен е много ниско (на ниво µg/l), а в моретата - средно 3 µg/l. някои минерална водаможе да съдържа големи количества арсен (до няколко милиграма на литър).
По-голямата част от арсена може да съдържа подземни резервоари - до няколко десетки милиграма на литър.
Неговите съединения са силно токсични за всички животни и за хората. В големи количества се нарушават процесите на окисление и транспортиране на кислород до клетките.
Максимално допустима концентрация на арсен за водната среда
ПДК за арсен за водната среда е 50 µg/l, а в езерата за рибарство ПДК за рибни стопанства също е 50 µg/l.
никел (Ni)
Съдържанието на никел в езерата и реките се влияе от местните скали. Ако в близост до резервоара има находища на никел и желязо-никелови руди, концентрацията може да бъде дори по-висока от нормалната. Никелът може да влезе в езера и реки, когато растенията и животните се разлагат. Синьо-зелените водорасли съдържат рекордни количества никел в сравнение с други растителни организми. Важни отпадъчни води с високо съдържание на никел се отделят при производството на синтетичен каучук, по време на процесите на никелиране. Никелът също се отделя в големи количества при изгарянето на въглища и нефт.
Високото pH може да доведе до утаяване на никел под формата на сулфати, цианиди, карбонати или хидроксиди. Живите организми могат да намалят нивото на подвижния никел, като го консумират. Важни са и процесите на адсорбция върху скалната повърхност.
Водата може да съдържа никел в разтворена, колоидна и суспендирана форма (балансът между тези състояния зависи от pH на средата, температурата и състава на водата). Железният хидроксид, калциевият карбонат, глината адсорбират добре никел-съдържащите съединения. Разтвореният никел е под формата на комплекси с фулвови и хуминови киселини, както и с аминокиселини и цианиди. Ni 2+ се счита за най-стабилната йонна форма. Ni 3+ обикновено се образува при високо pH.
В средата на 50-те години никелът е добавен към списъка с микроелементи, тъй като играе важна роля в различни процесикато катализатор. В ниски дози има положителен ефект върху хемопоетичните процеси. Големите дози все още са много опасни за здравето, тъй като никелът е канцерогенен химичен елемент и може да провокира различни заболявания на дихателната система. Свободният Ni 2+ е по-токсичен, отколкото под формата на комплекси (приблизително 2 пъти).
Ниво на никел в естествените води
Максимално допустима концентрация на никел за водната среда
ПДК за никел за водната среда е 0,1 mg/l, но в езера за рибарство ПДК за рибовъдни стопанства е 0,01 mg/l.
калай (Sn)
Естествени източници на калай са минерали, които съдържат този елемент (станин, каситерит). Антропогенни източници са заводи и фабрики за производство на различни органични бои и металургичната промишленост, работещи с добавка на калай.
Калайът е нискотоксичен метал, поради което не рискуваме здравето си, като ядем храна от консервиран метал.
Езерата и реките съдържат по-малко от микрограм калай на литър вода. Подземните резервоари могат да съдържат няколко микрограма калай на литър.
Максимално допустима концентрация на калай за водната среда
ПДК на калай за водна среда - 2 mg/l.
живак (Hg)
главно, повишено нивоживак във водата се вижда в райони, където има находища на живак. Най-разпространените минерали са жива камък, цинобър, метацинабарит. Отпадъчните води от фармацевтични, пестицидни и багрилни фабрики могат да съдържат значителни количества живак. Друг важен източник на замърсяване с живак е топлоелектрически централи(които използват въглища като гориво).
Нивото му в разтвора намалява основно поради морски животни и растения, които натрупват и дори концентрират живак! Понякога съдържанието на живак в морския живот се повишава няколко пъти по-високо, отколкото в морската среда.
Естествената вода съдържа живак в две форми: суспендиран (под формата на сорбирани съединения) и разтворен (комплексни, минерални съединения на живака). В определени области на океаните живакът може да се появи като метилживачни комплекси.
Живакът и неговите съединения са силно токсични. При високи концентрации има отрицателен ефект върху нервна система, провокира промени в кръвта, повлиява секрецията на храносмилателния тракт и двигателната функция. Продуктите от преработката на живак от бактерии са много опасни. Те могат да синтезират органични вещества на базата на живак, които са в пъти по-токсични от неорганичните съединения. Когато ядем риба, живачните съединения могат да влязат в тялото ни.
Максимално допустима концентрация на живак за водната среда
ПДК на живак в чиста вода- 0,5 µg/l, а в рибарниците ПДК за рибни стопанства е под 0,1 µg/l.
олово (Pb)
Реките и езерата могат да бъдат замърсени с олово по естествен начин, когато оловните минерали се отмиват (гален, англезит, церусит), и по антропогенен начин (изгаряне на въглища, използване на тетраетил олово в горивото, зауствания от рудодобивни фабрики, отпадни води от мини и металургични заводи). Утаяването на оловни съединения и адсорбцията на тези вещества върху повърхността на различни скали са най-важните природни методи за понижаване нивото му в разтвор. От биологичните фактори хидробионтите водят до намаляване на нивото на олово в разтвор.
Оловото в реките и езерата е в суспендирана и разтворена форма (минерални и органо-минерални комплекси). Също така, оловото е под формата на неразтворими вещества: сулфати, карбонати, сулфиди.
Съдържание на олово в естествените води
Чували сме много за токсичността на този тежък метал. Той е много опасен дори в малки количества и може да причини интоксикация. Оловото навлиза в тялото през дихателната и храносмилателната системи. Изхвърлянето му от тялото е много бавно и може да се натрупва в бъбреците, костите и черния дроб.
Максимално допустима концентрация на олово за водната среда
ПДК на олово за водната среда е 0,03 mg/l, а в рибарските езера ПДК на рибовъдните стопанства е 0,1 mg/l.
Тетраетил олово
Той служи като антидетонатор в моторните горива. По този начин основните източници на замърсяване с това вещество са превозните средства.
Това съединение е силно токсично и може да се натрупва в тялото.
Максимално допустима концентрация на тетраетил олово за водната средаМаксимално допустимото ниво на това вещество се приближава до нула.
Тетраетил олово обикновено не се допуска в състава на водите.
сребро (AG)
Среброто постъпва в реки и езера главно от подземни резервоари и като следствие от заустването на отпадъчни води от предприятия (фотографски предприятия, обогатителни фабрики) и мини. Друг източник на сребро могат да бъдат алгицидни и бактерицидни агенти.
В разтвор, най-важните съединения са солите на сребърния халогенид.
Съдържание на сребро в естествените води
В чистите реки и езера съдържанието на сребро е по-малко от микрограм на литър, в моретата - 0,3 µg/l. Подземните резервоари съдържат до няколко десетки микрограма на литър.
Среброто в йонна форма (при определени концентрации) има бактериостатичен и бактерициден ефект. За да може да се стерилизира водата със сребро, нейната концентрация трябва да бъде по-голяма от 2 * 10 -11 mol / l. Биологична ролясреброто в тялото все още не е добре познато.
Максимално допустима концентрация на сребро за водната среда
Максимално допустимото сребро за водната среда е 0,05 mg / l.
PEEP - максимално допустимата концентрация на вещество във водата на резервоар за питейна и битова вода, mg / l. Тази концентрация не трябва да има пряк или косвен ефект върху човешкия организъм през целия живот, както и върху здравето на следващите поколения и не трябва да влошава хигиенните условия за използване на водата. PEEP.r. - Максимално допустимата концентрация на вещество във водата на водоем, използван за риболовни цели, mg/l.
Оценката на качеството на водните екосистеми се основава на нормативни и директивни документи, като се използват директни хидрогеохимични оценки. В табл. 2.4, като пример са дадени критериите за оценка на химическото замърсяване на повърхностните води.
Установени са ограничения за водата допустими концентрациинад 960 химични съединения, които се обединяват в три групи според следните ограничителни показатели за вредност (ЛПВ): санитарно-токсикологични (с.-т.); общо санитарен (ген.); органолептичен (орг.).
ПДК на някои вредни вещества в водна средаса представени в табл. 2.1.4.
Повечето високи изискванияприлага се към питейна вода. Държавен стандартвърху водата, използвана за пиене и Хранително-вкусовата промишленост(SanPiN 2.1.4.1074-01), определя благоприятните за човека органолептични показатели на водата: вкус, мирис, цвят, прозрачност, както и безвредността на химичния й състав и епидемиологична безопасност.
Таблица 2.1.4
ПДК на вредни вещества във битови и питейни водоеми
културно-битово водоползване, mg/l
(GN 2.1.5.689-98)
| Вещества | LPV | MPC |
| 1 | 2 | 3 |
| />Бор | С.-т. | 0,5 |
| бром | С.-т. | 0,2 |
| бисмут | С.-т. | 0,1 |
| Хексахлорбензол | С.-т. | 0,05 |
| диметиламин | С.-т. | 0,1 |
| дифлуородихлорометан (фреон) | С.-т. | 10 |
| диетилов етер | Org. | 0,3 |
| Желязо | Org. | 0,3 |
| Изопрен | Org. | 0,005 |
| кадмий | С.-т. | 0,001 |
| Карбофос | Org. | 0,05 |
| керосин: | | |
| окислени | Org. | 0,01 |
| Осветление (GOST 4753-68) | Org. | 0,05 |
| Технически | Org. | 0,001 |
| киселина: | | |
| бензоена | Общо | 0,6 |
| Дифенилоцетен | Общо | 0,5 |
| мазен | Общо | 0,7 |
| Мравчена | Общо | 3,5 |
| Оцетна | Общо | 1,2 |
| Синтетични мастни киселини | Общо | 0,1 |
| C5-C20 | | |
| манган | Org. | 0,1 |
| медни | Org. | 1 |
| метанол | Св. | 3 |
| Молибден | Св. | 0,25 |
| урея | Общо | 1 |
| нафталин | Org. | 0,01 |
| масло: | | |
| полисярен | Org. | 0,1 |
| издръжлив | Org. | 0,3 |
| Нитрати за: | | |
| NO3- | Св. | 45 |
| NO2- | Св. | 3,3 |
| Полиетиленамин | Св. | 0,1 |
| тиоцианати | Св. | 0,1 |
| живак | Св. | 0,0005 |
| Водя | Св. | 0,03 |
| въглероден дисулфид | Org. | 1 |
| Терпентин | Org. | 0,2 |
| Сулфиди | Общо | Отсъствие |
| Тетраетил олово | Св. | Отсъствие |
| Трибутил фосфат | Общо | 0,01 |
Питейната вода по всяко време на годината не трябва да съдържа по-малко от 4 g / m кислород, а наличието на минерални примеси (mg / l) в нея не трябва да надвишава: сулфати (SO4 -) - 500; хлориди (Cl-) - 350; желязо (Fe2+ + Fe3+) - 0,3; манган (Mn2+) - 0,1; мед (Cu2+) - 1,0; цинк (Zn2+) - 5,0; алуминий (Al) - 0,5; метафосфати (PO3") - 3,5; фосфати (PO4
3") - 3,5; сух остатък - 1000. Така водата е подходяща за пиене, ако общото й минерално съдържание не надвишава 1000 mg / l. Много ниското минерално съдържание на водата (под 1000 mg / l) също влошава вкуса й и водата, обикновено лишена от соли (дестилирана), е вредна за здравето, тъй като нейната употреба нарушава храносмилането и дейността на жлезите с вътрешна секреция. Понякога, по съгласие със санитарно-епидемиологичната служба, съдържанието на сух остатък е до 1500 mg / l позволен.
Показатели, характеризиращи замърсяването на водоеми и питейни води с вещества, класифицирани в класове на опасност 3 и 4, както и физикохимични характеристикии органолептичните характеристики на водата са допълнителни. С тях се потвърждава степента на интензивност на антропогенното замърсяване на водоизточниците, установена по приоритетни показатели.
Прилагането на различни критерии за оценка на качеството на водата трябва да се основава на предимството на изискванията на водоползването, чиито критерии са по-строги. Например, ако воден обект едновременно служи за питейни и риболовни цели, тогава към оценката на качеството на водата могат да бъдат наложени по-строги изисквания (екологични и рибни).
PCP-10 (индикатор за химическо замърсяване). Този показател е особено важен за райони, където се наблюдава химическо замърсяване за няколко вещества наведнъж, всяко от които многократно надвишава ПДК. Изчислява се само при идентифициране на райони на извънредна екологична ситуация и зони на екологично бедствие.
Изчислението се извършва за десет съединения, които максимално надвишават MPC, съгласно формулата:
PKhZ-10 = C1 / MPC1 + C2 / MPC2 + C3 / MPC3 + ... C10 / MPC10,
където Cb C2, C3 ... Cb - концентрация на химикали във водата: MPC - риболов.
При определяне на PCP-10 за химикали, за които няма относително задоволителна стойност на замърсяването на водата, съотношението C/MAC условно се приема за равно на 1.
За да се установи PCP-10, се препоръчва да се анализира водата според максималния възможен брой показатели.
Допълнителните показатели включват общоприетите физикохимични и биологични характеристикидаване Главна идеяза състава и качеството на водата. Тези показатели се използват за допълнително характеризиране на процесите, протичащи във водните обекти. Освен това в допълнителни характеристикивключват индикатори, които отчитат способността на замърсителите да се натрупват в дънните седименти и хидробионтите.
Коефициентът на дънно натрупване на CDA се изчислява по формулата:
KDA \u003d Sd.o. / Sv,
където Sd. относно. и Sv - концентрацията на замърсители в дънните седименти и съответно във водата.
Коефициент на натрупване в хидробионти:
Kn \u003d Sg / Sv,
където Cr е концентрацията на замърсители в хидробионтите.
Критичните концентрации на химикали (КХ) се определят по методологията за определяне на критичните концентрации на замърсители, разработена от Държавния комитет по хидрометеорология през 1983 г.
Средните стойности на CC на някои замърсители са, mg/l: мед - 0,001 ... 0,003; кадмий - 0,008 ... 0,020; цинк - 0,05...0,10; ПХБ - 0,005; бензо(а)пирен - 0,005.
При оценката на състоянието на водните екосистеми достатъчно надеждни показатели са характеристиките на състоянието и развитието на всички екологични групиводна общност.
При идентифициране на разглежданите зони се използват индикатори за бактерио-, фито- и зоопланктон, както и за ихтиофауна. Освен това, за да се определи степента на токсичност на водите, се използва интегрален индикатор - биотест (за по-ниски ракообразни). В този случай трябва да се наблюдава съответната токсичност на водната маса във всички основни фази на хидроложкия цикъл.
Основните показатели за фито- и зоопланктона, както и за зообентоса, са приети на базата на данни от регионалните служби за хидробиологичен контрол, които характеризират степента на екологична деградация на сладководни екосистеми.
Параметрите на индикаторите, предложени за разпределяне на зони на дадена територия, трябва да се формират на базата на достатъчно дългосрочни наблюдения (най-малко три години).
Трябва да се има предвид, че индикаторните стойности на видовете могат да бъдат различни в различните климатични зони.
При оценката на състоянието на водните екосистеми са важни показателите за ихтиофауната, особено за уникални, специално защитени водни тела и резервоари от първа и най-висока категория за риболов.
BOD - биологична потребност от кислород - количеството кислород, използвано в биохимичните процеси на окисление на органични вещества (с изключение на процесите на нитрификация) за определено време на инкубация на пробата (2, 5, 20, 120 дни), mg O2 / l вода (BODp - за 20 дни, BOD5 - за 5 дни).
Окислителният процес при тези условия се осъществява от микроорганизми, които използват органични компоненти като храна. Методът BOD е както следва. След двучасово утаяване, изследваната отпадъчна вода се разрежда с чиста вода, взета в такова количество, че съдържащият се в нея кислород е достатъчен за пълно окисление на всички органични вещества в отпадъчните води. След като се определи съдържанието на разтворен кислород в получената смес, тя се оставя в затворена бутилка за 2, 3, 5, 10, 15 дни, като се определя съдържанието на кислород след всеки от изброените периоди от време (инкубационен период). Намаляването на количеството кислород във водата показва колко от него е изразходвано през това време за окисляване на органичните вещества в отпадъчните води. Това количество, отнесено към 1 литър отпадъчна вода, е индикатор за биохимичната консумация на кислород на отпадъчните води за даден период от време (БПК2, БПКз, БПК5, БПКw, БПК15).
Трябва да се отбележи, че биохимичната консумация на кислород не включва консумацията му за нитрификация. Следователно, преди началото на нитрификацията, която обикновено започва след 15-20 дни, трябва да се извърши пълна БПК. БПК на отпадъчните води се изчислява по формулата:
BOD = [(a1 ~ b1) ~ (a2 ~ b2)] X 1000
V'
където ai е концентрацията на кислород в пробата, подготвена за определяне в началото на инкубацията (в „нулевия ден“), mg/l; а2 - концентрация на кислород във водата за разреждане в началото на инкубацията, mg/l; b1 - концентрация на кислород в пробата в края на инкубацията, mg/l; b2 е концентрацията на кислород във водата за разреждане в края на инкубацията, mg/l; V е обемът на отпадъчната вода, съдържаща се в 1 литър от пробата след всички разреждания, ml.
COD - химическа нуждав кислород, определен по бихроматния метод, т.е. количеството кислород, еквивалентно на количеството изразходван окислител, необходимо за окисляването на всички редуциращи агенти, съдържащи се във водата, mg O2/l вода.
Химичната консумация на кислород, изразена като броя на милиграмите кислород на 1 литър отпадъчна вода, се изчислява по формулата:
HPC - 8(a - b)x N1000
V'
където а е обемът на разтвора на сол на Мор, използван за титруване в празен опит, ml; b е обемът на същия разтвор, използван за титруване на пробата, ml; N е нормалността на титрувания разтвор на солта на Мор; V е обемът на анализираната отпадъчна вода, ml; 8 - кислороден еквивалент.
По отношение на BODp/COD се оценява ефективността на биохимичното окисление на веществата.
