Характеристика на основните методи за анализ на водата. Химични методи за изследване на водата
Под окислимостразбират способността на органичните вещества във водата да се окисляват от атомарния кислород. Стойността на окисляемостта се изразява чрез количеството кислород (mg), необходимо за окисляването на органичните вещества, съдържащи се в 1 литър вода. Източникът на атомен кислород в тези реакции е калиев перманганат или бихромат, а окисляемостта се нарича съответно перманганат или бихромат. Обикновено окислимостта се определя в кисела вода, но когато съдържанието на хлориди във водата е повече от 300 mg/l и е силно замърсено, изследването се провежда в алкална среда.
Метод на перманганат (според Кубел).Въз основа на способността на калиевия перманганат да отделя кислород в кисела среда. По количеството консумиран кислород се преценява окислимостта на водата.
Прибори за хранене и прибори: бюрети, пипети от 5 ml, колби от 250-300 ml, мерни цилиндри от 100 ml, епруветки, стъклени перли, фунии с диаметър 5-7 cm.
Реагенти:
1) разтвор на калиев перманганат (0,01 N) - за това 0,316 g от лекарството се разтварят в 1 литър дестилирана вода; 1 ml от този разтвор съответства на 0,08 mg кислород. Разтворът се съхранява в бутилка от тъмно стъкло
покриване и проверка с всяка серия от изследвания;
2) решение оксалова киселина(0,01 n) - за приготвянето му се претеглят 0,63 g киселина и се разтварят в 1 литър дестилирана вода; 1 ml разтвор изисква 0,08 mg кислород за неговото окисление;
3) разтвор на сярна киселина (25%) с плътност 1,84 g/cm3 куб.
обем (1:3) в дестилирана вода.
Изследователски метод.
1) Няколко стъклени перли се поставят в конична колба от 250 ml и се изсипват 100 ml вода, добавят се 5 ml сярна киселина (1: 3) и 10 ml разтвор на калиев перманганат (0,01 N). Сместа бързо се загрява до кипене (за 5 минути) и се държи на слаб огън за около 10 минути. След това колбата се отстранява (разтворът трябва да има розов цвят) и 10 ml разтвор на оксалова киселина (0,01 N) се добавя към горещия разтвор. Обезцветеният горещ разтвор (при температура 80 0 С) се титрува с разтвор на калиев перманганат (0,01 N), докато се получи стабилен бледорозов цвят. Ако изследваната течност стане безцветна или стане светлокафява по време на кипене, по-нататъшните изследвания се спират и разтворът се излива. Взима се нова порция вода и първо се разрежда с дестилирана вода 2 или 5 пъти и анализите се повтарят, както е посочено по-горе.
2) Нормалността на разтвора на калиев перманганат (стойност K) се задава, както следва. Изсипете 100 ml дестилирана вода в колба с вместимост 250 ml, добавете 5 ml сярна киселина (25%) и 10 ml разтвор на калиев перманганат (0,01 N). Течността се загрява и се вари 10 минути на слаб огън. След това към горещата течност се добавят 10 ml разтвор на оксалова киселина (0,01 N), което води до обезцветяване. След това, докато е горещ, се титрува с разтвор на калиев перманганат (0,01 N) до получаване на бледорозов цвят.
Коефициентът на корекция (K) за титъра на 0,01 N разтвор на калиев перманганат се изчислява по формулата:
където 10 е количеството на 0,01 n разтвор на оксалова киселина, ml; b - количеството 0,01 n разтвор на калиев перманганат, добавен преди кипене и след това използван за титруване, ml.
3) Окисляемостта на водата се изчислява по формулата:
където X е окисляемостта на кислорода в mg на 1 литър вода; а - количеството KMPO 4 в ml, излято преди кипене; b е количеството KMPO 4, използвано за титруване в ml; K - корекционен коефициент към нормалността на KMnO 4 ; 10 - количеството KMPO 4, изразходвано за окисляване на оксалова киселина; 0,08 - количеството кислород, съответстващо на 1 ml 0,01 n разтвор на KMnO 4 ; 1000 - прехвърлете в 1 литър вода; C е обемът на водата, взета за анализ, ml.
Забележка:ако тестовата водна проба се разрежда с дестилирана вода, тогава е необходимо да се провери съдържанието на органични вещества и при изчисляване на окислимостта да се извади количеството KMnO 4, което е отишло за окисляване на органични вещества в дестилирана вода.
Поради факта, че някои минерални (оксидни) съединения - желязо, манган, нитрити, сероводород - също могат да се окисляват във вода, със значително съдържание от тях, е необходимо да се вземе предвид ефектът върху стойността на окисляемостта ( експериментът се провежда без нагряване).
Определяне на окислимостта в алкална среда (по Шулц).Този метод е приложим за определяне на окисляемостта на вода, замърсена с хлориди и др.
реагенти:
1) разтвор на калиев перманганат (0,01 N) - за това 0,316 g от лекарството се разтварят в 1 литър дестилирана вода;
2) 50% разтвор на натриев хидроксид;
3) разтвор на оксалова киселина (0,01 n) - за приготвянето му се претеглят 0,63 g киселина и се разтварят в 1 литър дестилирана вода;
4) 20% разтвор на сярна киселина.
Изследователски метод.
В конична колба се изсипват 100 ml вода, добавят се 0,5 ml 50% разтвор на натриев хидроксид и 10 ml разтвор на калиев перманганат (0,01 N). Течността се загрява и се вари 10 минути от началото на появата на първите мехурчета, охлажда се до 50-60°C, добавят се 5 ml сярна киселина, 10 ml 0,01 N разтвор на оксалова киселина (течността трябва да се обезцвети ; ако това не е така, добавете още няколко ml оксалова киселина). След това се титрува с 0,01 N разтвор на калиев перманганат, докато се появи бледо розов цвят, който не изчезва в рамките на 3-5 минути. Изчислението се извършва по същата формула като по метода на Kubel, резултатът се изразява в mg кислород на литър.
Експресен метод за определяне на окислимостта. Изсипете 10 ml вода в епруветка и добавете 0,5 ml разтвор на сярна киселина с разреждане 1:3 и 1 ml 0,01 N разтвор на калиев перманганат. Сместа се разбърква старателно и се оставя за 20 минути при температура 20 0 С и за 40 минути при температура 10-20 0 С. След това разтворът се изследва отстрани и отгоре и се определя окислимостта по цвят, което зависи от цвета. И така, ярък медено-розов цвят съответства на 1, люляк-розов - 2, слаб люляк-розов - 4, бледо-люляк-розов - 6, бледорозов - 8, розово-жълт - 12, жълт - 16 mg O 2 / л и по-горе.
Азот амоняк и амониеви соли. Количеството амоняк и амониев азот във водата се определя чрез колориметричен метод, чиято същност е, че при добавяне на реактива на Неслер към тестовата вода се образува меркурамониев йодид, който оцветява водата в жълторазлична интензивност в зависимост от съдържанието на амоняк. След добавяне на реактива на Неслер, водната проба се сравнява със стандартен разтвор на амониев хлорид, съдържащ известно количество амониев азот. За колориметрия е подходяща вода с концентрация на амоняк в диапазона от 0,1-10 mg/l.
Прибори за хранене и прибори: фотоелектричен колориметър - FEC, пипети 1 и 5 ml, колби 100 ml, градуиран цилиндър 100 ml и епруветки.
реагенти:
1) реагент на Неслер;
2) стандартен разтвор на амониев хлорид със съдържание на азот 0,001 mg
в 1 мл;
3) 50% воден разтвор на сол Rochelle;
4) алкална смес, състояща се от 50 g натриев хидроксид и 100 g въглероден диоксид
сода, разтворена в 300 ml дестилирана вода (приготвеният разтвор се вари 15 минути и се филтрира през азбестова вата);
5) алуминиев хидроксид.
Подготовка на вода за анализ: точността на определяне на съдържанието на амонячен азот и амониеви соли във водата се влияе от нейния цвят и твърдост, съдържанието на желязо, сулфити и свободен въглероден диоксид. За обезцветяване на 500 ml вода се добавят 0,5 g алуминиев хидроксид и утайката се утаява за 2 часа,
Сулфидите се определят, както следва: 1 ml реактив на Неслер и след това 2 ml разтвор на сярна киселина (1: 3) се добавят към 10 ml вода. Ако мътността не изчезне след подкиселяване на водата, значи тя съдържа сулфиди, които трябва да се отстранят чрез добавяне на 10 капки 30% разтвор на цинков ацетат към 100 ml вода. След това водата се утаява за 2 часа, прозрачната част се източва и от нея се вземат проби за изследване.
Когато твърдостта на водата е повече от 3,5 mg / екв. Омекотявам го, за това се добавят 2 ml сода каустик към 100 ml вода и разтворът се утаява за 2 часа.
Методология на изследването. 100 ml стандартен разтвор на амониев хлорид се изсипват в едната колба, а 100 ml от тестовата вода се изсипват в другата. След това към двете колби се добавят 3 ml 50% разтвор на сол на Рошел и 2 ml реактив на Nessler. Съдържанието на колбите се разклаща и се оставя за около 10 минути, докато се появи цветът.
Колориметрията се извършва на FEC с филтър за синя светлина (№ 4) в кювети с дебелина 1-5 cm. оптична плътностстандартен разтвор на тестовата вода точно 10 минути след добавянето на реактива на Неслер (отчитат се последователността на добавяне на реагентите и тяхната колориметрия). Изчислението се извършва по формулата:
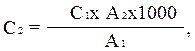
където C 2 е концентрацията на амоняк и амониев азот в тестваната вода, mg/l; C 1 - същото в стандартен разтвор на амониев хлорид, mg/l; A 1 - оптична плътност на стандартен разтвор на амониев хлорид (червена скала); A 2 - оптична плътност на изследваната вода (по червена скала); 1000 - прехвърлете в 1 литър.
Определяне на амоняка по приблизителен метод. Изсипете в епруветка
10 ml от изследваната вода, добавете 0,2-0,3 ml 50% разтвор на Rochelle
сол, разбъркайте добре и добавете реактива на Неслер. Определение за амоняк
олово съгласно таблица 38.
азотен нитрит. Принципът на изследването е, че водата, съдържаща нитрити, при добавяне на реактива на Грийс става розова. За откриване на нитрити използвайте реактива на Грийс - разтвор на алфа-нафталамин и сулфанилова киселина в оцетна киселина. Когато съдържанието на нитрити във водата е повече от 0,3 mg/l, водата става жълта. Границата на чувствителност на реагента е 0,01 mg/l нитрити.
Възможно е да се изчисли и инсталира висококачествена система за пречистване на вода във всяко предприятие, във всяко съоръжение само чрез извършване на анализ на водата. Днес има най-много различни вариантианализи, но все още остава приоритет. Без неговите данни е невъзможно да се направи висококачествено пречистване на водата. Времето не стои неподвижно и съвременни методи химичен анализводапозволяват на настоящото поколение, при същите условия, да получи много повече информация.
Лабораторен анализ: последици за човешкото здраве
Трябва да се отбележи, че технологичният прогрес донесе не само нови технологии в живота на хората, но и проблеми с околната среда. Мръсна водае източникът на инфекцията. И е невъзможно да се направи без методи за почистване, просто е невъзможно. Учените казват, че в резултат на некачествено третиране повече от 70 процента от водата, консумирана от хората, е нежива. Тоест от такава вода определено няма да има полза.
Има определени стандарти, които важат за качеството на водата. Те са разработени с цел получаване на поне приемлива вода за консумация. Но, уви, повечето от водните ресурси от централизирани системине отговарят на тези стандарти. По света учените се опитват да привлекат вниманието към качеството на водата и нейните проблеми. И съвременни начинихимичният анализ на водата в този аспект заемат значителна ниша, помагайки да се реши цяла линияпроблеми.
И първото нещо, което помага да се реши такъв анализ, е оценката на качеството на водата. И днес трябва да разберете, че въпреки че оценката на качеството на водата се извършва по същите параметри, тя има свои собствени характеристики за вода от, от, от. Наборът от параметри е подобен, но все пак малко по-различен. Следователно, когато поръчва анализ, потребителят трябва ясно да посочи какво точно трябва да бъде оценено и как иска водата да бъде оценена по химичен състав или бактериологично.
Ще трябва да анализирате водата във всеки случай, от всеки източник. Такива резултати са гаранция за безопасност за потребителите и предприятието. Най-добре е да се извърши такава процедура в специални специализирани лаборатории. Всяка лаборатория трябва да има сертификат за потвърждение. И се издава на предприятия от всякаква форма на собственост.
Анализите могат да се правят в две посоки – бактериологично и химико-физично. Съвременни методихимичните анализи принадлежат към втората група. Тук се показват както параметрите на твърдостта, така и мътността, всички видове миризми, проверяват се органични и неорганични включвания във водата.
Възможно е да се направи без бактериологичен анализ само в случай на оценка на чешмяна вода, с централно водоснабдяване. По правило такава вода вече е дезинфекцирана. Във всички останали случаи оценката трябва да върви в комплекса.
Проектирането на пречистване на водата за всякакви цели предполага оценка на състоянието на водните ресурси във всеки случай. Няма анализ - няма висококачествено оборудване за пречистване на водата.
За да върви всичко както трябва, можете, според правилата, сами да изберете вода. Но за да се гарантира липсата на грешки в оценката, най-добре е да се обадите на специалист у дома или в предприятие.
Оценката на водата днес се превърна в част от човешкия живот. И на работа, и вкъщи. Ако потребител на водни ресурси иска да гарантира собственото си здраве, тогава правилната връзка е незаменима - оценка на водата + правилна системапречистване.
Също толкова важно е да се отговори на въпроса - колко често да се анализира водата? Не е тайна, че съставът на водата се променя с течение на времето. И какво трябва да направи собственикът на частна къща? Как и в какъв ред трябва да се извършват тестовете? За какво да се хванете?
Малка екскурзия за начинаещи. Тези, които току-що са оборудвали кладенец на обекта си, в без провалнаправете пълен химичен анализ на водата два пъти. Преди и след монтажа. Първият път е ясно. Вторият се извършва, за да се оцени правилността на съставената система за пречистване. Дава възможност за коригиране на грешки.
В бъдеще, когато кладенецът ще бъде експлоатиран, първата година - анализира се веднъж на всеки три месеца, след това може да се прави веднъж на всеки 12 месеца. Може би такъв брой анализи ще изглежда излишен за някого, но винаги трябва да се помни две характеристики:
- Тези, които са копали сами, трябва да разберат, че контролът върху състоянието на водата лежи изцяло върху техните плещи и следователно ще трябва да го контролират сами и през целия си живот;
- Когато работите със собствен кладенец, всичко може да се случи, собственикът на къщата може да не знае, че някъде наблизо има химикал. малка фабрика и буквално онзи ден там проби тръба с отпадъци. В същото време състоянието на водата стана не само опасно, но и критично, както когато не забелязаха водоносния хоризонт и отпадъците от помийна ямацялото село и този факт може да стане ясен след половин година експлоатация.
В никакъв случай извършването на химически анализ в началото изобщо не е безцелно начинание. Освен това днес е възможно да се използват най-ефективните и най-модерни методи за химичен анализ на водата.
Съвременни възможности за изследване на водата
Днес има няколко варианта за изследване на водата, повечето от които химически. Едно лошо нещо е, че не всички лаборатории правят такива изследвания. Някои методи са толкова нови и прогресивни, че могат да се правят само в чужбина. По-долу е дадена таблица на самите съвременни методи за анализ. Най-уникалните за днес са хромато-масспектрометричните анализи, луминесцентното и неутронно активиране. Последните обикновено се извършват на неутронно ниво, под микроскоп с много висока точност.
|
Вид анализ |
Методология |
|
По обем |
|
|
Електрохимични |
Потенциометър Полярография |
|
Фото-, спектрометричен Луминесцентен |
|
|
Снимка+химия |
Фотохимични |
|
Хроматография |
Течни колони Течност с висока ефективност |
За да извършите правилния анализ, е необходимо правилно да изберете водата. За да направите това, можете да вземете обикновена бутилка обикновена вода, не газирана или сладка. Водата се източва от крана за най-малко 15 минути. След това бутилката се измива (БЕЗ ФУНКЦИИ) и се изписват под самото гърло. Изсипете на тънка струя отстрани на бутилката. По-добре е незабавно да го занесете в лабораторията. Можете да го съхранявате в хладилник за максимум 24 часа.
Един от съвременните методи за анализ е химическата оценка на водата по разширен списък. Този метод се използва при оценка на плитки кладенци или кладенци. Поради малката си дълбочина съществува риск от замърсяване на водата с всякакви вредни примеси. Следователно такава вода трябва да се изследва, като се вземат предвид следните параметри:
- Органични вещества - в допълнение към стандартните метални соли, това ще включва винилхлорид, въглероден тетрахлорид, акриламид и др.;
- Неорганични - проверява се наличието не само на твърди примеси, но и на соли на никел, олово, цинк и др.;
- Микробиологични примеси - тук те изследват E. coli, ламбия, като цяло, малко по-широк диапазон вредни бактерииотколкото при конвенционален бактериологичен анализ;
- Тъй като водата се извлича от малка дълбочина, съществува висок риск и Голям брой, пестицидни примеси, така че се откриват - метоксихлор, токсафол, ендрин и др.;
- Радионуклидни примеси и хербициди, причината е същата - определя се съдържанието на пенхлорфенол, атрацин, определя се броят на заредените частици и радий.
Тестов комплект
Като пример за съвременен метод за химичен анализ на водата може да се посочи тестов комплект. Това е много удобен метод, който ви позволява бързо да оцените водните ресурси, почти на терен.

Този тестов комплект съдържа пълен комплект консумативза 100 вида анализи. И всичко се прави бързо и просто. И всички анализи отговарят на изискванията за методите за анализ. Такива тестови комплекти са добри, защото ви позволяват бързо да проверявате състава на водата веднъж на тримесечие. Тоест за наблюдение на състоянието на водата такъв комплект е най-оптималният. Освен това оценителят ще получи резултатите от селекцията на място на място, без пътувания до лабораторията и очаквания.
Този метод дава възможност да се оценят и двете техническа вода. Грешката на показанията съответства на лабораторните изследвания. Колеба се между 25-30 процента. Но за скорост това е напълно приемлива такса и обаждането на специалист с такъв комплект ще помогне да се оцени състоянието на водата дори в най-отдалечените и труднодостъпни райони, което е важно.
Такива комплекти се произвеждат в количество от 12 комплекта на 100 теста. Тоест също е доста икономичен.
Оценката на водата винаги е била и остава основен компонент на всяка пречиствателна система. Дали ще бъде мощно индустриално предприятие или малко частна къща. Но да се направи без резултатите от наличието на различни примеси във водата няма да работи. Не можете да харчите пари за такива сериозни устройства като почистващи препарати на случаен принцип. Само ясен план и оценка. Ето защо е невъзможно да се подценява значението на химичните методи за анализ днес. Без тях висококачествената обработка на водата не може да бъде видяна от повече от един потребител.
Въведение
Актуалността на темата се определя от факта, че е важно да се знае значението пия водаи неговите свойства. Водата е едно от най-разпространените вещества в природата (хидросферата заема 71% от земната повърхност). Водата принадлежи съществена роляв геологията, историята на планетата. Живите организми не могат да съществуват без вода.
Според особеностите на произход, състав или приложение се различават:
мека вода и твърда вода, прясна вода, дъждовна вода, разтопена вода, Подземните води, минерална вода, дестилирана вода, отпадни води и питейна вода.
Сред основните показатели за качеството на питейната вода са:
Водата, която не вреди на човешкото здраве и отговаря на изискванията на действащите стандарти за качество, се нарича питейна вода, ако е необходимо, за да отговаря водата на санитарните и епидемиологичните стандарти, тя се проверява, пречиства или, официално казано, се „приготвя“ с пречиствателни станции за вода.
Отпадъчни води - всякакви води и валежи, отклонени към водоеми от териториите промишлени предприятияи населени местапрез канализационната система или гравитачно, чиито свойства са влошени в резултат на човешка дейност.
Отпадъчните води могат да бъдат класифицирани според следните характеристики:
Производство
Повърхностна канализация
Хората, животните и растенията са предимно вода, включително хората: водата съставлява 70% от нашето телесно тегло. Може би в преобладаването на водата, във факта, че всичко е „проникнато и обгърнато от вода“, и нейната основна уникален имот.
Второто най-важно свойство е способността на водата да разтваря вещества. Водата е универсален разтворител. Поради това неговият състав не се ограничава до формулата H 2 O.
Третото уникално свойство на водата е, че на Земята тя присъства едновременно в три състояния или, използвайки физическа терминология, в три фази – газообразна, течна и твърда, тоест под формата на водна пара, всъщност течна вода и лед. Не се опитвайте да намерите друго вещество, което има същото свойство! Вземете например кислородния газ - той се превръща в течност при температура -183 °C и в твърда фаза при -218 °C. Желязо, твърд метал, става течност (стопява се) при +1539 °C и преминава в състояние на пара при огромна температура от +3200 °C.
Вода на много извори прясна водане е подходящ за пиене от хора, тъй като може да разпространи болести или да причини дългосрочни здравословни проблеми, ако не отговаря на определени стандарти за качество на водата:
Водата, която не вреди на човешкото здраве и отговаря на изискванията на действащите стандарти за качество, се нарича питейна вода, ако е необходимо, за да отговаря водата на санитарните и епидемиологичните стандарти, тя се проверява, пречиства или, официално казано, се „приготвя“ с пречиствателни станции за вода. Важно е да знаете определението за мътност на водата, защото здравето на хората зависи от това.
Мътност вода - индикаторхарактеризиращо намаляването на прозрачността на водата поради наличието на неорганични и органични фини суспензии, както и развитието на планктонни организми. Ще ви разкажа малко за Староосколския механичен завод.
Староосколски механичен заводе основният производител на стомана и желязна стрела в страната. Произвежда също минно и сондажно оборудване, вентилационни и душ инсталации за горещо металургично производство; Общи потребителски стоки.
За производството на продукти, съществуващата гама, заводът използва технологични процеси, които правят възможно производството на всички основни видове преразпределение, използвани в машиностроенето. В завода се извършва аналитичен контрол на всички производствени процеси. Аналитичният производствен контрол включва практическа употребатеория и методи на аналитичната химия за определяне на състава на конкретни обекти от всяко производство.
Контролът на производството се използва за проверка на качеството на продуктите и напредъка на технологичен процес, за предотвратяване на брак и обезпечени
установени от правилата и спецификациикачеството на произвежданите продукти.
Показателите за качество включват следните показатели: предназначение на стоката, надеждност на стоката, екологичност на стоките, показатели за екологичност на стоките, ергономични показатели, показатели за ергономичност, показатели за технологичност на стоката, естетиката на стоката. (Вижте Приложение 3)
Освен производствения контрол, в завода непрекъснато се следи съставът на питейната и питейната вода. отпадъчни водиразлични химични и химико-физични методи.
Цел на курсовата работа: изследване на качеството на питейната вода според турбидиметричното определяне на мътността.
 Съдържание
Съдържание
1.Въведение……………………………………………………………………………………...5
2. Основна част……………………………………………………………………………………..9
2.1 Същността на физико-химичните методи за анализ…………………….. 9
2.2 Фотометрично определяне на мътността на питейната вода по турбидиметричен метод съгласно GOST 3351-74……………………………………….12
2.3 Реагенти. Материали. Оборудване………………………………………19
2.4 Анализ……………………………………………………………..21
2.5 Обработка на резултатите……………………………………………………………23
2.6 Заключение………………………………………………………………………………….24
3. Заключение…………………………………………………………………………...26
4. Литература………………………………………………………………………………….28
5. Приложение
2.Основна част
Същността на физико-химичните методи за анализ
Физико-химични методи (PCMA) анализ, се основават на зависимостта на физичните свойства на веществото от неговата природа, а аналитичният сигнал е количеството физическа собственост, функционално свързани с концентрацията или масата на определения компонент.
Физикохимичните методи за анализ (PCMA) могат да включват химическа трансформация на аналита, разтваряне на пробата, концентрация на аналита, маскиране на интерфериращи вещества и други.
За разлика от „класическите“ химични методи на анализ, където масата на веществото или неговият обем служи като аналитичен сигнал, във физикохимичните методи на анализ се използват като аналитични интензитет на радиация, сила на тока, електропроводимост, потенциална разлика и др. сигнал.
Важно практическа стойностимат методи, базирани на изследване на емисиите и абсорбцията електромагнитно излъчванев различни полетаспектър.
Те включват спектроскопия (например луминесцентен анализ, спектрален анализ, нефелометрия и турбидиметрия и други). Важните физикохимични методи за анализ включват: електрохимични методи, използващи измерване електрически свойствавещества, кулометрия, потенциометрия и др.), както и хроматография (например газова хроматография, течна хроматография, йонообмен, хроматография, тънкослойна хроматография).
 Успешно се развиват методи, базирани на измерване на скорости химична реакция(кинетични методи за анализ), термични ефекти на реакциите (термометрично титруване), както и върху разделянето на йони в магнитно поле (масспектрометрия).
Успешно се развиват методи, базирани на измерване на скорости химична реакция(кинетични методи за анализ), термични ефекти на реакциите (термометрично титруване), както и върху разделянето на йони в магнитно поле (масспектрометрия).
При извършване на физикохимични методи за анализ се използва специално, понякога доста сложно, измервателно оборудване и затова тези методи често се наричат инструментални. много модерни уредиоборудвани с вградени компютри, които ви позволяват да намирате оптимални условияанализ (напр. спектралната област за получаване на най-точни резултати при анализ на смес от оцветени вещества), извършвам. В почти всички физикохимични методи за анализ се използват два основни метода: методи на директни измервания и титруване.
Директните методи използват зависимостта на аналитичния сигнал от естеството на аналита и неговата концентрация. Зависимостта на сигнала от естеството на веществото - основата качествен анализ(полувълнов потенциал при полярография и др.). При някои методи връзката между аналитичния сигнал и естеството на веществото се установява строго теоретично. Например, спектърът на водороден атом може да бъде изчислен с помощта на теоретично извлечени формули. При количествения анализ се използва зависимостта на интензитета на сигнала от концентрацията на дадено вещество.
Числовите стойности на константите в уравнението на свързване се определят експериментално с помощта на стандартни проби, стандартни разтвори и др. Само в кулометрията, базирана на закона на Фарадей, не се изисква дефиницията на константите.
Най-разпространени в практиката са следните методи за определяне на константите на уравнението на комуникация или, което е същото, методи за количества, анализ с помощта на физикохимични измервания:
1) Метод на калибровъчната крива. Интензитетът на аналитичния сигнал се измерва за няколко стандартни проби или стандартни разтвори и се нанася калибровъчна графика в координатите I=f(c) или I=f(lgc), където C е концентрацията на компонента в стандартния разтвор или стандартна проба. При същите условия се измерва интензитетът на сигнала на анализираната проба и концентрацията се намира от калибровъчната крива.
2) Методът на моларните свойства се използва в случаите, когато уравнението на отношението I = bc се спазва доста стриктно. Измерете аналитичния сигнал от няколко стандартни проби или разтвори и изчислете b=I st /s st; ако c st се измерва в mol / l, тогава b е моларно свойство.
3) Метод на допълнения. Измерете интензитета на аналитичния сигнал на пробата I x , а след това интензитета на сигнала на пробата с известно добавяне на стандартния разтвор I x+stt .
4) Методи за титруване. Измерва се интензитетът на аналитичния сигнал I в зависимост от обема V на добавения титрант. Според кривата на титруване I=f (V) се намира точката на еквивалентност и резултатът се изчислява по обичайните формули на титриметричния анализ.
Физикохимичните методи за анализ често се използват за определяне на ниско съдържание (от порядъка на 10 -3% или по-малко), където класическите химични методи за анализ обикновено са неприложими.
В областта на средните и високи концентрации химичните и физикохимичните методи за анализ успешно се конкурират помежду си, взаимно се допълват. Физическите и химичните методи за анализ се развиват в посока търсене на нови химични аналитични свойства на веществото, повишаване на точността на анализа, проектиране на нови прецизни аналитични инструменти, подобряване на съществуващите методи и автоматизиране на анализа.
Турбидиметричният метод се използва широко за определяне на мътността на питейната вода.
 2.2 Фотометрично определяне на мътността на питейната вода по турбидиметричен метод
2.2 Фотометрично определяне на мътността на питейната вода по турбидиметричен метод
Турбидиметричният метод се използва за анализ на суспензии, емулсии, различни суспензии и други мътни среди. Интензитетът на светлинния лъч, преминаващ през такава среда, намалява поради разсейването и поглъщането на светлината от суспендирани частици.
Турбидиметричните методи се основават на измерване на интензитета на светлината, преминала през анализираната суспензия.
Основното предимство на турбидиметричния метод е тяхната висока чувствителност, която е особено ценна по отношение на елементи или йони, за които няма цветни реакции.
Този видИзследването на мътна среда се основава на измерване на промяната в интензитета на светлинния енергиен поток, който е преминал през дисперсна система. Промяната в потока на светлинната енергия се причинява както от поглъщането, така и от разсейването й от дисперсна система. Методът е подобен на колориметричния, но в някои случаи измерването може да се осъществи в поток "бяла светлина" без използването на филтри.
По отношение на чувствителността на метода, сравнението на нефелометрията и турбидиметрията благоприятства нефелометрията, тъй като този метод е по-чувствителен, когато малко количество суспендирани частици води до забележимо увеличение на сигнала с малък фон.
Ефектът на фоновото разсейване е намален в редица инструменти чрез елиминиране на измерванията на разсейване от 90° и чрез електронно изваждане на фоновите сигнали (скоростна нефелометрия).
 Предимството на турбидиметричния анализ е, че измерванията могат да се правят на почти всеки колориметър или фотометър. Повишаване на чувствителността на турбидиметричните изследвания може да се постигне чрез използване на спектрофотометри с висококачествени детектори.
Предимството на турбидиметричния анализ е, че измерванията могат да се правят на почти всеки колориметър или фотометър. Повишаване на чувствителността на турбидиметричните изследвания може да се постигне чрез използване на спектрофотометри с висококачествени детектори.
Посоките на светлинните енергийни потоци, обясняващи принципите на турбидиметричните изследвания, са показани на фигурата.
Като източници на светлина обикновено се използват живачни дъгови лампи, волфрамови йодни лампи и хелий-неонови лазери. Лазерите излъчват монохроматична светлина, концентрирана в тесен и интензивен лъч. Въпреки това, лазерите са много скъпи и могат да излъчват ограничен набор от фиксирани дължини на вълната.
Измерванията се извършват с помощта на фотоелектроколориметри, като техниката на измерване е подобна на тази на фотометрията. Методът на калибровъчната крива се използва за намиране на концентрацията.
Предимството на нефелометричните и турбидиметричните методи
е тяхната висока чувствителност, което е особено ценно при определяне на елементи, които не показват цветни реакции. Грешката при измерване при турбидиметричните методи обаче е малко по-голяма, отколкото при фотометричните, което е свързано с трудности при получаването на суспензии със същите размери на частиците, стабилност във времето и др. Турбидиметричното определяне на сулфатните йони се основава на измерване на интензитета на мътност на разтвори, съдържащи сулфати при добавяне на бариев хлорид.
Оптичната плътност на разтворите се измерва при 315 nm. Линейна зависимостоптичната плътност върху концентрацията на сулфати се наблюдава в диапазона от 0 - 50 mg / dm 3
Сулфатните йони се утаяват като бариев сулфат в солна среда. За стабилизиране на суспензията BaSO 4 в реакционната смес се въвежда глицерол или етиленгликол, а за намаляване на разтворимостта на бариевия сулфат - етанол.
Определянето се затруднява от суспендирани, оцветени, опалесцентни вещества, както и силициева киселина с концентрация над 200 mg/dmSi, което е малко вероятно за води с ниско съдържание на сулфати.
Интерфериращият ефект на суспендираните и колоидни вещества се елиминира чрез предварително филтриране на пробата през мембранен филтър с диаметър на порите 0,45 µm. Ефектът на опалесцентните вещества и ниския цвят се взема предвид чрез измерване на вътрешната оптична плътност на пробата,
подкиселена киселина. Ефектът от висок цвят поради наличието на хумусни вещества се елиминира чрез третиране на пробата с активен въглен.
Възможността за утаяване на други аниони (карбонати, фосфати, сулфити) от бариев хлорид се елиминира по време на анализа чрез подкисляване на пробата.
Измерете интензитета на всяка разсеяна светлина (нефелометрично
вариант), или светлина, преминаваща през мътна среда (турбидиметричен вариант). Съдържанието на сулфатни йони се определя по метода на калибровъчната крива.
За да приготвите стандартен разтвор, се нуждаете от следното: разтвор на солна киселина (1:1). 50 cm 3 концентрирана солна киселина се смесва с 50 cm 3 бидестилирана вода. Разтворът е стабилен.
Разтвор на бариев хлорид, 5%. 6,2 g бариев хлорид BaCI 2 .2H 2O се разтварят в 100 cm 3 бидестилирана вода.
утаителен разтвор. 50 cm 3 от 5% разтвор на бариев хлорид се смесват със 150 cm 3 глицерол или етиленгликол и 150 cm 3 етилов алкохол в 500 cm 3 конична колба. Стойността на рН на разтвора се довежда до приблизително 3 с разтвор на солна киселина 1:1 и се оставя за 1-2 дни на тъмно място, като колбата се покрива с часовниково стъкло. След утаяване утаеният разтвор се излива в тъмна колба със смляна запушалка. Ако по време на утаяването на дъното на колбата се образува утайка, прехвърлянето на реагента в колбата трябва да се извърши внимателно, така че утайката да остане в колбата. Разтворът за утаяване е подходящ за не повече от 3 месеца.
За да се изгради калибровъчна графика, 0 се въвежда в мерни колби с вместимост 50 cm 3 с помощта на градуирани пипети с капацитет 1, 5 и 10 cm 3; 0,6,; 1,0; 20; 3,0; 4^0; 6,0; 8,0; 10,0 cm 3 разтвор на калиев сулфат с масова концентрация на сулфатни йони 0,250 mg/cm 3 . Обемите на разтворите се довеждат до маркировките върху колбите с бидестилирана вода, разбърква се. Изчислете получените концентрации. 5 cm от всеки от приготвените разтвори се поставят в конични колби с вместимост 50 cm 3 и се добавя 1 капка разтвор на солна киселина 1:1. При непрекъснато разбъркване във всяка колба се изсипват 5 cm 3 от утаещия разтвор и се разбърква съдържанието още 10-15 s. След 40 ± 5 минути абсорбцията на разтворите се измерва в 2 cm кювета и абсорбцията на празната проба се изважда от абсорбцията на разтворите, съдържащи сулфати.
Калибровъчната зависимост се изгражда в координатите: оптична плътност - концентрация на сулфатни йони в mg/DM 3 и се изчислява по метода на най-малките квадрати.
За определяне на сулфатни йони. Вземете 5,0 ml от анализираната вода в суха конична колба
с вместимост 50 ml 3 или епруветка със смляна запушалка с вместимост 10-
15 см, добавете 1 капка солна киселина 1:1 и разбъркайте.
След 1-2 минути, при непрекъснато разбъркване, изсипете 5 cm 3 от утаещия разтвор в колбата и продължете да разбърквате съдържанието още 10-15 s. След 40 g 5 min, оптичната плътност на пробата се измерва при 315 nm в кювета с дължина 2 cm спрямо дестилирана вода. В същото време се анализира празна проба с 5 ml бидестилирана вода.
За изчисляване се изчислява стойността на оптичната плътност Dx, съответстваща на концентрацията на сулфати в първоначалната проба по формулата:
A \u003d A - Ai -A 2,
където
A - стойността на оптичната плътност на пробата, получена по време на определянето;
Ai е стойността на присъщата оптична плътност на пробата;
A 2 - стойността на оптичната плътност на празна проба.
Според калибровъчната зависимост се установява масовата концентрация на сулфати в анализираната водна проба, съответстваща на получената стойност на оптичната плътност A.
За определяне на сулфатните йони са необходими следните реагенти: разтвор на солна киселина (1:1) 50 cm 3 концентрирана солна киселина се смесва с 50 cm 3 бидестилирана вода. Разтворът е стабилен. Разтвор на бариев хлорид, 5% 6,2 g бариев хлорид BaCI 2 .2H 2 O се разтваря в 100 cm 3 бидестилирана вода. Утаителен разтвор: 50 cm 3 от 5% разтвор на бариев хлорид се смесват със 150 cm 3 глицерол или етиленгликол и 150 cm 3 етилов алкохол в 500 cm 3 конична колба. Стойността на рН на разтвора се довежда до приблизително 3 с разтвор на солна киселина 1:1 и се оставя за 1-2 дни на тъмно място, като колбата се покрива с часовниково стъкло.
След утаяване утаеният разтвор се излива в тъмна колба със смляна запушалка.
Ако по време на утаяването на дъното на колбата се образува утайка, прехвърлянето на реагента в колбата трябва да се извърши внимателно, така че утайката да остане в колбата. Разтворът за утаяване е подходящ за не повече от 3 месеца и за изграждане на калибровъчна графика 0 се въвежда в мерни колби с вместимост 50 cm 3 с помощта на градуирани пипети с капацитет 1, 5 и 10 cm 3; 0,6,; 1,0; 20; 3,0; 4^0; 6,0; 8,0; 10,0 cm 3 разтвор на калиев сулфат с масова концентрация на сулфатни йони 0,250 mg/cm 3 . Обемите на разтворите се довеждат до маркировките върху колбите с бидестилирана вода, разбърква се. Изчислете получените концентрации. 5 cm от всеки от приготвените разтвори се поставят в конични колби с вместимост 50 cm 3 и се добавя 1 капка разтвор на солна киселина 1:1. При непрекъснато разбъркване във всяка колба се изсипват 5 cm 3 от утаещия разтвор и се разбърква съдържанието още 10-15 s. След 40 ± 5 минути оптичната плътност на разтворите се измерва в кювета с дължина 2 cm.
Оптичната плътност на празния експеримент се изважда от оптичната плътност на разтворите, съдържащи сулфати.
Турбидиметричното определяне на калция се основава на утаяването на калций под формата на оксалат и измерването на интензитета на светлината, пропусната през разтвор, съдържащ суспензия на CaC 2 O 4 . Наличието на етанол повишава чувствителността на метода.
За определяне на калция са необходими следните реагенти: калциев карбонат CaCO 3 (c), изсушен при 110 ° C, амониев оксалат (NH 4) 2 C 2 O 4 H 2 O, 0,25 М разтвор, солна киселина HC1, 2М разтвор.
За приготвянето на стандартен разтвор на калций се изчислява част от CaCO 3, която е необходима за приготвянето на 100 ml от първоначалния стандартен разтвор с калциев титър T Ca \u003d 1 10 ~ 3 g / ml.
 Проба от CaCO 3, близка до изчислената, се претегля на аналитична везна в чаша с вместимост 50 ml и внимателно се разтваря в 10 ml разтвор на HC1, като киселина се добавя постепенно, на малки порции. Количествено се прехвърля получения разтвор в мерителна колба от 100 ml и се разрежда до маркировката с вода.
Проба от CaCO 3, близка до изчислената, се претегля на аналитична везна в чаша с вместимост 50 ml и внимателно се разтваря в 10 ml разтвор на HC1, като киселина се добавя постепенно, на малки порции. Количествено се прехвърля получения разтвор в мерителна колба от 100 ml и се разрежда до маркировката с вода.
Разреден стандартен разтвор на калций с калциев титър T Ca = 1 10 ~ 4 g / ml (разтвор 2) се приготвя чрез разреждане на първоначалния разтвор с вода 10 пъти Пипетирайте различни (от 1 до 10 ml) обеми на разреден стандарт разтвор на калциева сол (разтвор 2) и съдържанието на колбите се довежда до маркировката с вода. (Разтворите се препоръчват да се приготвят на интервали от 5 минути.
За да се увеличи чувствителността на определянето, към всяка колба могат да се добавят 5-10 ml етилов алкохол.)
Разтворите се смесват, изсипват се последователно в кюветата на оптично устройство (I = 3 cm при работа на фотоелектричен колориметър) и 5 минути след приготвянето се измерва оптичната плътност спрямо вода с филтър за зелена светлина. Въз основа на получените данни се изгражда калибровъчна графика в координатите оптична плътност-концентрация на калций.
За определяне на калция, тестовият разтвор се поставя в мерителна колба от 100 ml, разрежда се до маркировката с вода и се разбърква добре. Пипетирайте 10 ml от получения разтвор в мерителна колба с вместимост 50 ml.
Добавят се 10 ml разтвор на амониев оксалат, етилов алкохол (ако е добавен при конструирането на калибровъчната графика) от бюретата и разтворът се довежда до маркировката с вода. 5 минути след приготвянето се измерва оптичната плътност и се установява концентрацията на калций от графиката.
изследвано решение. Изчислете масата на калция в пробата от тестовия разтвор.
2.3 Реагенти. Материали. Оборудване
Фотоелектроколориметър КФК-2;
Кювети с дебелина на светопоглъщащия слой 50 и 100 mm;
Лабораторни везни, клас на точност 1, 2;
сушилня: центрофуга;
Порцеланови тигели;
Устройство за филтриране през мембранни филтри с водоструйна помпа;
Пипети отмерени, с вместимост 25, 100 ml;
Суспензията трябва да съдържа около 4g/dm 3 каолин Каолин обогатен за парфюмерийната индустрия;
Калиев пирофосфат
натриев пирофосфат,
хидразин сулфат,
хексаметидентетрамин за монокристали,
живачен хлорид,
формалин,
хлороформ;
Мембранни филтри;
Мътността се определя не по-късно от 24 часа след вземането на пробата. Пробата може да се консервира чрез добавяне на 2-4 ml хлороформ към 1 литър вода. Мътността на водата се определя фотометрично чрез сравняване на проби от изследваната вода със стандартни суспензии.
Стандартните суспензии могат да бъдат направени от каолин или триполи. Стандартните разтвори се приготвят по образец на Държавен стандарт (GSO - предназначен за калибриране и проверка на аналитични инструменти, контрол на грешките на методите за измерване (MVI), сертифициране на новоразработени MVI за съдържанието на аниони във водна и въздушна среда, почви и отпадъци ).
Приготвяне на стандартната проба (CO- се състои в предварително приготвяне на калибровъчни суспензии от нея по метода на обемно разреждане). Суспензиите от CO трябва да се приготвят при температура 20-25 градуса. По време на приготвянето на суспензията не се допускат температурни промени. заобикаляща средаповече от 20 градуса.
Обем до 50 cm 3 от разтвор на 2,5 g хексаметилентетрамин (CH 2) 6 N 4 се разрежда в мерителна колба с вместимост 500 cm 3 в 25 cm 3 дестилирана вода 25 cm 3 от разтвор А се добавя към разтвора.
За приготвяне на работни стандартни суспензии от мътния каолин, основната стандартна суспензия се разклаща и от нея се приготвя суспензия, съдържаща 100 mg/dm 3 каолин. От междинната суспензия се приготвят работни суспензии с концентрация 0,5; 1,0; 1,5; 2,0; 3,0; 4,0; 5,0 mg / dm 3. Междинната суспензия и всички работни суспензии се приготвят с бидестилирана вода и се съхраняват не повече от един ден.
За да се приготви основната стандартна суспензия на формазин I, съдържаща 0,4 IU в 1 cm 3, се взема разтвор A. 0,5 g хидразин сулфат (NH 2) 2 H 2 SO 4 се разтваря в дестилирана вода и се регулира до B и се поддържа (24 ± 2) h при температура (25 ± 5) °C. След това добавете дестилирана вода до маркировката. Основната стандартна суспензия на формазин се съхранява 2 месеца и не изисква консервиране и стабилизиране.
За да приготвите стандартна суспензия на формазин II, съдържаща 0,04 IU на 1 cm 3 разтвор, направете следното: 50 cm 3 от добре разбъркана основна стандартна суспензия на формазин I се разрежда с дестилирана вода до обем от 500 cm 3 . Стандартната суспензия на формазин II се съхранява в продължение на две седмици.
За приготвянето на работни стандартни суспензии на формазин вземете 2,5; 5,0; 10,0; 20,0 cm 3 предварително смесена стандартна суспензия на формазин II се довежда до обем от 100 cm 3 с бидестилирана вода.
 2.4 Провеждане на анализа
2.4 Провеждане на анализа
За приготвянето на основната стандартна суспензия от каолин се вземат 25-30 г каолин, разклаща се добре с 3-4 dm 3 дестилирана вода и се оставя да престои 24 ч. След 24 ч. неизбистрената част от течността се взема с сифон. В останалата част отново се налива вода, разклаща се енергично, оставя се отново за 24 часа и отново се взема средната неизбистрена част. Тази операция се повтаря три пъти, като всеки път се добавя суспензията, която не е избистрена през деня, към предишно събраната. Натрупаната суспензия се разклаща добре и след три дни течността над утайката се отцежда, тъй като съдържа твърде малки частици.
Към получената утайка се прибавят 100 cm 3 дестилирана вода, разклаща се и се получава основна стандартна суспензия. Концентрацията на основната суспензия се определя по метода на теглото (най-малко от две успоредни проби): 5 cm 3 от суспензията се поставят в тигел, доведен до постоянно тегло, изсушава се при температура 105 ° C до постоянно тегло, претегля се и се изчислява съдържанието на каолин на 1 dm 3 от суспензията.
След това основната стандартна суспензия се стабилизира с калиев или натриев пирофосфат (200 mg на 1 dm 3) и се консервира с наситен разтвор на живачен хлорид (1 cm 3 на 1 dm 3), формалин (10 cm 3 на 1 dm 3) или хлороформ (1 cm 3 на 1 dm 3).
Основната стандартна суспензия се съхранява 6 месеца. Това е основната стандартна вода за изпитване, от която суспендираните твърди вещества са отстранени чрез центрофугиране или филтриране през мембранни филтри.
За изграждане на графика за калибриране се вземат стандартни работни окачвания. Получените стойности на оптичните плътности и съответните концентрации на стандартни суспензии (mg/l) са нанесени на графика.
Преди тестване, за да се избегнат грешки, фотоколориметрите се калибрират спрямо течни стандартни суспензии за мътност или спрямо набор от твърди стандартни суспензии за мътност с известна оптична плътност.
Добре разклатена проба за изпитване се въвежда в кювета с дебелина на поглъщащия светлина слой 5-10 cm и оптичната плътност се измерва в зелената част на спектъра. Контролната течност е водата за изпитване, от която суспендираните твърди вещества са отстранени чрез центрофугиране или филтриране през мембранни филтри.
2.5 Резултати от работа
Обемът на CO, Vco, cm 3 се изчислява по формулата:
Vco \u003d X * Vk 1Xco
X е стойността на мътността, получена от суспензии, NMF;
Xco - сертифицирана стойност на мътност на CO, NMF;
Vk - обемът, използван от мерната колба, cm 3
Разтвор No 1-1 см 3 ГСО питейна вода до 1000 см 3
1cm 3 = 4 EMF
Разтвор № 2-1 см 3 разтвор № 1 питейна вода до 1000 см 3
1 см 3 = 0,04 UMF
Vcm 3 разтвор № 2 + питейна вода до 1000 cm 3 à и направете анализ за KFK-2
Мътността се определя по формулата:
2.6 Заключение
Питейната вода трябва да бъде епидемично безопасна, безвредна по химичен състав и да има благоприятни органолептични свойства.
Качеството на водата се определя от нейния състав и свойства при постъпване във водопроводната мрежа; в точките на водовземане на външната и вътрешната водопроводна мрежа.
Микробиологични показатели. Епидемиологично безопасността на водата се определя от общ броймикроорганизми и броя на бактериите от групата на Escherichia coli.
По микробиологични показатели питейната вода трябва да отговаря на изискванията.
Токсикологичните показатели за качеството на водата характеризират нейната безвредност. химичен състави включват стандарти за вещества:
възникващи в резултат на промишлени, селскостопански, битови и други замърсявания на водоснабдителни източници.
Концентрация химични веществаоткрити в естествени води или добавени към водата по време на нейната обработка, не трябва да надвишават стандартите.
Органолептичните показатели, които осигуряват благоприятни органолептични свойства на водата, включват стандарти за вещества:
намира се в естествени води;
добавен към вода по време на обработката под формата на реагенти;
в резултат на промишлени, селскостопански и битово замърсяванеизточници на водоснабдяване.
 Концентрациите на химикали, които влияят на органолептичните свойства на водата, намиращи се в естествени води или добавени към водата по време на нейната обработка, не трябва да надвишават стандартите
Концентрациите на химикали, които влияят на органолептичните свойства на водата, намиращи се в естествени води или добавени към водата по време на нейната обработка, не трябва да надвишават стандартите
Водата не трябва да съдържа водни организми, видими с просто око и не трябва да има филм на повърхността.
Химични концентрации , присъства във водата в резултат на промишлено, селскостопанско и битово замърсяване, не трябва да надвишава ПДК, одобрена от Министерството на здравеопазването на СССР за водата от питейни и питейни водни обекти. културно и обществено ползване на водатапо органолептични и санитарно-токсикологични характеристики, както и стандарти за радиационна безопасност NRB-76/87. Ако във водата се открият такива химикали със същия ограничаващ знак за вредност, сумата от съотношенията на установените концентрации във водата и техните ПДК не трябва да бъде повече от 1.
Питейна вода е вода, която е предназначена за ежедневна неограничена и безопасна консумация от хора и други живи същества. Основната разлика от столовите и минерални водие ниско съдържание на сол (сух остатък), както и наличието на съществуващи стандарти за общ състави имоти.
Проверяват се миризмата, вкуса, мътността, цвета, твърдостта на питейната вода, това е общо за всички видове вода.
Мътността на водата е индикатор, който характеризира намаляването на прозрачността на водата поради наличието на неорганични и органични фини суспензии.
Заключение: резултатите от анализа са удовлетворени, тъй като отговарят на стандартите за толеранс (виж Приложение 4)
3.Заключение
Сигурно всеки знае това човешкото тялоЗа нормален живот е необходима на първо място чиста питейна вода. Водата е основното средство за доставяне на микроелементи до всички части на нашето тяло. Чистата питейна вода е незаменима в процесите на растеж и хранене на тялото, чистата питейна вода осигурява стабилно температурно ниво в организма, а в случаи на нужда именно водата може да запълни липсващите, но жизненоважни ресурси в организма и сменете ги за известно време.
В бързия ритъм на нашия живот доста често тялото изпитва липса на воден баланс в тялото. Това се проявява в лека жажда, но най-често поради голям клъстердела, ние не обръщаме внимание на това чувство, особено ако няма източник на вода под ръка. А последствията от липсата на течности в организма се отразяват много плачевно върху нашето здраве: веднага щом тялото престане да има достатъчно вода, всички физиологични цикли се заблуждават, тези ресурси, които тялото запазва за „черен ден“ или особено извънредни ситуации. Тялото намери вода, но за да компенсира липсващия ресурс, изразходван за вода - тялото се опитва да го обнови възможно най-бързо и дори с марж - оттук и допълнителното тегло "на лицето", а не само върху лицето, но по цялото тяло. Това не е единствената последица от "леката жажда": механизмите на храносмилането, метаболизма, кръвообращението и дори мозъчна дейност. Всичко това заплашва с преумора, загуба на внимание, главоболие. Но това не е всичко. Ако тялото редовно не получава достатъчно вода по време на активния период на деня, това заплашва със сериозни неуспехи в почти всички системи на тялото, в резултат на което липсата на вода води не само до влошаване на "слабите места" в нашето тяло, но и до появата на нови заболявания. Чистата вода, както вече споменахме, е от голямо значение в човешки животживотински живот,  флораи природата като цяло. Капацитетът на всички живи клетки зависи от наличието на вода. Изследвайки ролята, която водата играе за човек, може да се види, че цялото ни тяло е колекция от водни разтвори, колоиди, суспензии и други сложни водни системи.
флораи природата като цяло. Капацитетът на всички живи клетки зависи от наличието на вода. Изследвайки ролята, която водата играе за човек, може да се види, че цялото ни тяло е колекция от водни разтвори, колоиди, суспензии и други сложни водни системи.
Водата обогатява клетките на тялото хранителни вещества(витамини, минерални соли) и премахва отпадните продукти (шлаки). Освен това водата участва в процеса на терморегулация (изпотяване) и в процеса на дишане (човек може да диша много сух въздух, но относително малко време). За нормалното функциониране на всички системи човек трябва да пие поне 1/5 литър вода на ден.
В резултат на това чистата вода, консумирана от човек, е необходима за правилното му функциониране. Следователно основният въпрос на нашето хранене е редовното използване на вода чрез въвеждането й в тялото в свободна форма и в храната, както и задължителното използване на прецизно чиста вода. Следователно питейната вода трябва да бъде пречистена. Тестът за мътност на питейната вода също е неразделна част, която пречиства водата и проверява качеството.
Мътността на водата е индикатор, който характеризира намаляването на прозрачността на водата поради наличието на неорганични и органични фини суспензии, както и развитието на планктонни организми. Причините за мътността на водата могат да бъдат наличието на пясък, глина, неорганични съединения (хидроксид, алуминий, различни карбонати, метали), както и органични примеси или живи същества, като бактерио-фито- или зоопланктон.
Така в срочна писмена работаотразява стойността на индикатора за качество дефиниция на питейна водамътност.
4. Литература
Резюмета:
Резюме по дисциплина: " Аналитична химия»
Резюме по дисциплина: " Технически анализ»
Реферат по дисциплина: "Физически и химични методи на анализ"
Резюме по дисциплина: "Спектрален анализ"
"Основи на техническия анализ". Писаренко В.В. и Захаров Л,С. Издателство " висше училище". Москва 1972г
„Технически анализ на контрола”. Августинович И.В., Андрианова С.Ю. Москва. Издателски център "Академия" 2010г
„Промишлено обучение на лаборанти на химици”. Гурвич Я.А. Москва. "Гимназия" 1987г
"Основи на аналитичната химия". Книга 1. Иванов В.М. Гармаш А.В
Доролова Ю.А. Москва. "Гимназия" 2004г
"Аналитична химия". А. А. Ишченко. Москва. Издателски център "Академия" 2012г
ГОСТ 3351-74 Питейна вода. Методи за определяне на вкус, мирис, цвят и мътност;
ГОСТ 4192-82 Питейна вода. Методи за определяне минерали
GOST 2874-82 Питейна вода. Хигиенни изискванияи контрол на качеството на водата.
Статии по аналитична химия, програми, съобщения.
Химически форум Chemforum.ru съдържа информация за химическа индустрияРусия и ОНД. Това е разнообразен информационен център за предприятия в химическата и свързаните с нея индустрии в Русия и ОНД.
chem.msu.su - на сайта "Химическа наука и образование в Русия": " Дигитална библиотекапо химия" - chem.msu.su (раздел "Материали за ученици") и "Училищно образование по химия в Русия: стандарти, учебници, олимпиади, изпити" - chem.msu.su (Материали за учители и ученици).
school-sector.relarn.ru - "Химия за ВСИЧКИ"от поредицата "Образователни енциклопедии".
 Областна държавна автономия образователна институция
Областна държавна автономия образователна институция
среден професионално образование
"Староосколски индустриален колеж"
КУРСОВА РАБОТА
В дисциплината "Физични и химични методи на анализ"
"Фотометрично определяне на мътността на питейната вода по турбидиметричен метод"
KR. 240308.4979.00.00.PZ
Попълва се от ученик Требунских Олга Михайловна
Група АК 44специалност" Аналитичен контрол на качеството химични съединения »
Защитено с рейтинг _____________
Ръководител на проекта __________ "___" ________ 2014 г. Семерджиева Е.В.
