Caracteristicile principalelor metode de analiză a apei. Metode chimice de cercetare a apei
Sub oxidabilitateînțelegeți capacitatea substanțelor organice din apă de a fi oxidate de oxigenul atomic. Valoarea oxidabilității se exprimă prin cantitatea de oxigen (mg) necesară pentru oxidarea substanțelor organice conținute în 1 litru de apă. Sursa de oxigen atomic în aceste reacții este permanganatul sau bicromat de potasiu, iar oxidabilitatea se numește respectiv permanganat sau dicromat. De obicei, oxidabilitatea se determină în apă acidă, dar când conținutul de cloruri în apă este mai mare de 300 mg/l și este foarte poluat, studiul se realizează într-un mediu alcalin.
Metoda permanganatului (după Kubel). Bazat pe capacitatea permanganatului de potasiu de a elibera oxigen într-un mediu acid. După cantitatea de oxigen consumată, se apreciază oxidabilitatea apei.
Tacâmuri și ustensile: biurete, pipete de 5 ml, baloane de 250-300 ml, cilindri de măsurare de 100 ml, eprubete, mărgele de sticlă, pâlnii cu diametrul de 5-7 cm.
Reactivi:
1) o soluție de permanganat de potasiu (0,01 N) - pentru aceasta, 0,316 g de medicament se dizolvă în 1 litru de apă distilată; 1 ml din această soluție corespunde la 0,08 mg de oxigen. Soluția a fost păstrată într-o sticlă de sticlă închisă la culoare
acoperiți și verificați cu fiecare serie de studii;
2) soluție acid oxalic(0,01 n) - pentru preparare se cântăresc 0,63 g acid și se dizolvă în 1 litru de apă distilată; 1 ml de soluție necesită 0,08 mg de oxigen pentru oxidarea sa;
3) o soluție de acid sulfuric (25%) cu o densitate de 1,84 g/cm3 cub
volum (1:3) în apă distilată.
Metodă de cercetare.
1) Într-un balon conic de 250 ml se pun mai multe mărgele de sticlă și se toarnă 100 ml apă, se adaugă 5 ml acid sulfuric (1: 3) și 10 ml soluție de permanganat de potasiu (0,01 N). Amestecul se încălzește rapid la fierbere (în 5 minute) și se ține la foc mic aproximativ 10 minute. După aceea, balonul este îndepărtat (soluția ar trebui să aibă culoarea roz) și la soluția fierbinte se adaugă 10 ml de soluție de acid oxalic (0,01 N). Soluția fierbinte decolorată (la o temperatură de 80 0 C) se titrează cu o soluție de permanganat de potasiu (0,01 N) până se obține o culoare roz deschis stabilă. Dacă lichidul investigat devine incolor sau devine maro deschis în timpul fierberii, atunci cercetările ulterioare sunt oprite și soluția este turnată. Luați o nouă porție de apă și pre-diluați-o cu apă distilată de 2 sau 5 ori și repetați testele, așa cum s-a menționat mai sus.
2) Normalitatea soluției de permanganat de potasiu (valoarea K) se stabilește după cum urmează. Se toarnă 100 ml apă distilată într-un balon de 250 ml, se adaugă 5 ml acid sulfuric (25%) și 10 ml soluție de permanganat de potasiu (0,01 N). Lichidul se încălzește și se fierbe timp de 10 minute la foc mic. Apoi se adaugă 10 ml de soluție de acid oxalic (0,01 N) la lichidul fierbinte, rezultând decolorarea. După aceea, cât este fierbinte, se titrează cu o soluție de permanganat de potasiu (0,01 N) până se obține o culoare roz pal.
Factorul de corecție (K) pentru titrul soluției de permanganat de potasiu 0,01 N se calculează prin formula:
unde 10 este cantitatea de 0,01 n soluție de acid oxalic, ml; b - cantitatea de soluție de permanganat de potasiu 0,01 n adăugată înainte de fierbere și utilizată apoi pentru titrare, ml.
3) Oxidabilitatea apei se calculează prin formula:
unde X este oxidabilitatea oxigenului în mg per 1 litru de apă; a - cantitatea de KMPO 4 în ml, turnată înainte de fierbere; b este cantitatea de KMPO 4 utilizată pentru titrare în ml; K - factor de corecție la normalitatea KMnO 4 ; 10 - cantitatea de KMPO 4 cheltuită pentru oxidarea acidului oxalic; 0,08 - cantitatea de oxigen corespunzătoare la 1 ml de soluție 0,01 n de KMnO 4 ; 1000 - se transferă la 1 litru de apă; C este volumul de apă luat pentru analiză, ml.
Notă: dacă proba de apă de testat este diluată cu apă distilată, atunci este necesar să se verifice conținutul de substanțe organice și, la calcularea oxidabilității, să se scadă cantitatea de KMnO 4 care a mers la oxidarea substanțelor organice în apă distilată.
Datorită faptului că unii compuși minerali (oxidici) - fier, mangan, nitriți, hidrogen sulfurat - pot fi și ei oxidați în apă, cu un conținut semnificativ al acestora, este necesar să se țină seama de efectul asupra valorii de oxidabilitate ( experimentul se efectuează fără încălzire).
Determinarea oxidabilității în mediu alcalin (după Schultz). Această metodă este aplicabilă pentru a determina oxidabilitatea apei contaminate cu cloruri etc.
Reactivi:
1) o soluție de permanganat de potasiu (0,01 N) - pentru aceasta, 0,316 g de medicament se dizolvă în 1 litru de apă distilată;
2) soluție de hidroxid de sodiu 50%;
3) o soluție de acid oxalic (0,01 n) - pentru a o prepara, se cântăresc 0,63 g de acid și se dizolvă în 1 litru de apă distilată;
4) Soluție de acid sulfuric 20%.
Metodă de cercetare.
Într-un balon conic se toarnă 100 ml apă, se adaugă 0,5 ml soluție de hidroxid de sodiu 50% și 10 ml soluție de permanganat de potasiu (0,01 N). Lichidul se încălzește și se fierbe timp de 10 minute de la începutul apariției primelor bule, se răcește la 50-60 ° C, se adaugă 5 ml acid sulfuric, 10 ml soluție de acid oxalic 0,01 N (lichidul trebuie să se decoloreze). ; dacă nu este cazul, mai adăugați câțiva ml de acizi oxalici). Se titează apoi cu o soluție 0,01 N de permanganat de potasiu până când apare o culoare roz slab, care nu dispare în 3-5 minute. Calculul se face după aceeași formulă ca și conform metodei Kubel, rezultatul se exprimă în mg de oxigen pe litru.
Metoda expresă pentru determinarea oxidabilității. Se toarnă 10 ml de apă într-o eprubetă și se adaugă 0,5 ml dintr-o soluție de acid sulfuric diluat 1:3 și 1 ml dintr-o soluție de permanganat de potasiu 0,01 N. Amestecul se amestecă bine și se lasă singur timp de 20 de minute la o temperatură de 20 0 C și timp de 40 de minute la o temperatură de 10-20 0 C. După aceea, soluția se examinează din lateral și de sus și se determină oxidabilitatea. după culoare, care depinde de culoare. Deci, o culoare roz-miere strălucitoare corespunde cu 1, roz liliac - 2, roz liliac slab - 4, roz liliac pal - 6, roz pal - 8, roz-galben - 12, galben - 16 mg O 2 / l și mai sus.
Azot amoniac și săruri de amoniu. Cantitatea de amoniac și azot de amoniu din apă este determinată printr-o metodă colorimetrică, a cărei esență este că atunci când reactivul Nessler este adăugat în apa de testare, se formează iodură de mercuramoniu, care colorează apa în galben intensitate variabilă în funcţie de conţinutul de amoniac. După adăugarea reactivului Nessler, proba de apă este comparată cu o soluție standard de clorură de amoniu care conține o cantitate cunoscută de azot de amoniu. Pentru colorimetrie este potrivită apa cu o concentrație de amoniac în intervalul 0,1-10 mg/l.
Tacâmuri și ustensile: colorimetru fotoelectric - FEC, pipete 1 si 5 ml, baloane 100 ml, cilindru gradat 100 ml si eprubete.
Reactivi:
1) reactiv Nessler;
2) soluție standard de clorură de amoniu, cu un conținut de azot de 0,001 mg
în 1 ml;
3) soluție apoasă 50% de sare Rochelle;
4) un amestec alcalin format din 50 g hidroxid de sodiu și 100 g dioxid de carbon
sifon dizolvat în 300 ml apă distilată (soluția preparată se fierbe timp de 15 minute și se filtrează prin lână de azbest);
5) hidroxid de aluminiu.
Pregătirea apei pentru analiză: acuratețea determinării conținutului de azot amoniac și săruri de amoniu din apă este afectată de culoarea și duritatea acesteia, conținutul de fier, sulfiți și dioxid de carbon liber. Pentru a decolora 500 ml de apă, se adaugă 0,5 g hidroxid de aluminiu și se depune precipitatul timp de 2 ore,
Sulfurile se determină astfel: la 10 ml apă se adaugă 1 ml de reactiv Nessler și apoi 2 ml de soluție de acid sulfuric (1: 3). Dacă turbiditatea nu dispare după acidificarea apei, atunci aceasta conține sulfuri, care trebuie îndepărtate prin adăugarea a 10 picături dintr-o soluție 30% de acetat de zinc la 100 ml de apă. După aceea, apa se depune timp de 2 ore, se scurge partea transparentă și se prelevează probe din ea pentru cercetare.
Când duritatea apei este mai mare de 3,5 mg/echiv. Îl înmoaie, pentru aceasta se adaugă 2 ml de sodă caustică la 100 ml de apă și soluția se stabilește timp de 2 ore.
Metodologia de cercetare. Într-un balon se toarnă 100 ml dintr-o soluție standard de clorură de amoniu, iar în celălalt se toarnă 100 ml din apă de testare. Apoi, în ambele baloane se adaugă 3 ml dintr-o soluție 50% de sare Rochelle și 2 ml de reactiv Nessler. Conținutul baloanelor se agită și se lasă singur timp de aproximativ 10 minute până când apare culoarea.
Colorimetria se efectuează pe FEC cu un filtru de lumină albastră (Nr. 4) în cuve de 1-5 cm grosime. densitate optica soluție standard a apei de testare la exact 10 minute după adăugarea reactivului Nessler (se ia în considerare ordinea în care se adaugă reactivii și colorimetria acestora). Calculul se efectuează după formula:
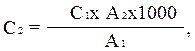
unde C2 este concentrația de amoniac și azot de amoniu din apa de testare, mg/l; C 1 - aceeași într-o soluție standard de clorură de amoniu, mg/l; A 1 - densitatea optică a unei soluții standard de clorură de amoniu (scara roșie); A 2 - densitatea optică a apei studiate (pe o scară roșie); 1000 - transfer la 1 litru.
Determinarea amoniacului printr-o metodă aproximativă. Se toarnă într-o eprubetă
10 ml de apă investigată, se adaugă 0,2-0,3 ml de soluție 50% de Rochelle
sare, amestecați bine și adăugați reactivul Nessler. Definiţia ammonia
plumb conform tabelului 38.
nitrit de azot. Principiul studiului este că apa care conține nitriți, atunci când se adaugă reactivul Griess, devine roz. Pentru a detecta nitriții, utilizați reactivul Griess - o soluție de alfa-naftalamină și acid sulfanilic în acid acetic. Când conținutul de nitriți în apă este mai mare de 0,3 mg/l, apa devine galbenă. Limita de sensibilitate a reactivului este de 0,01 mg/l de nitriți.
Este posibil să se calculeze și să instaleze un sistem de purificare a apei de înaltă calitate la orice întreprindere, la orice instalație numai prin efectuarea unei analize a apei. Astăzi sunt cele mai multe diferite variante analize, dar rămâne totuși o prioritate. Fără datele sale, este imposibil să se facă tratare a apei de înaltă calitate. Timpul nu stă pe loc și metode moderne analiza chimica apă permite generației actuale, în aceleași condiții, să obțină mult mai multe informații.
Analize de laborator: Implicații pentru sănătatea umană
Trebuie remarcat faptul că progresul tehnologic a adus nu numai noi tehnologii în viața oamenilor, ci și probleme de mediu. Apa murdara este sursa infecției. Și este imposibil să faci fără metode de curățare, pur și simplu este imposibil. Oamenii de știință spun că, ca urmare a tratamentului de proastă calitate, mai mult de 70% din apa consumată de oameni este neînsuflețită. Adică, cu siguranță nu va exista niciun beneficiu de la o astfel de apă.
Există anumite standarde care se aplică pentru calitatea apei. Au fost dezvoltate pentru a obține apă cel puțin acceptabilă pentru consum. Dar, din păcate, majoritatea resurselor de apă din sisteme centralizate nu îndeplinesc aceste standarde. În întreaga lume, oamenii de știință încearcă să atragă atenția asupra calității apei și problemelor acesteia. Și moduri moderne analiza chimică a apei în acest aspect ocupă o nișă considerabilă, ajutând la rezolvare întreaga linie Probleme.
Iar primul lucru care ajută la rezolvarea unei astfel de analize este evaluarea calității apei. Și astăzi trebuie să înțelegeți că, deși evaluarea calității apei se realizează în funcție de aceiași parametri, are propriile caracteristici pentru apa de la, de la, de la. Setul de parametri este similar, dar totuși ușor diferit. Prin urmare, atunci când comanda o analiză, utilizatorul trebuie să indice clar ce anume trebuie evaluat și cum dorește să fie evaluată apa după compoziția chimică sau bacteriologică.
Va trebui să analizezi apa în orice caz, din orice sursă. Astfel de rezultate sunt o garanție a siguranței pentru consumatori și întreprindere. Cel mai bine este să efectuați o astfel de procedură în laboratoare specializate. Fiecare laborator trebuie să aibă un certificat de confirmare. Și este eliberat întreprinderilor de orice formă de proprietate.
Analizele se pot face în două direcții - bacteriologice și chimico-fizice. Metode moderne analizele chimice aparțin grupei a doua. Aici sunt afișate atât parametrii de duritate, cât și de turbiditate, tot felul de mirosuri, se verifică incluziunile organice și anorganice din apă.
Se poate face fara analize bacteriologice doar in cazul evaluarii apei de la robinet, cu alimentarea centrală cu apă. De regulă, o astfel de apă a fost deja dezinfectată. În toate celelalte cazuri, evaluarea ar trebui să se desfășoare în complex.
Proiectarea epurării apei în orice scop presupune în orice caz o evaluare a stării resurselor de apă. Nu există nicio analiză - nu există echipamente de înaltă calitate pentru purificarea apei.
Pentru ca totul să meargă bine, puteți, conform regulilor, să efectuați singur selecția apei. Dar pentru a garanta absența erorilor de estimare, cel mai bine este să apelați la un specialist acasă sau la o întreprindere.
Evaluarea apei a devenit o parte a vieții umane astăzi. Și atât la serviciu, cât și acasă. Dacă un utilizator de resurse de apă dorește să-și asigure propria sănătate, atunci legătura potrivită este indispensabilă - evaluarea apei + sistem corect purificare.
Este la fel de important să răspundem la întrebarea - cât de des să analizăm apa? Nu este un secret pentru nimeni că compoziția apei se modifică în timp. Și ce ar trebui să facă proprietarul unei case private? Cum și în ce ordine trebuie efectuate testele? De ce să te apuci?
O mică excursie pentru începători. Cei care tocmai au echipat o fântână pe site-ul lor, în fara esec efectuați o analiză chimică completă a apei de două ori. Înainte și după instalare. Prima dată este clară. Al doilea este efectuat pentru a evalua corectitudinea sistemului de purificare compilat. Oferă posibilitatea de a corecta erorile.
Pe viitor, când va fi exploatată puțul, primul an - se analizează o dată la trei luni, apoi se poate face o dată la 12 luni. Poate că un astfel de număr de analize va părea redundante pentru cineva, dar două caracteristici trebuie amintite întotdeauna:
- Cei care au săpat singuri ar trebui să înțeleagă că controlul asupra stării apei se află în întregime pe umerii lor și, prin urmare, vor trebui să-l controleze singuri și toată viața;
- Când lucrați cu propria fântână, orice se poate întâmpla, proprietarul casei poate să nu știe că există o substanță chimică undeva în apropiere. fabrică mică și literalmente zilele trecute, o țeavă cu deșeuri a spart acolo. În același timp, starea apei a devenit nu doar periculoasă, ci critică, la fel ca atunci când, nu au observat acviferul și deșeurile din haznaîntregul sat, iar acest fapt poate deveni clar după jumătate de an de funcționare.
În niciun caz, efectuarea unei analize chimice la început nu este deloc o întreprindere fără scop. În plus, astăzi este posibil să se utilizeze cele mai eficiente și mai moderne metode de analiză chimică a apei.
Opțiuni moderne pentru cercetarea apei
Astăzi, există mai multe opțiuni pentru studiul apei, cele mai multe dintre ele chimice. Un lucru rău este că nu toate laboratoarele fac astfel de teste. Unele metode sunt atât de noi și progresive încât pot fi făcute numai în străinătate. Mai jos este un tabel al metodelor moderne de analiză în sine. Cele mai unice pentru astăzi sunt analizele spectrometrice cromato-masă, activarea luminiscentă și neutronică. Acestea din urmă sunt efectuate în general la nivel de neutroni, la microscop cu o precizie foarte mare.
|
Tipul analizei |
Metodologie |
|
După volum |
|
|
Electrochimic |
Potențiometru polarografie |
|
Foto-, Spectrometric Luminescent |
|
|
Foto+chimie |
Fotochimic |
|
Cromatografia |
Coloane lichide Lichid de înaltă eficiență |
Pentru a efectua analiza corectă, este necesar să selectați corect apa. Pentru a face acest lucru, puteți lua o sticlă obișnuită de apă plată, nu carbogazoasă sau dulce. Apa se scurge de la robinet timp de cel puțin 15 minute. Apoi sticla este spălată (FĂRĂ FUNCȚII), și sunt tastate chiar sub gât. Se toarnă un jet subțire de-a lungul părții laterale a sticlei. Este mai bine să-l duceți imediat la laborator. Il poti tine la frigider maxim 24 de ore.
Una dintre metodele moderne de analiză este evaluarea chimică a apei conform unei liste extinse. Această metodă este utilizată la evaluarea puțurilor sau puțurilor de mică adâncime. Datorită adâncimii sale mici, există riscul de a contamina apa cu tot felul de impurități dăunătoare. Prin urmare, o astfel de apă trebuie examinată luând în considerare următorii parametri:
- Organice - pe lângă sărurile metalice standard, acestea vor include clorură de vinil, tetraclorură de carbon, acrilamidă etc.;
- Anorganice - se verifică prezența nu numai a impurităților solide, ci și a sărurilor de nichel, plumb, zinc etc.;
- Impurități microbiologice - aici se examinează E. coli, lambia, în general, o gamă ceva mai largă bacterii dăunătoare decât cu analiza bacteriologică convențională;
- Deoarece apa este extrasă de la o adâncime mică, există un risc mare și un numar mare, impurități pesticide, astfel încât acestea sunt depistate - metoxiclor, toxafol, endrina etc.;
- Impurități radionuclide și erbicide, motivul este același - se determină conținutul de peclorofenol, atracină, se determină numărul de particule încărcate și radiu.
Kit de testare
Un kit de testare poate fi citat ca exemplu de metodă modernă de analiză chimică a apei. Aceasta este o metodă foarte convenabilă care vă permite să evaluați rapid resursele de apă, aproape în teren.

Acest kit de testare contine un set complet consumabil pentru 100 de tipuri de analize. Și totul se face rapid și simplu. Și toate analizele îndeplinesc cerințele pentru metodele de analiză. Astfel de truse de testare sunt bune pentru că vă permit să verificați rapid compoziția apei, o dată pe trimestru. Adică, pentru monitorizarea stării apei, un astfel de set este cel mai optim. Mai mult, evaluatorul va primi rezultatele selecției chiar acolo pe loc, fără deplasări la laborator și așteptări.
Această metodă face posibilă evaluarea ambelor apa tehnica. Eroarea de indicații corespunde cercetărilor de laborator. Fluctuează între 25-30 la sută. Dar pentru viteză, acesta este un preț complet acceptabil, iar apelarea unui specialist cu un astfel de kit va ajuta la evaluarea stării apei chiar și în zonele cele mai îndepărtate și greu accesibile, ceea ce este important.
Astfel de truse sunt produse în cantitate de 12 truse la 100 de teste. Adică este și destul de economic.
Evaluarea apei a fost întotdeauna și rămâne componenta principală a oricărui sistem de tratare. Va fi o întreprindere industrială puternică sau o mică casă privată. Dar să faci fără rezultatele prezenței diferitelor impurități în apă nu va funcționa. Nu puteți cheltui bani la întâmplare pe dispozitive atât de serioase, precum cele de curățat. Doar un plan clar și o evaluare. De aceea este imposibil de subestimat astăzi importanța metodelor chimice de analiză. Fără ele, tratarea apei de înaltă calitate nu poate fi văzută de mai mult de un consumator.
Introducere
Relevanța subiectului este determinată de faptul că este important să cunoaștem sensul bând apăși proprietățile sale. Apa este una dintre cele mai comune substanțe din natură (hidrosfera ocupă 71% din suprafața Pământului). Apa aparține rol esentialîn geologie, istoria planetei. Organismele vii nu pot exista fără apă.
În funcție de caracteristicile de origine, compoziție sau aplicare, există:
apa moale si apă dură, apa dulce, apa de ploaie, apa topită, Apele subterane, apă minerală, apă distilată, apă uzată și apă potabilă.
Printre principalii indicatori ai calității apei potabile se numără:
Apa care nu dăunează sănătății umane și care îndeplinește cerințele standardelor actuale de calitate se numește apă potabilă, dacă este necesar, pentru ca apa să respecte standardele sanitare și epidemiologice, este verificată, purificată sau, oficial vorbind, „preparată” folosind statii de tratare a apei.
Ape uzate - orice apă și precipitare, deturnat către corpuri de apă din teritorii întreprinderile industrialeși zonele populate prin sistemul de canalizare sau prin gravitație, ale căror proprietăți au fost degradate ca urmare a activității umane.
Apele uzate pot fi clasificate după următoarele semne:
Productie
Canalizare de suprafață
Oamenii, animalele și plantele sunt în mare parte apă, inclusiv oameni: apa reprezintă 70% din greutatea corpului nostru. Poate că, în prevalența apei, în faptul că totul este „pătruns și îmbrățișat de apă”, și principalul său proprietate unică.
A doua proprietate ca importantă este capacitatea apei de a dizolva substanțe. Apa este un solvent universal. Din acest motiv, compoziția sa nu se limitează la formula H2O.
A treia proprietate unică a apei este că pe Pământ este prezentă simultan în trei stări sau, folosind terminologia fizică, în trei faze - gazoasă, lichidă și solidă, adică sub formă de vapori de apă, de fapt apă lichidă și gheață. Nu încercați să găsiți o altă substanță care să aibă aceeași proprietate! Luați, de exemplu, oxigenul gazos - se transformă într-un lichid la o temperatură de -183 °C și într-o fază solidă la -218 °C. Fier, metal solid, devine lichid (topită) la +1539 °C și trece în stare de vapori la o temperatură uriașă de +3200 °C.
Apa multor izvoare apa dulce nu este potrivit pentru băutura umană, deoarece poate răspândi boli sau poate cauza probleme de sănătate pe termen lung dacă nu îndeplinește anumite standarde de calitate a apei:
Apa care nu dăunează sănătății umane și care îndeplinește cerințele standardelor actuale de calitate se numește apă potabilă, dacă este necesar, pentru ca apa să respecte standardele sanitare și epidemiologice, este verificată, purificată sau, oficial vorbind, „preparată” folosind statii de tratare a apei. Este important să cunoaștem definiția turbidității apei, deoarece de aceasta depinde sănătatea oamenilor.
Turbiditate apă - indicator care caracterizează scăderea transparenței apei datorită prezenței suspensiilor fine anorganice și organice, precum și a dezvoltării organismelor planctonice. O să vă povestesc puțin despre Uzina Mecanică Starooskol.
Starooskolsky instalatie mecanica este principalul producător de oțel și împușcături de fier din țară. De asemenea, produce utilaje miniere și echipamente de foraj, instalații de ventilație și duș pentru producția metalurgică la cald; Bunuri de consum comun.
Pentru fabricarea produselor, din gama existentă, fabrica utilizează procese tehnologice care fac posibilă producerea tuturor principalelor tipuri de redistribuire utilizate în industria ingineriei. Controlul analitic al tuturor proceselor de producție se realizează în fabrică. Controlul analitic al producţiei include uz practic teorie și metode de chimie analitică pentru determinarea compoziției obiectelor specifice oricărei producții.
Controlul producției este utilizat pentru a verifica calitatea produselor și progresul proces tehnologic, pentru a preveni căsătoria și a asigurat
stabilite prin reguli şi specificații calitatea produselor fabricate.
Indicatorii de calitate cuprind următorii indicatori: scopul mărfurilor, fiabilitatea mărfurilor, caracterul prietenos al mărfurilor cu mediul înconjurător, indicatorii ecologici ai mărfurilor, indicatorii ergonomici, indicatorii ergonomiei, indicatorii fabricabilitatea mărfurilor, estetica mărfurilor. (Vezi Anexa 3)
Pe lângă controlul producției, la fabrică este monitorizată constant compoziția apei potabile și potabile. apa reziduala diverse metode chimice şi chimico-fizice.
Scopul lucrării de curs: studiul calității apei potabile în funcție de determinarea turbidimetrică a turbidității.
 Conţinut
Conţinut
1.Introducere…………………………………………………………………………………….5
2. Partea principală………………………………………………………………………..9
2.1 Esența metodelor fizico-chimice de analiză……………………………………… 9
2.2 Determinarea fotometrică a turbidității apei potabile prin metoda turbidimetrică conform GOST 3351-74……………………………….12
2.3 Reactivi. Materiale. Echipament………………………………………19
2.4 Analiză…………………………………………………………..21
2.5 Prelucrarea rezultatelor………………………………………………………23
2.6 Concluzie……………………………………………………………………………….24
3.Concluzie………………………………………………………………………...26
4. Literatură………………………………………………………………………………….28
5. Aplicare
2. Partea principală
Esența metodelor fizico-chimice de analiză
Analiza metodelor fizico-chimice (PCMA)., se bazează pe dependența proprietăților fizice ale unei substanțe de natura sa, iar semnalul analitic este cantitatea proprietate fizică, raportat funcțional la concentrația sau masa componentei determinate.
Metodele fizico-chimice (PCMA) de analiză pot include transformarea chimică a analitului, dizolvarea probei, concentrația analitului, mascarea substanțelor interferente și altele.
Spre deosebire de metodele chimice „clasice” de analiză, în care masa unei substanțe sau volumul acesteia servesc drept semnal analitic, în metodele fizico-chimice de analiză, intensitatea radiației, puterea curentului, conductivitatea electrică, diferența de potențial etc. semnal.
Important valoare practică au metode bazate pe studiul emisiei și absorbției radiatie electromagneticaîn domenii diverse spectru.
Acestea includ spectroscopia (de exemplu, analiza luminiscentă, analiza spectrală, nefelometria și turbidimetria și altele). Metodele fizico-chimice importante de analiză includ: metode electrochimice care utilizează măsurarea proprietăți electrice substanțe, coulometrie, potențiometrie etc.), precum și cromatografia (de exemplu, cromatografia în gaz, cromatografia lichidă, schimbul de ioni, cromatografia, cromatografia în strat subțire).
 Metodele bazate pe măsurarea vitezelor sunt dezvoltate cu succes reacții chimice(metode cinetice de analiză), efectele termice ale reacțiilor (titrare termometrică), precum și asupra separării ionilor într-un câmp magnetic (spectrometrie de masă).
Metodele bazate pe măsurarea vitezelor sunt dezvoltate cu succes reacții chimice(metode cinetice de analiză), efectele termice ale reacțiilor (titrare termometrică), precum și asupra separării ionilor într-un câmp magnetic (spectrometrie de masă).
Atunci când se efectuează metode fizico-chimice de analiză, se folosesc echipamente de măsurare speciale, uneori destul de complexe și, prin urmare, aceste metode sunt adesea numite instrumentale. Mulți aparate moderne echipat cu calculatoare încorporate care vă permit să găsiți conditii optime analiza (ex., regiunea spectrală pentru obținerea celor mai precise rezultate la analiza unui amestec de substanțe colorate), efectuez. În aproape toate metodele fizico-chimice de analiză se folosesc două metode principale: metode de măsurători directe și titrare.
Metodele directe folosesc dependența semnalului analitic de natura analitului și concentrația acestuia. Dependența semnalului de natura substanței - baza analiza calitativa(potenţial de semi-undă în polarografie etc.). În unele metode, legătura dintre semnalul analitic și natura substanței este stabilită strict teoretic. De exemplu, spectrul unui atom de hidrogen poate fi calculat folosind formule derivate teoretic. În analiza cantitativă se utilizează dependența intensității semnalului de concentrația unei substanțe.
Valorile numerice ale constantelor din ecuația de cuplare sunt determinate experimental folosind probe standard, soluții standard etc. Numai în coulometrie bazată pe legea lui Faraday nu este necesară definirea constantelor.
Cele mai răspândite în practică sunt următoarele metode de determinare a constantelor ecuației de comunicare sau, ceea ce este același, metode de mărime, analiză folosind măsurători fizico-chimice:
1) Metoda curbei de calibrare. Intensitatea semnalului analitic este măsurată pentru mai multe probe standard sau soluții standard și este trasat un grafic de calibrare în coordonatele I=f(c) sau I=f(lgc), unde C este concentrația componentului din soluția standard. sau eșantion standard. În aceleași condiții, se măsoară intensitatea semnalului probei analizate și se găsește concentrația din curba de calibrare.
2) Metoda proprietății molare este utilizată în cazurile în care ecuația relației I = bc este respectată destul de strict. Se măsoară semnalul analitic din mai multe probe standard sau soluții și se calculează b=I st /s st; dacă c st se măsoară în mol / l, atunci b este o proprietate molară.
3) Metoda adăugărilor. Se măsoară intensitatea semnalului analitic al probei I x , iar apoi intensitatea semnalului probei cu o adăugare cunoscută a soluției standard I x+stt .
4) Metode de titrare. Se măsoară intensitatea semnalului analitic I în funcție de volumul V al titrantului adăugat. Conform curbei de titrare I=f (V), se găsește punctul de echivalență și se calculează rezultatul folosind formulele uzuale de analiză titrimetrică.
Metodele fizico-chimice de analiză sunt adesea folosite pentru a determina conținuturi scăzute (de ordinul a 10 -3% sau mai puțin), unde metodele chimice clasice de analiză sunt de obicei inaplicabile.
În zona concentrațiilor medii și mari, metodele chimice și fizico-chimice de analiză concurează cu succes între ele, completându-se reciproc. Metodele fizice și chimice de analiză se dezvoltă în direcția căutării de noi proprietăți chimice analitice ale unei substanțe, creșterea preciziei analizei, proiectarea de noi instrumente analitice de precizie, îmbunătățirea metodelor existente și automatizarea analizei.
Metoda turbidimetrică este utilizată pe scară largă pentru a determina turbiditatea apei potabile.
 2.2 Determinarea fotometrică a turbidității apei potabile prin metoda turbidimetrică
2.2 Determinarea fotometrică a turbidității apei potabile prin metoda turbidimetrică
Metoda turbidimetrică este utilizată pentru a analiza suspensii, emulsii, diverse suspensii și alte medii tulburi. Intensitatea unui fascicul de lumină care trece printr-un astfel de mediu scade din cauza împrăștierii și absorbției luminii de către particulele în suspensie.
Metodele turbidimetrice se bazează pe măsurarea intensității luminii care a trecut prin suspensia analizată.
Principalul avantaj al metodei turbidimetrice este sensibilitatea lor mare, care este deosebit de valoroasă în raport cu elementele sau ionii pentru care nu există reacții de culoare.
Acest tip Studiul mediilor tulburi se bazează pe măsurarea modificării intensității fluxului de energie luminoasă care a trecut printr-un sistem dispersat. Modificarea fluxului de energie luminoasă este cauzată atât de absorbție, cât și de împrăștierea acesteia de către un sistem dispersat. Metoda este similară cu metoda colorimetrică, dar în unele cazuri măsurarea poate avea loc în fluxul de „lumină albă” fără utilizarea de filtre.
În ceea ce privește sensibilitatea metodei, comparația dintre nefelometrie și turbidimetrie favorizează nefelometria, deoarece această metodă este mai sensibilă atunci când o cantitate mică de particule în suspensie duce la o creștere vizibilă a semnalului cu fond redus.
Efectul împrăștierii de fundal a fost redus într-un număr de instrumente prin eliminarea măsurătorilor de împrăștiere de 90° și prin scăderea electronică a semnalelor de fundal (nefelometrie de viteză).
 Avantajul analizei turbidimetrice este că măsurătorile pot fi făcute pe aproape orice colorimetru sau fotometru. Creșterea sensibilității studiilor turbidimetrice poate fi realizată prin utilizarea spectrofotometrelor cu detectoare de înaltă calitate.
Avantajul analizei turbidimetrice este că măsurătorile pot fi făcute pe aproape orice colorimetru sau fotometru. Creșterea sensibilității studiilor turbidimetrice poate fi realizată prin utilizarea spectrofotometrelor cu detectoare de înaltă calitate.
Direcțiile fluxurilor de energie luminoasă, explicând principiile studiilor turbidimetrice, sunt prezentate în figură.
Lămpile cu arc cu mercur, lămpile cu tungsten-iod și laserele cu heliu-neon sunt utilizate în mod obișnuit ca surse de lumină. Laserele emit lumină monocromatică concentrată într-un fascicul îngust și intens. Cu toate acestea, laserele sunt foarte scumpe și pot emite un set limitat de lungimi de undă fixe.
Măsurătorile sunt efectuate cu ajutorul fotoelectrocolorimetrelor, iar tehnica de măsurare este similară cu cea a fotometriei. Metoda curbei de calibrare este utilizată pentru a găsi concentrația.
Avantajul metodelor nefelometrice și turbidimetrice
este sensibilitatea lor mare, care este deosebit de valoroasă în cazul elementelor determinante care nu prezintă reacții de culoare. Eroarea de măsurare în metodele turbidimetrice este însă ceva mai mare decât în metodele fotometrice, ceea ce este asociat cu dificultăți în obținerea suspensiilor cu aceleași dimensiuni ale particulelor, stabilitate în timp etc. Determinarea turbidimetrică a ionilor sulfat se bazează pe măsurarea intensității turbidității a soluții care conțin sulfați la adăugarea de clorură de bariu.
Densitatea optică a soluțiilor este măsurată la 315 nm. Dependență liniară densitatea optică asupra concentrației de sulfați se observă în intervalul 0 - 50 mg / dm 3
Ionii de sulfat sunt precipitați ca sulfat de bariu într-un mediu clorhidric. Pentru a stabiliza suspensia de BaSO4, se introduce glicerol sau etilenglicol în amestecul de reacție și pentru a reduce solubilitatea sulfatului de bariu - etanol.
Determinarea este împiedicată de substanțe în suspensie, colorate, opalescente, precum și de acid silicic la o concentrație mai mare de 200 mg/dmSi, ceea ce este puțin probabil pentru apele cu conținut scăzut de sulfați.
Efectul de interferență al substanțelor în suspensie și coloidale este eliminat prin filtrarea preliminară a probei printr-un filtru cu membrană cu diametrul porilor de 0,45 µm. Efectul substanțelor opalescente și al culorii scăzute este luat în considerare prin măsurarea densității optice intrinseci a probei,
acid acidificat. Efectul de culoare ridicată datorită prezenței substanțelor humice este eliminat prin tratarea probei cu cărbune activ.
Posibilitatea precipitarii altor anioni (carbonati, fosfati, sulfiti) prin clorura de bariu se elimina in timpul analizei prin acidificarea probei.
Măsurați intensitatea fiecărei lumini împrăștiate (nefelometrică
varianta), sau lumina care trece printr-un mediu tulbure (varianta turbidimetrica). Conținutul de ioni sulfat este determinat prin metoda curbei de calibrare.
Pentru a prepara o soluție standard, aveți nevoie de următoarele: soluție de acid clorhidric (1:1). Acid clorhidric concentrat de 50 cm3 se amestecă cu apă bidistilată de 50 cm3. Soluția este stabilă.
Soluție de clorură de bariu, 5%. 6,2 g de clorură de bariu BaCI2.2H20 se dizolvă în 100 cm3 de apă bidistilată.
soluție precipitantă. 50 cm3 dintr-o soluţie de clorură de bariu 5% se amestecă cu 150 cm3 de glicerol sau etilenglicol şi 150 cm3 de alcool etilic într-un balon conic de 500 cm3. Valoarea pH-ului soluției se ajustează la aproximativ 3 cu o soluție de acid clorhidric 1:1 și se lasă 1-2 zile într-un loc întunecat, acoperind balonul cu un geam de ceas. După decantare, soluția de precipitare este turnată într-un balon întunecat cu dop măcinat. Dacă la fundul balonului se formează un precipitat în timpul depunerii, transferul reactivului în balon trebuie efectuat cu atenție, astfel încât precipitatul să rămână în balon. Soluția de precipitare este potrivită pentru cel mult 3 luni.
Pentru a construi un grafic de calibrare, se introduce 0 în baloane cotate cu o capacitate de 50 cm 3 folosind pipete gradate cu o capacitate de 1, 5 și 10 cm 3; 0,6,; 1,0; 20; 3,0; 4^0; 6,0; 8,0; 10,0 cm 3 dintr-o soluție de sulfat de potasiu cu o concentrație în masă de ioni sulfat de 0,250 mg/cm 3 . Volumele soluțiilor se ajustează la semnele de pe baloane cu apă bidistilată, amestecată. Calculați concentrațiile rezultate. 5 cm din fiecare dintre soluţiile preparate se pun în baloane conice cu o capacitate de 50 cm 3 şi se adaugă 1 picătură dintr-o soluţie de acid clorhidric 1:1. Cu agitare continuă, se toarnă 5 cm 3 din soluția de precipitare în fiecare balon și se continuă agitarea conținutului pentru încă 10-15 s. După 40 ± 5 min, absorbanța soluțiilor se măsoară într-o cuvă de 2 cm și absorbanța martorului se scade din absorbanța soluțiilor care conțin sulfați.
Dependența de calibrare este construită în coordonatele: densitate optică - concentrația ionilor sulfat în mg/DM 3 și calculată prin metoda celor mai mici pătrate.
Pentru determinarea ionilor sulfat. Se iau 5,0 ml de apă analizată într-un balon conic uscat
cu o capacitate de 50 ml 3 sau o eprubetă cu dop de pământ cu o capacitate de 10-
15 cm, se adaugă 1 picătură de acid clorhidric 1:1 și se amestecă.
După 1-2 minute, cu agitare continuă, se toarnă 5 cm 3 din soluția precipitantă în balon și se continuă agitarea conținutului pentru încă 10-15 s. După 40 g 5 min, densitatea optică a probei este măsurată la 315 nm într-o cuvă de 2 cm lungime în raport cu apa distilată. În același timp, se analizează o probă martor folosind 5 ml apă bidistilată.
Pentru calcul, se calculează valoarea densității optice Dx, corespunzătoare concentrației de sulfați din proba inițială conform formulei:
A \u003d A - Ai -A 2,
Unde
A - valoarea densității optice a probei obținute în timpul determinării;
Ai este valoarea densității optice intrinseci a probei;
A 2 - valoarea densității optice a unei probe martor.
În funcție de dependența de calibrare se găsește concentrația de masă a sulfaților din proba de apă analizată, corespunzătoare valorii obținute a densității optice A.
Pentru determinarea ionilor de sulfat sunt necesari urmatorii reactivi: o solutie de acid clorhidric (1:1) 50 cm 3 de acid clorhidric concentrat se amesteca cu 50 cm 3 de apa bidistilata. Soluția este stabilă. Soluţie de clorură de bariu, 5% 6,2 g de clorură de bariu BaCI2.2H2O se dizolvă în 100 cm3 apă bidistilată. Soluție precipitantă: 50 cm3 dintr-o soluție de clorură de bariu 5% se amestecă cu 150 cm3 de glicerol sau etilenglicol și 150 cm3 de alcool etilic într-un balon conic de 500 cm3. Valoarea pH-ului soluției se ajustează la aproximativ 3 cu o soluție de acid clorhidric 1:1 și se lasă 1-2 zile într-un loc întunecat, acoperind balonul cu un geam de ceas.
După decantare, soluția de precipitare este turnată într-un balon întunecat cu dop măcinat.
Dacă la fundul balonului se formează un precipitat în timpul depunerii, transferul reactivului în balon trebuie efectuat cu atenție, astfel încât precipitatul să rămână în balon. Soluția precipitantă este adecvată pentru cel mult 3 luni, iar pentru a construi un grafic de calibrare se introduce 0 în baloane cotate cu o capacitate de 50 cm 3 folosind pipete gradate cu o capacitate de 1, 5 și 10 cm 3; 0,6,; 1,0; 20; 3,0; 4^0; 6,0; 8,0; 10,0 cm 3 dintr-o soluție de sulfat de potasiu cu o concentrație în masă de ioni sulfat de 0,250 mg/cm 3 . Volumele soluțiilor se ajustează la semnele de pe baloane cu apă bidistilată, amestecată. Calculați concentrațiile rezultate. 5 cm din fiecare dintre soluţiile preparate se pun în baloane conice cu o capacitate de 50 cm 3 şi se adaugă 1 picătură dintr-o soluţie de acid clorhidric 1:1. Cu agitare continuă, se toarnă 5 cm 3 din soluția de precipitare în fiecare balon și se continuă agitarea conținutului pentru încă 10-15 s. După 40 ± 5 min, se măsoară densitatea optică a soluțiilor într-o cuvă de 2 cm lungime.
Densitatea optică a experimentului martor este scăzută din densitatea optică a soluțiilor care conțin sulfați.
Determinarea turbidimetrică a calciului se bazează pe precipitarea calciului sub formă de oxalat și măsurarea intensității luminii transmise printr-o soluție care conține o suspensie de CaC 2 O 4 . Prezența etanolului crește sensibilitatea metodei.
Următorii reactivi sunt necesari pentru determinarea calciului: carbonat de calciu CaCO 3 (c), uscat la 110 ° C, oxalat de amoniu (NH 4) 2 C 2 O 4 H 2 O, soluție 0,25 M, acid clorhidric HC1, soluție 2M.
Pentru prepararea unei soluții standard de calciu, se calculează o porție de CaCO 3, care este necesară pentru prepararea a 100 ml din soluția standard inițială cu un titru de calciu T Ca \u003d 1 10 ~ 3 g / ml.
 O probă de CaCO 3 apropiată de cea calculată se cântărește pe o balanță analitică într-un pahar cu o capacitate de 50 ml și se dizolvă cu grijă în 10 ml soluție HC1, adăugând acid treptat, în porții mici. Se transferă cantitativ soluția rezultată într-un balon cotat de 100 ml și se diluează până la semn cu apă.
O probă de CaCO 3 apropiată de cea calculată se cântărește pe o balanță analitică într-un pahar cu o capacitate de 50 ml și se dizolvă cu grijă în 10 ml soluție HC1, adăugând acid treptat, în porții mici. Se transferă cantitativ soluția rezultată într-un balon cotat de 100 ml și se diluează până la semn cu apă.
O soluție standard diluată de calciu cu un titru de calciu T Ca = 1 10 ~ 4 g/ml (soluția 2) se prepară prin diluarea soluției inițiale cu apă de 10 ori.pipetează diverse (de la 1 la 10 ml) volume ale unui standard diluat. se adaugă soluție de sare de calciu (soluția 2) și conținutul baloanelor se aduce la semn cu apă. (Soluțiile se recomandă a fi preparate la intervale de 5 minute.
Pentru a crește sensibilitatea determinării, în fiecare balon se pot adăuga 5-10 ml de alcool etilic.)
Soluțiile se amestecă, se toarnă alternativ în cuva unui dispozitiv optic (I = 3 cm când se lucrează la un colorimetru fotoelectric), iar la 5 minute de la preparare se măsoară densitatea optică relativ la apă cu un filtru de lumină verde. Pe baza datelor obținute, se construiește un grafic de calibrare în coordonatele densității optice-concentrație de calciu.
Pentru determinarea calciului, soluția de testat se pune într-un balon cotat de 100 ml, se diluează până la semn cu apă și se amestecă bine. Se pipetează 10 ml din soluția rezultată într-un balon cotat cu o capacitate de 50 ml.
Adăugați 10 ml de soluție de oxalat de amoniu, alcool etilic (dacă a fost adăugat la construirea graficului de calibrare) din biuretă și aduceți soluția la semn cu apă. La 5 minute de la preparare, se măsoară densitatea optică și se găsește concentrația de calciu din grafic.
solutie investigata. Calculați masa de calciu din proba soluției de testat.
2.3 Reactivi. Materiale. Echipamente
Fotoelectrocolorimetru KFK-2;
Cuve cu o grosime a stratului de absorbție a luminii de 50 și 100 mm;
Cantare de laborator, clasa de precizie 1, 2;
dulap de uscare: centrifuga;
Creuzete din porțelan;
Dispozitiv de filtrare prin filtre membranare cu pompa cu jet de apa;
Pipete măsurate, cu o capacitate de 25, 100 ml;
Suspensia ar trebui să conțină aproximativ 4g/dm 3 caolin.Caolin îmbogățit pentru industria parfumurilor;
Pirofosfat de potasiu
pirofosfat de sodiu,
sulfat de hidrazină,
hexametidentetramină pentru monocristale,
clorura de mercur,
formol,
cloroform;
Filtre cu membrană;
Turbiditatea se determină nu mai târziu de 24 de ore după prelevare. Proba poate fi conservată prin adăugarea a 2-4 ml de cloroform la 1 litru de apă. Turbiditatea apei se determină fotometric prin compararea probelor de apă investigată cu suspensii standard.
Suspensiile standard pot fi făcute din caolin sau tripoli. Soluțiile standard sunt pregătite în conformitate cu Proba Standard de Stat (GSO - conceput pentru calibrarea și verificarea instrumentelor analitice, controlul erorilor metodelor de măsurare (MVI), certificarea MVI nou dezvoltat pentru conținutul de anioni din mediile de apă și aer, sol și deșeuri ).
Prepararea unei probe standard (CO- constă în prepararea preliminară a suspensiilor de calibrare din aceasta prin metoda diluției volumetrice). Suspensiile din CO ar trebui preparate la o temperatură de 20-25 de grade. În timpul preparării suspensiei, schimbările de temperatură nu sunt permise. mediu inconjurator peste 20 de grade.
Un volum de până la 50 cm 3 dintr-o soluție de 2,5 g de hexametilentetramină (CH 2 ) 6 N 4 se diluează într-un balon cotat cu o capacitate de 500 cm 3 în 25 cm 3 de apă distilată 25 cm 3 de soluție A este adăugat la soluție.
Pentru a prepara suspensii standard de lucru din caolin de turbiditate, suspensia standard principală este agitată și din aceasta se prepară o suspensie care conține 100 mg/dm3 de caolin. Din suspensia intermediară se prepară suspensii de lucru cu o concentrație de 0,5; 1,0; 1,5; 2,0; 3,0; 4,0; 5,0 mg/dm 3. Suspensia intermediară și toate suspensiile de lucru se prepară cu apă bidistilată și se păstrează cel mult o zi.
Pentru a prepara suspensia standard principală de formazină I, care conține 0,4 UI în 1 cm 3, se ia soluția A. 0,5 g de sulfat de hidrazină (NH 2) 2 H 2 SO 4 se dizolvă în apă distilată și se ajustează la B și se păstrează (24 ± 2) h la o temperatură de (25 ± 5) °C. Apoi adăugați apă distilată până la semn. Principala suspensie standard de formazină se păstrează timp de 2 luni și nu necesită conservare și stabilizare.
Pentru a prepara o suspensie standard de formazină II care conține 0,04 UI la 1 cm3 de soluție, procedați după cum urmează: 50 cm3 dintr-o suspensie standard de formazină bazică bine amestecată se diluează cu apă distilată până la un volum de 500 cm3. Suspensia standard de formazină II se păstrează timp de două săptămâni.
Pentru prepararea suspensiilor standard de lucru de formazin se iau 2,5; 5,0; 10,0; 20,0 cm3 suspensie standard preamestecată de formazin II este ajustată la un volum de 100 cm3 cu apă bidistilată.
 2.4 Efectuarea analizei
2.4 Efectuarea analizei
Pentru prepararea suspensiei standard de bază din caolin se iau 25-30 g caolin, se agită bine cu 3-4 dm 3 de apă distilată și se lasă să stea 24 de ore După 24 de ore, partea neclarificată a lichidului se ia cu un sifon. Se toarnă din nou apă în partea rămasă, se agită energic, se lasă din nou singur timp de 24 de ore și se ia din nou partea din mijloc neclarificată. Această operațiune se repetă de trei ori, adăugându-se de fiecare dată suspensia care nu a fost clarificată în timpul zilei la cea colectată anterior. Suspensia acumulată este agitată bine și după trei zile lichidul de deasupra sedimentului este drenat, deoarece conține particule prea mici.
La precipitatul obţinut se adaugă 100 cm 3 de apă distilată, se agită şi se obţine o suspensie standard bazică. Concentrația suspensiei principale se determină prin metoda greutății (cel puțin din două probe paralele): 5 cm 3 din suspensie se pun într-un creuzet adus la greutate constantă, se usucă la o temperatură de 105 ° C până la greutate constantă, se cântărește si se calculeaza continutul de caolin la 1 dm 3 de suspensie .
Apoi, suspensia standard principală este stabilizată cu pirofosfat de potasiu sau de sodiu (200 mg per 1 dm 3) și conservată cu o soluție saturată de clorură de mercur (1 cm 3 pe 1 dm 3), formol (10 cm 3 per 1 dm 3) sau cloroform (1 cm 3 la 1 dm 3).
Suspensia standard principală este păstrată timp de 6 luni. Aceasta este principala apă standard de testare din care solidele în suspensie au fost îndepărtate prin centrifugare sau filtrare prin filtre cu membrană.
Pentru a construi un grafic de calibrare, sunt luate suspensii standard de lucru. Valorile obținute ale densităților optice și concentrațiile corespunzătoare ale suspensiilor standard (mg/l) sunt reprezentate pe un grafic.
Înainte de testare, pentru a evita erorile, fotocolorimetrele sunt calibrate față de suspensii standard de turbiditate lichidă sau față de un set de suspensii standard de turbiditate solide cu densitate optică cunoscută.
O probă de test bine agitată este introdusă într-o cuvă cu o grosime a unui strat de absorbție a luminii de 5-10 cm, iar densitatea optică este măsurată în partea verde a spectrului. Lichidul de control este apa de testare din care solidele în suspensie au fost îndepărtate prin centrifugare sau filtrare prin filtre cu membrană.
2.5 Rezultate de manipulare
Volumul CO, Vco, cm 3 se calculează prin formula:
Vco \u003d X * Vk 1Xco
X este valoarea turbidității preparată prin suspensii, NMF;
Xco - valoarea de turbiditate certificată a CO, NMF;
Vk - volumul folosit de balonul cotat, cm 3
Soluție nr. 1-1 cm 3 GSO apă potabilă până la 1000 cm 3
1cm 3 \u003d 4 EMF
Soluție nr. 2-1 cm 3 soluție nr. 1 apă de băut până la 1000 cm 3
1cm 3 \u003d 0,04 UMF
Soluția Vcm 3 nr. 2 + apă potabilă până la 1000 cm 3 à și faceți o analiză pentru KFK-2
Turbiditatea este determinată de formula:
2.6 Concluzie
Apa de băut trebuie să fie sigură din punct de vedere epidemic, inofensivă în compoziția chimică și să aibă proprietăți organoleptice favorabile.
Calitatea apei este determinată de compoziția și proprietățile acesteia atunci când intră în rețeaua de alimentare cu apă; la punctele de captare a apei din reteaua de alimentare cu apa externa si interna.
Indicatori microbiologici. Epidemiologic, siguranța apei este determinată de numărul total microorganismele și numărul de bacterii din grupul Escherichia coli.
Potrivit indicatorilor microbiologici, apa potabilă trebuie să îndeplinească cerințele.
Indicatorii toxicologici ai calității apei caracterizează caracterul inofensiv al acesteia. compoziție chimicăși includ standarde pentru substanțe:
apărute ca urmare a poluării industriale, agricole, casnice și de altă natură a surselor de alimentare cu apă.
Concentraţie substanțe chimice găsite în apele naturale sau adăugate în apă în timpul prelucrării acesteia nu trebuie să depășească standardele.
Indicatorii organoleptici care oferă proprietăți organoleptice favorabile ale apei includ standarde pentru substanțe:
găsit în apele naturale;
adăugat în apă în timpul procesării sub formă de reactivi;
rezultate din industria, agricola si poluarea gospodărească surse de alimentare cu apă.
 Concentrațiile de substanțe chimice care afectează proprietățile organoleptice ale apei, găsite în apele naturale sau adăugate în apă în timpul procesării acesteia, nu trebuie să depășească standardele.
Concentrațiile de substanțe chimice care afectează proprietățile organoleptice ale apei, găsite în apele naturale sau adăugate în apă în timpul procesării acesteia, nu trebuie să depășească standardele.
Apa nu trebuie să conțină organisme acvatice vizibile cu ochiul liber și nu trebuie să aibă o peliculă la suprafață.
Concentrații chimice , prezent în apă ca urmare a poluării industriale, agricole și casnice, nu trebuie să depășească MAC aprobat de Ministerul Sănătății al URSS pentru apa corpurilor de apă potabilă și potabilă. utilizarea culturală și comunitară a apei privind caracteristicile organoleptice și sanitar-toxicologice, precum și standardele de radioprotecție NRB-76/87. Dacă în apă se găsesc astfel de substanțe chimice cu același semn limitativ de nocive, suma raporturilor dintre concentrațiile detectate în apă și MPC-ul lor nu trebuie să fie mai mare de 1.
Apa de băut este apa care este destinată consumului zilnic nerestricționat și sigur de către oameni și alte ființe vii. Principala diferență față de cantine și ape minerale este un conținut scăzut de sare (reziduu uscat), precum și prezența standardelor existente pentru compozitia generala si proprietati.
Se verifică mirosul, gustul, turbiditatea, culoarea, duritatea apei potabile, aceasta fiind comună pentru toate tipurile de apă.
Turbiditatea apei este un indicator care caracterizează o scădere a transparenței apei datorită prezenței suspensiilor fine anorganice și organice.
Concluzie: rezultatele analizei sunt satisfăcute, deoarece îndeplinesc standardele de toleranță (vezi Anexa 4).
3.Concluzie
Probabil că toată lumea știe asta corpul uman Pentru viața normală, în primul rând, este nevoie de apă potabilă curată. Apa este principalul mijloc de a furniza micronutrienți în toate părțile corpului nostru. Apa de băut pură este indispensabilă în procesele de creștere și nutriție a organismului, apa potabilă pură asigură un nivel stabil de temperatură în organism, iar în cazuri de nevoie, este apa care poate umple resursele lipsă, dar vitale din organism și înlocuiți-le pentru o vreme.
În ritmul rapid al vieții noastre, destul de des corpul se confruntă cu o lipsă de echilibru a apei în organism. Acest lucru se manifestă în sete ușoară, dar cel mai adesea din cauza cluster mare treburilor, nu acordăm atenție acestui sentiment, mai ales dacă nu există nicio sursă de apă la îndemână. Iar consecințele lipsei de lichid din organism se reflectă foarte deplorabil asupra sănătății noastre: de îndată ce organismul încetează să mai aibă suficientă apă, se rătăcesc toate ciclurile fiziologice, acele resurse pe care organismul le rezervă pentru o „zi ploioasă” sau mai ales Situații de urgență. Corpul a găsit apă, dar pentru a compensa resursa lipsă cheltuită cu apă - organismul încearcă să o reînnoiască cât mai repede posibil, și chiar cu o marjă - de unde și greutatea suplimentară „pe față”, și nu numai pe fata, dar pe tot corpul. Aceasta nu este singura consecință a „setei ușoare”: mecanismele de digestie, metabolism, circulație sanguină și chiar activitatea creierului. Toate acestea amenință cu suprasolicitare, pierderea atenției, dureri de cap. Dar asta nu este tot. Dacă organismul nu primește în mod regulat suficientă apă în perioada activă a zilei, aceasta amenință cu eșecuri grave în aproape toate sistemele corpului, ca urmare, lipsa de apă duce nu numai la agravarea „punctelor slabe” din corpul nostru, dar şi la apariţia unor noi afecţiuni. Apa curată, așa cum am menționat deja, este de mare importanță în viata umana, viata animala,  florăși natura în general. Capacitatea tuturor celulelor vii depinde de disponibilitatea apei. Explorând rolul pe care apa îl joacă pentru o persoană, se poate observa că întregul nostru organism este o colecție de soluții apoase, coloizi, suspensii și alte sisteme complexe de apă.
florăși natura în general. Capacitatea tuturor celulelor vii depinde de disponibilitatea apei. Explorând rolul pe care apa îl joacă pentru o persoană, se poate observa că întregul nostru organism este o colecție de soluții apoase, coloizi, suspensii și alte sisteme complexe de apă.
Apa îmbogățește celulele corpului nutrienți(vitamine, saruri minerale) si elimina deseurile (zgura). În plus, apa este implicată în procesul de termoreglare (transpirație) și în procesul de respirație (o persoană poate respira aer foarte uscat, dar relativ puțin timp). Pentru funcționarea normală a tuturor sistemelor, o persoană trebuie să bea cel puțin 1/5 litru de apă pe zi.
Drept urmare, apa curată consumată de o persoană este necesară pentru buna funcționare a acesteia. Prin urmare, principala problemă a nutriției noastre este utilizarea regulată a apei prin introducerea acesteia în organism într-o formă liberă și în alimente, precum și utilizarea obligatorie a exact apă curată. Prin urmare, apa de băut trebuie purificată. Testul de turbiditate a apei potabile este, de asemenea, o parte integrantă care curăță apa și verifică calitatea.
Turbiditatea apei este un indicator care caracterizează o scădere a transparenței apei din cauza prezenței suspensiilor fine anorganice și organice, precum și a dezvoltării organismelor planctonice. Motivele turbidității apei pot fi prezența nisipului, argilei, compușilor anorganici (hidroxid, aluminiu, diverși carbonați, metale), precum și a impurităților organice sau a viețuitoarelor, precum bacterio-fito- sau zooplancton.
Astfel in termen de hârtie reflectă valoarea indicatorului de calitate definiția apei potabile turbiditate.
4. Literatură
Rezumate:
Rezumat după disciplină: " Chimie analitică»
Rezumat după disciplină: " Analiza tehnica»
Rezumat pe discipline: „Metode fizice și chimice de analiză”
Rezumat pe discipline: „Analiză spectrală”
„Fundamentele analizei tehnice”. Pisarenko V.V. și Zaharov L,S. Editura " facultate". Moscova 1972
„Analiza tehnică a controlului”. Avgustinovici I.V., Andrianova S.Yu. Moscova. Centrul de editare „Academia” 2010
„Pregătirea industrială a asistenților de laborator ai chimiștilor”. Gurvich Ya.A. Moscova. „Liceu” 1987
„Fundamentele chimiei analitice”. Cartea 1. Ivanov V.M. Garmash A.V
Dorolova Yu.A. Moscova. „Liceu” 2004
"Chimie analitică". A.A. Iscenko. Moscova. Centrul de editare „Academia” 2012
GOST 3351-74 Apă de băut. Metode de determinare a gustului, mirosului, culorii și turbidității;
GOST 4192-82 Apă de băut. Metode de determinare minerale
GOST 2874-82 Apă de băut. Cerințe de igienăși controlul calității apei.
Articole de chimie analitică, programe, anunțuri.
Chemical Forum Chemforum.ru conține informații despre industria chimica Rusia și CSI. Este un centru divers de informare pentru întreprinderile din industria chimică și industriile conexe din Rusia și CSI.
chem.msu.su - pe site-ul „Știința chimică și educația în Rusia”: „ Biblioteca digitalaîn Chimie” - chem.msu.su (secțiunea „Materiale pentru școlari”) și „Învățământul școlar de chimie în Rusia: standarde, manuale, olimpiade, examene” - chem.msu.su (Materiale pentru profesori și școlari).
school-sector.relarn.ru - „Chimie pentru TOȚI” din seria „Enciclopedii educaționale”.
 Stat Regional Autonom instituție educațională
Stat Regional Autonom instituție educațională
mijloc învăţământul profesional
„Colegiul Industrial Starooskol”
LUCRARE DE CURS
La disciplina „Metode fizico-chimice de analiză”
„Determinarea fotometrică a turbidității apei potabile prin metoda turbidimetrică”
KR. 240308.4979.00.00.PZ
Completat de un student Trebunskikh Olga Mihailovna
grup AK 44 specialitate" Controlul analitic al calității compuși chimici »
Protejat cu un rating de _____________
Manager de proiect __________ "___" ________ 2014 Semerdzhieva E.V.
